細胞および組織メカノでのアプリケーションのためのプラットフォームをストレッチ小説
Summary
我々は、この資料に複雑な異方性軸の機械的変形に単一細胞応答を調査し、生物学的組織の機械的特性を定量化するために使用することができる新規な延伸プラットフォームを提示する。
Abstract
細胞や組織、またはそれに機械的な力の適用は、生体組織の機械的特性を定量化することができるためのツールは、基本的なメカノの理解に劇的に貢献してきた。これらの技術は、広く様々な疾患の発症および進行を頻繁に機械的な手がかりの影響を受けているかを示すために使用されている。この記事では、機械的に、単一の細胞を刺激するか、組織の機械的剛性を定量化するか多機能二軸延伸(BAXS)プラットフォームを提供します。 BAXSプラットフォームは独立して制御することができる4つのボイスコイルモータで構成されている。単一細胞ひとつ、複雑な動的、および空間的に変化する歪み場に細胞を露出することを可能にモータに取り付けることができるフレキシブル基板上に培養することができる。逆に、力ロードセルを組み込むことによって、人はまた、それらが変形サイクルにさらされているように、一次組織の機械的特性を定量化することができる。両方の場合において、クランプの適切なセットを設計しなければならないし、しっかりとフレキシブル基板または目的の組織を保持するためにBAXSプラットフォームモータに取り付けられた。 BAXSプラットフォームは、延伸実験の間、試料の構造的または生化学的反応を調べるために同時の透過光および/または蛍光イメージングを実行するために倒立顕微鏡に装着することができる。この記事ではBAXSプラットフォームの設計と使用法の実験の詳細を提供し、単一の細胞や組織全体の研究の結果を提示します。 BAXSプラットフォームは、歪みを基板へと単離したマウス大動脈の剛性を測定するために応じて、単一のマウス筋芽細胞における核の変形を測定するために使用した。 BAXSプラットフォームは、細胞内、細胞および全組織レベルでの新たなmechanobiologicalな洞察を提供するために、様々な光学顕微鏡法と組み合わせることができる汎用性の高いツールです。
Introduction
機械的な微小環境は、組織の発生及び恒常性にし、また疾患1-6に大きな影響を与えるような、増殖、遊走、および分化のような多くの細胞機能において重要な役割を果たしている。長年にわたって、多数の実験的なツールは、機械的に細胞または組織を刺激し、基本的なメカノの我々の理解を高め、疾患6-17の発症および進行を研究することを目的として生体組織の機械的特性を測定するために使用されてきた。しかし、一つは、多くの場合、特定の研究の目標を達成するために、いくつかの異なる実験のデバイスに依存しなければならない。この記事では、機械的特性や機械的な力を全組織長さスケールに細胞内で生物学に果たす役割を調べる研究を可能にし、単一の、多機能、二軸延伸(BAXS)プラットフォームを提供します。 BAXSプラットフォームはquantificatioのためにできるだけでなく単離された組織の機械的特性のn個ではなく、単純に適用する能力を容易にし、複雑で、動的歪み場すなわちインビボで起こる延伸への応答を理解するために、生きた細胞である。 BAXSプラットフォームは、細胞や組織に機械的試験と摂動中に生細胞顕微鏡を実行する能力を維持している。
BAXSプラットフォームは、細胞レベルでの基板変形の影響を調査し、生物学的組織( 図1A)上に引張試験を行うために使用することができる特注の装置である。アルミニウムヒーターは、標準的な10cmのペトリ皿を収容し、温度制御器およびカプトンヒーター( 図1B)を用いて、37℃で、任意の生理学的溶液を維持するように作製した。このBAXSプラットフォームは、倒立位相差顕微鏡および/ または蛍光顕微鏡上に集積し、同時イメージング( 図1C)を可能にすることができる。要するに、BAXSプラットフォームは、可動部品が直交する二軸( 図1D)に沿って配向されたスライド軸受ミニチュア直動ボールに搭載された4本の直線状のボイスコイルモータで構成されている。線形位置決めステージ( 図1E)に使用されるクランプシステムの垂直移動を可能にするために4つのモータのそれぞれに取り付けられている。各モータの位置は、500nmの分解能( 図1F)を有する光学式エンコーダによって監視される。すべての4つのモータは、独立して動作コマンド( 図1G)を実行するための光学エンコーダフィードバックを用いたモーションコントローラで制御される。 LabVIEWのインターフェースは、細胞または組織試料の、完全にカスタマイズ可能な静的および動的変形を生成するために、変位量、速度、及び各モータの加速度を完全に制御できる。
細胞における変形を誘導するために使用される技術は、単にallowinにより達成されるG細胞は、しっかりと柔軟で透明基材に付着した後、BAXSプラットフォームの4つのモータを使用して、この基板を延伸。 BAXSプラットフォームは、ボイスコイルモータ基板を取り付けるクランプのいずれかのカスタム設計されたセットの装着を可能にする。この目的のために、我々は、ポリジメチルシロキサン(PDMS)からなる可撓性透明基板は、( 図2A-C及び図3)を結合させることができるクランプのセットを設計した。クランプは生理学的溶液に暴露されるように、すべての部品は、滅菌を可能にするために、ステンレス鋼から機械加工した。これらのクランプは慎重に( 図2D)が延伸中に基板へのストレスを最小限に抑えつつ、画像品質を向上させるために顕微鏡対物レンズにできるだけ近接して基材をもたらすように設計されている。
同じBAXSプラットフォームは、ADAPとクランプの適切なセットを用いて、小さな組織試料の剛性を定量化するために使用することができるテッドは軍を監視するための組織サンプルとロードセルのためサポートしています。いくつかのアプローチがBAXSプラットフォームモータに組織をマウントするために撮影することができます。この場合には、ステンレス鋼昆虫minutiensピンは、引張試験( 図4A-B)を実行するために、血管組織の開口部を通してフックできる。代替的に、自然の開口部のない厚さの組織について、組織の縁部は、いずれかのボイスコイルモータに取り付けられた、または生物学的接着剤の小さなガラススライドに接着し、クランプでモータに取り付けられたクランプを所定の位置に保持することができる。引張りを行うために、小型ロードセルが必要とされるテストし、容易にBAXSプラットフォームモータに組み込ま延伸サイクル( 図4C)の間に組織に作用する力を測定するために使用することができる。 BAXSプラットフォームは4つのモータから構成されているように、第二のロードセルの導入は、いずれか2つの直交方向に沿って引張試験を行うことができる。この能力は、1がquantifすることができますYと同じ実験中の2つの垂直な方向に沿った単一組織の機械的剛性。
重要なことに、すべての構成で、目的の細胞または組織サンプルは、常にユーザがアクセス可能な恒温槽内に維持される。この能力は、試料の時間応答を調べるために、延伸試料中の薬理学的物質の導入を可能にする。倒立顕微鏡の光軸が遮られないままであるさらに、顕微鏡のすべての形態は、まだユーザーが使用できる。 BAXSプラットフォームのすべての4つのモータが独立しているように、最終的に、関心対象の試料に高度に構成可能な歪み場を適用することが可能である。 インビボ細胞および組織が 暴露された複合体とは対照的に、それはこのプラットフォームでは、より適切に模倣することができる延伸異方性伝統的な一軸延伸プラットフォーム7,13,15,18,19へ。また、物理的特性歪み場の実験中にオンザフライで変更することができる。これらの能力は、ユーザが時間的に非常に複雑な、異方性の広い数、および空間的に変化する歪み場に対する細胞および組織レベルの応答を調べることを可能にする。この記事では、利点と制限BAXSプラットフォームのだけでなく、その設計、動作原理、および単一セルおよび全組織実験のための実験の詳細を説明しています。

図1。BAXSプラットフォームの概要。 37℃Cで細胞および組織を維持するために使用ペトリ皿加熱ヒータのA)は、4つのボイスコイルモータを示すBAXSプラットフォームの上面図である。B)詳細ピクチャ)プラットフォームは、ライブを実行するために倒立顕微鏡に装着することができるストレッチ実験中の細胞イメージング。D)ボイスコイルモータの詳細な絵;プラットホームの可動部分。E)クランプシステムの垂直方向の変位を可能にする線形位置決めステージの詳細な絵。F)モーションコントローラにモータの実時間位置を提供する光学式エンコーダの詳細な絵。G)詳細画像4つの音声コイルモータ、4つの光エンコーダ入力および電力出力を示すモーションコントローラ。
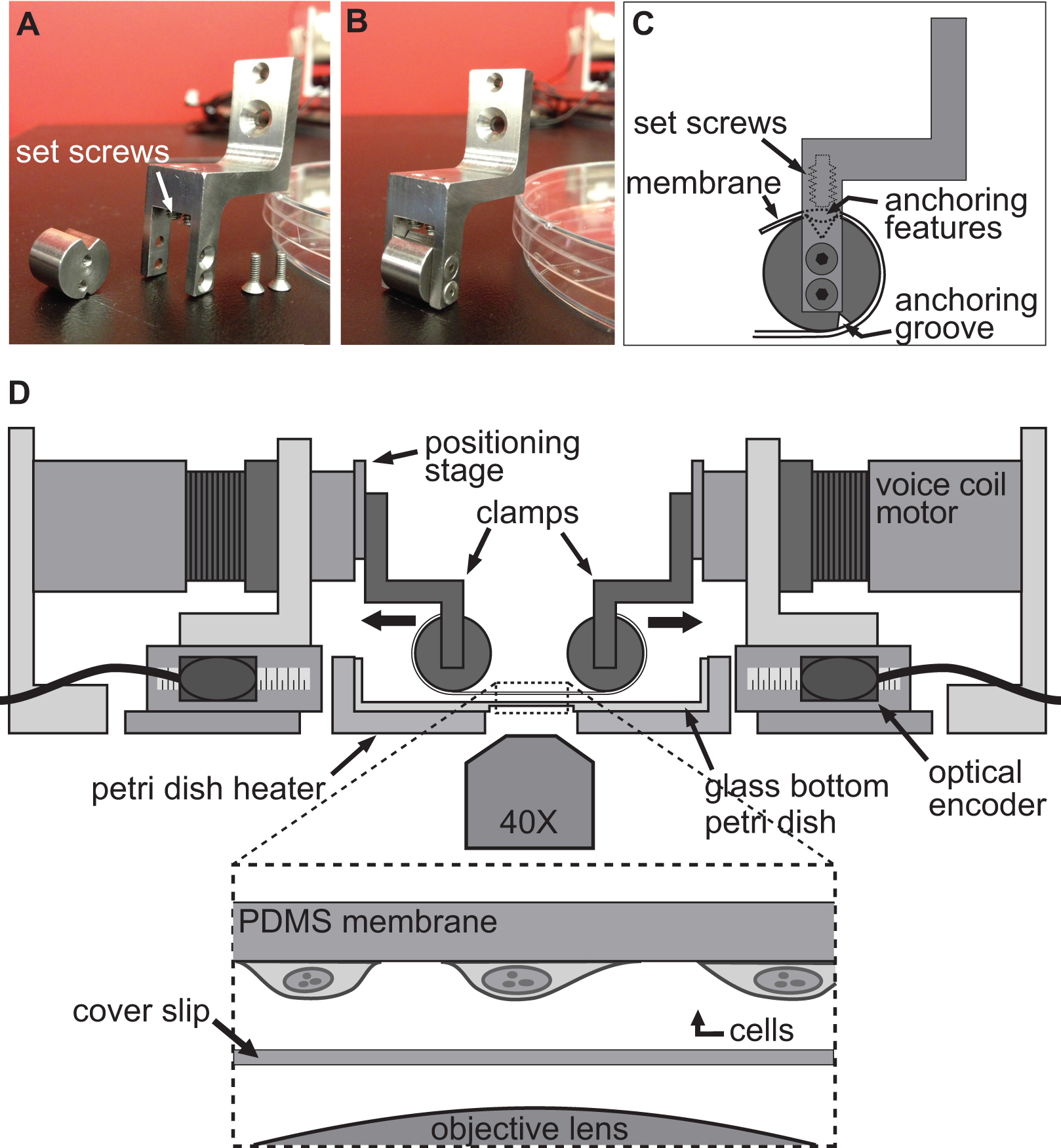
図2。実験を伸ばすセル用のクランプシステム。基板は、そのアンカーfeaturとクランプの円筒部に巻き付けられる。C)を延伸するためのボイスコイルモータにPDMS基板を取り付けるために使用されるクランプの詳細を示すAB)の画像ES上部の溝に座って。次いで、基板を上部溝に特徴をアンカー/基質をプッシュ止めねじを用いて固定されている。クランプが所定の位置に基板を保持するとともにBAXSプラットフォームのD)イラストレーション。挿入図は、それだけでカバースリップと顕微鏡の対物レンズの上に座っているに付着した細胞を有する基板の詳細図を示す。
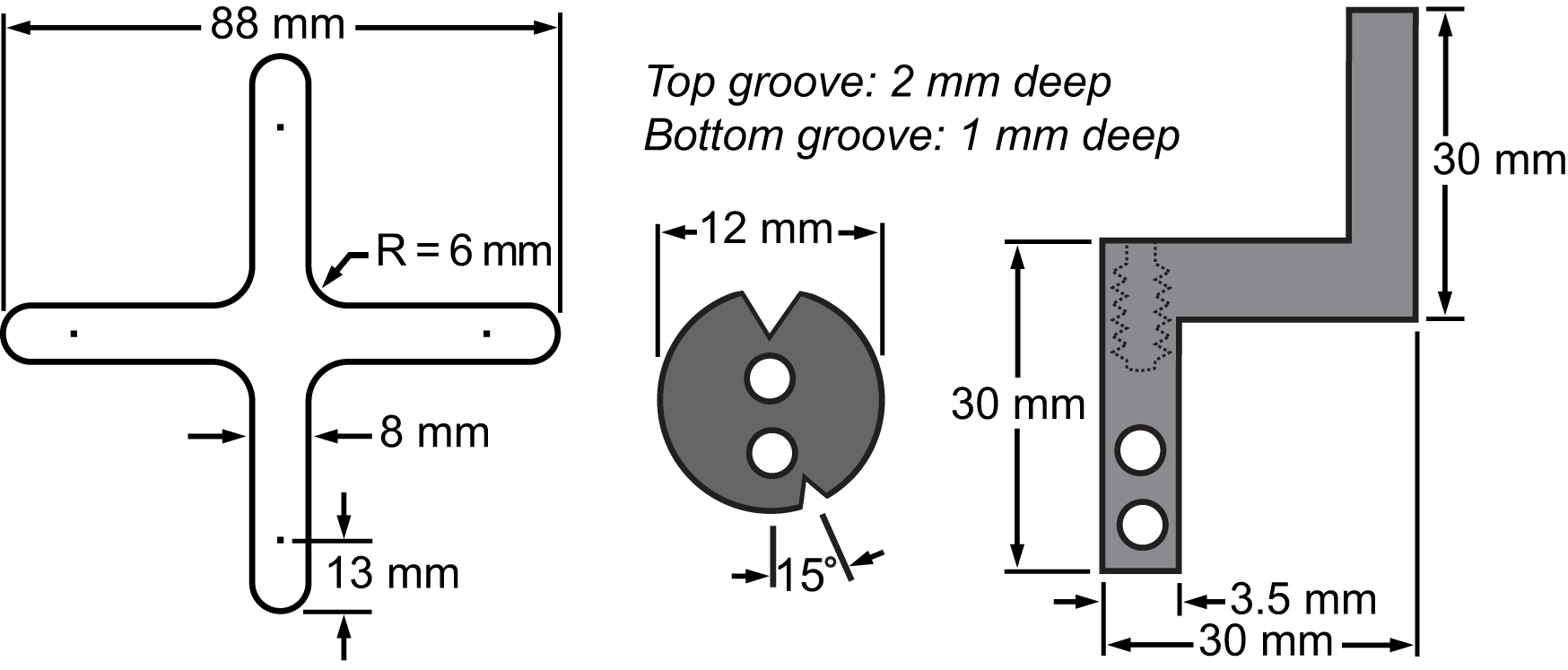
図3膜及びそのクランプシステムの部品表。細胞延伸実験を行うために二軸プラットフォームに集積主要部の寸法を示す図面。
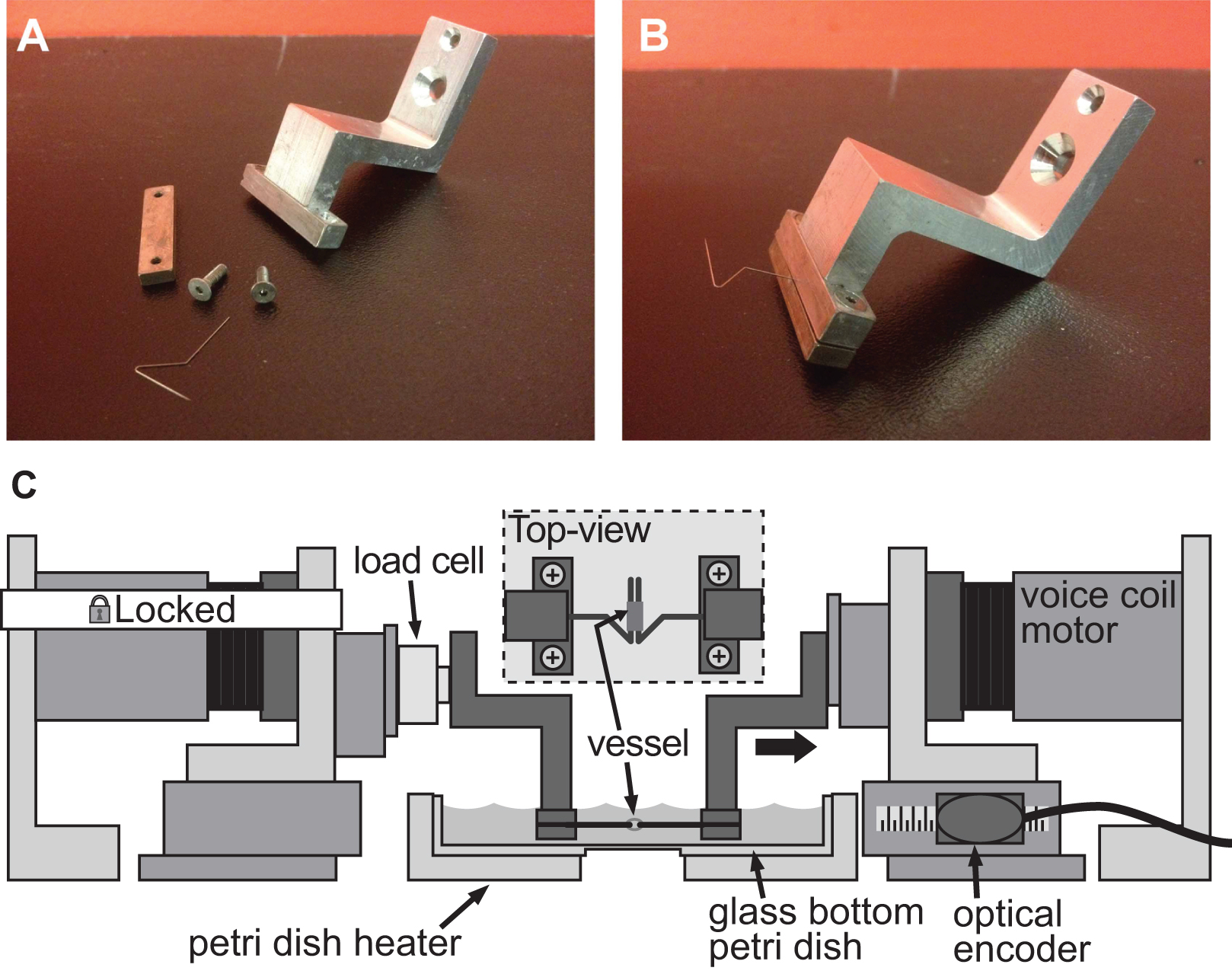
図4。例クランプシステムの小口径血管の剛性評価のためのクランプシステムの十分。AB)の詳細な写真は直径1mm、マウスの大動脈の変形を誘導するために使用。ステンレス製のピンを慎重に船が両方のピンにスライドすることができるように、オープン三角形に成形した。固定されたモータと左クランプとの間に取り付け、容器とロードセルを保持するクランプを備えたBAXSプラットフォームのC)のイラスト。挿入図は、ピンの上に取り付けられた容器の詳細な平面図を示している。
Protocol
Representative Results
Discussion
ここで紹介するBAXSプラットフォームは、組織全体に対する単一の細胞の調査から、メカノの研究に多くの実験を容易にします。また、プラットフォームは、多数の機械的刺激実験や多軸引張試験を可能にし、非常に柔軟で設定可能です。プラットフォームはまた、生理学的条件下で細胞および組織の維持を可能にし、延伸実験の間、同時顕微鏡検査を可能にする。取り付けクランプの適切な…
Declarações
The authors have nothing to disclose.
Acknowledgements
DTは、ル·フォン·ド·ルシェルシュ·デュ·ケベックネイチャーらテクノロジーズ(FQRNT)とMITACS昇格戦略的フェローシップからのポスドク学生の身分によってサポートされていました。 CMCは、ル·フォン·ド·ルシェルシュアンサンテ·デュ·ケベック(FRSQ)とアーネストオタワ心臓研究所の大学からマーガレットフォード心臓病恵まれ研究フェローシップからのポスドク学生の身分によってサポートされていました。 EOBは、オンタリオ州の心臓と脳卒中財団から健康の研究(CIHR)およびT6335のためのカナダの協会からの補助金のMOP80204を操作することでサポートされていました。 CIHRとメドトロニックは、集合の査読研究議長(URC#57093)でEOBを提供しています。 AEPは、自然科学と工学研究評議会(NSERC)ディスカバリーグラント、NSERC Discovery Acceleratorのサプリメントによって資金を供給し、感謝してカナダのリサーチチェア(CRC)プログラムとオンタリオ州からの早期リサーチャー賞のサポートを認めている。
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
Referências
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

