ワンナノメートルの精度で蛍光イメージング(FIONA)
Summary
シングルフルオロフォアはFIONAを使用して、ナノメートルの精度で定位させることができる。ここでFIONA技術の概要が報告され、そしてどのようにFIONA実験を実施する方法について説明する。
Abstract
1ナノメートルの精度(FIONA)と蛍光イメージングは、xy平面上にナノメートルの精度で単一の蛍光団をローカライズするためのシンプルでありながら有用な技術である。ここでFIONA技術の概要が報告され、FIONAを使用して行われている研究の例が簡潔に記載されている。まず、 すなわち 、FIONA実験のために全反射蛍光顕微鏡(TIRFM)を、必要な機器の設定方法を、光学部品を位置合わせする方法の詳細に記載されている。次に、どのように量子ドットで標識された単一の切り捨てミオシンVaモータの36 nmのステップサイズを測定するためFIONAの使用に続いて、適切なプロトコルを使用して固定化したCy3でDNA一分子のローカライズで簡単なFIONA実験を実施するために、例示されている。最後に、厚いサンプルにFIONAのアプリケーションを拡張するための最近の取り組みが報告されている。 >(これは、水浸対物レンズを使用して、それを示され、量子ドットは、ゾル – ゲルおよびウサギの眼の角膜における深い浸し200μm)は、2〜3程度の局在化精度を達成することができる。
Introduction
1882年頃、エルンスト·アッベは、可視光顕微鏡の分解能は〜λ/ 2NA、または〜200nmの(λは波長であり、NAは開口数である)1,2であることがわかった。したがって、この寸法よりも小さい任意のオブジェクトは、光学顕微鏡の回折限界スポットとして現れる。しかし、非常に高い精度3であるスポットの中心、物体の位置を決定することが可能である。 1ナノメートルの精度(FIONA)と蛍光イメージングは、xy平面4ナノメートルの精度で単一の蛍光団をローカライズするためのシンプルでありながら有用な技術である。局在化の精度σμ( すなわち 、平均の標準誤差)は、収集された光子の総数に依存する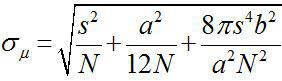 Nは、光子計数であり、sは蛍光スポットの標準偏差であり、aはピクセルイメージング検出器の大きさ、bはバックグラウンド3,4の標準偏差である。 〜万光子を放出する蛍光団のために、フィオナは〜1nmの精度4を達成することができます。
Nは、光子計数であり、sは蛍光スポットの標準偏差であり、aはピクセルイメージング検出器の大きさ、bはバックグラウンド3,4の標準偏差である。 〜万光子を放出する蛍光団のために、フィオナは〜1nmの精度4を達成することができます。
FIONA正確静止エミッタの位置、または(十分に速く取り出すことができる画像を仮定して)移動するかを決定するために用いることができる。 FIONAムービーのフレームに順次適用されるため、単一分子4〜8の動きを追跡することができます。光防護試薬は、試料が光分解しないことを保証する必要があるかもしれない。さらに、蛍光物体自体は任意のサイズであってもよい、リミット-側、例えば回折よりも小さいまたは大きいと、その膜上に分散多くの蛍光タンパク質と細胞小器官(〜1ミクロン)で構成することができる。 FIONAを使用すると、まだその平均重心の非常に正確な(ナノメートル)の平均を得ることができる。 FIONAによるローカリゼーション精度の大幅な向上はnanomeを解決することができます時間をかけてタースケールの動き。これは、分子長さスケール4〜8に顕微鏡をプッシュしています。
その発明以来、FIONAの変異体が開発されてきた。例えば1ナノメートルの精度(bFIONA)9と、明視野イメージング、FIONAのわずかな変種、画像や透過光などのメラノソームのin vivo(メラニン色素を含む暗いオブジェクト)などの高密度のオブジェクトを局在する。また、FIONAは、複数の色素を解決するために採用されている。例えば、光退色(エビ)を有する単一分子の高分解能イメージング10,11または単一分子の高解像度の共局在(SHREC)は12が約10nm内の2つの色素を解決するために開発されてきた。さらに最近では、FIONA分析はそのような確率論的光学recoのようなある種の超解像顕微鏡のローカリゼーションプロセスに貢献してきました( つまり 1が離れて、同一の染料を伝えることができますどのように正確に。、これは解像度であることに注意してください)nstruction顕微鏡(STORM)13〜15と光活性化ローカライゼーション顕微鏡(PALM)16、一時的な暗い蛍光団が励起され、その後、蛍光がローカライズされている。繰り返しエキサイティングかなり低い染料の密度(未満あたりの回折限界スポット)した後、FIONAによってそれらのそれぞれを分析し、蛍光を収集することによって、人は、高解像度のマップを構築することができます。解像度は、ちょうど光子の数によって制限され、各染料が出す、ならびに取得中に( 例えば 、顕微鏡ステージを含む)試料を静止状態に保つようなもの。
本論文では、FIONA技術の概要と簡単にFIONAが報告されている使用して行われている研究の例を記載している。まず、 すなわち 、FIONA実験のために全反射蛍光顕微鏡(TIRFM)を、必要な機器の設定方法を、光学部品を位置合わせする方法の詳細に記載されている。次に、どのように適切なプロトコルを使用して固定化されたCy3-DNAの単一分子を局在化する上で単純なFIONA実験を行って、図示されている。その後、FIONAの使用は量子ドットで標識された単一の切断型ミオシンVaモータ36 nmのステップサイズを測定することが提示されている。ミオシンVaは、アクチンフィラメントに沿って転位しながら携帯の貨物を運ぶ不可欠プロセッシブモータータンパク質である。ここで、Vaはトランケート構築ミオシンステップサイズとは無関係なドメインを除去するために使用され、およびFLAGタグがC末端に付加して、抗FLAG抗体で官能化量子ドットで標識の容易さを可能にする。この実験は、ミオシンを遅くし、フレーム毎に優れた光子数を得るために十分に長い露光時間の使用を可能にするために、低ATP下で行われる。でも十分に明るい蛍光標識は、以下のプロトコルに置き換えることができる。最後に、厚いサンプルにFIONAの適用を拡張する最近の努力が報告されている。原理証明として、量子ドットは、浸漬したゾル – ゲルおよびウサギの眼の角膜における、その後FIONAを使用して画像化し、ローカライズされた。この目的は、以前に使用100X油浸対物レンズよりも長い作動距離を有するため、撮像のためにNAと、60X浸水対物= 1.2を用いた。客観的に倍率の損失を補償するために、余分な倍率のレンズ(3.3倍または4.0X)が放出路に挿入した。また、落射蛍光(ないTIR)顕微鏡は、厚い試料の深い領域にアクセスするために使用される必要がある。これは、量子ドットは、ゾル – ゲル中の深い浸したことが示されていると、ウサギの眼の角膜(Z> 200ミクロン)に2-3 nmの精度で定位させることができる。
Protocol
Representative Results
Discussion
フィオナは1ミリ秒4〜8までナノメートルの精度と時間分解能を有する蛍光発光体(有機フルオロフォアまたは量子ドット)の位置を局所化する技術である。十分な光子が収集されると、この技術はより正確に回折限界(〜200 nm)を超える蛍光発光体の位置を決定することができ、したがって、この技術は、従来の/従来の光学顕微鏡4で見られなかったものを観察する道を開く<…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この作品は、NIHの助成金068625、NSF助成1063188と0822613.感謝はウサギの眼の贈り物のために先端科学技術のためのベックマン研究所で博士マリーナMarjanovicに行く生きている細胞の物理学センターによってサポートされていました。
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
References
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

