Lumineszenz-Resonanzenergietransfer zu Konformationsänderungen in Membranproteinen in Säugerzellen exprimiert Studieren
Summary
Wir beschreiben hier eine verbesserte Lumineszenz-Resonanz-Energie-Transfer (LRET) Verfahren, wo wir eine Protease-Schnittstelle zwischen dem Spender und Akzeptor-Fluorophor Stellen einzuführen. Diese Modifikation erlaubt es uns, spezifische LRET Signale aus Membranproteinen von Interesse, so dass für die Untersuchung von Membranproteinen ohne Proteinreinigung erhalten.
Abstract
Lumineszenz-Resonanz-Energie-Transfer oder LRET, ist eine leistungsstarke Technik verwendet, um Abstände zwischen zwei Standorten in Proteine innerhalb der Reichweite von 10-100 Å messen. Durch Messen der Abstände unter verschiedenen Bedingungen ligiert, können Konformationsänderungen des Proteins leicht beurteilt werden. Mit LRET, einem Lanthaniden, meist Chelat Terbium, als Donorfluorophor verwendet, BIETEN Vorteile wie eine längere Donor-Emission nur Lebenszeit, die Flexibilität, mehrere Akzeptorfluorophore zu verwenden, und die Möglichkeit, sensibilisierte Akzeptor-Emission als eine einfache Möglichkeit zu erkennen Energieübertragung ohne das Risiko der auch Donor-Erfassungssignal nur zu messen. Hier beschreiben wir ein Verfahren zur LRET auf Membranproteine exprimiert und auf der Oberfläche von intakten Säugetierzellen getestet verwenden. Wir stellen eine Protease-Schnittstelle zwischen der LRET Fluorophor-Paar. Nach dem Erhalt des ursprünglichen LRET Signal, Spaltung an dieser Stelle entfernt die spezifischen LRET Signal von dem Protein vonInteresse ermöglicht es uns, das Hintergrundsignal, das nach der Spaltung bleibt quantitativ zu subtrahieren. Dieses Verfahren ermöglicht eine physiologisch relevante Messungen ohne die Notwendigkeit für die Reinigung von Protein hergestellt werden.
Introduction
Lumineszenz-Resonanz-Energie-Transfer (LRET) ist ein Derivat des bekannten Fluoreszenz-Resonanz-Energie-Transfer (FRET) Technik 1. Ähnlich FRET kann LRET verwendet, um Abstände und Abstandsänderungen zwischen Donor und Akzeptor-Fluorophore an spezifische Stellen auf dem Protein von Interesse in dem Bereich von 10-100 Å 1-3 befestigt messen. Die Prinzipien der LRET sind auch ähnlich in dem Resonanzenergietransfer zwischen zwei FRET auftritt proximalen Fluorophore wenn das Emissionsspektrum des Donor-Fluorophors überlappt sich mit dem Absorptionsspektrum des Akzeptor-Fluorophors. Die Effizienz dieser Übertragung wird der Abstand zwischen den beiden Fluorophoren, die durch die folgende Gleichung in Beziehung:
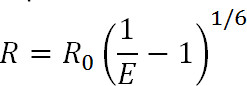 Gl. 1
Gl. 1
wobei R der Abstand zwischen den beiden Fluorophoren, E die Effizienz der DEEnergietransfer und R 0, wie unten diskutiert, ist der Förster-Radius für den Fluorophor-Paar, dh der Abstand, bei dem die Effizienz der Übertragung ist eine halbmaximale. Aus dieser Gleichung kann man erkennen, dass die Effizienz der Grße des Abstandes zu der inversen sechsten Potenz 1 angesprochen wird. Es ist dieser inversen sechsten Potenz Abhängigkeit, die für FRET-Messungen und LRET ermöglicht außerordentlich empfindlich auch auf kleine Abstandsänderungen, wenn in der Nähe des R 0 des FRET-Paar sein. Die Fähigkeit, spezifisch zu markieren gewünschten Stellen auf Proteinen oder anderen Makromolekülen ermöglicht es, die Vorteile dieser Empfindlichkeit, um Konformationsänderungen zu überwachen.
Im Vergleich zu FRET, die herkömmliche organische Farbstoffmoleküle nutzt, bietet LRET zusätzliche Vorteile. In LRET, anstelle der Verwendung eines organischen Farbstoffs als Donor-Fluorophor, einem Lanthaniden-Reihe Kation, typischerweise Tb 3 + oder Eu 3 +, verwendet wird, 1,4-6. Fluorophore, die u fallennder die Kategorie, beispielsweise Terbium-Chelat, sind auch sehr vielseitig, dass sie mit einer Vielzahl von Akzeptor-Fluorophore verwendet werden. Diese Flexibilität ist möglich, weil die Emissionsspektren von Chelat Lanthaniden enthalten mehrere scharfe Emissionsspitzen, so dass für eine einzige Art von Donor-Fluorophor mit einem von einer Vielzahl von Akzeptor-Fluorophore verwendet werden. Somit kann sensibilisierten Akzeptor-Emission ohne Angst vor kontaminierenden Durchbluten von Donoremission 5 detektiert werden. Der Experimentator wählt den spezifischen Akzeptor auf Basis der erwarteten Abstand zwischen den beiden Fluorophoren (Abbildung 1 und Tabelle 1). In dieser chelatisierten Lanthanid Fluorophore, die Metallionen von einem Molekül, das eine Antennengruppe, die in der Regel schlecht absorbierende Lanthanid sensibilisiert als auch als Anregungs bioreaktiven funktionellen Gruppe, um die Ionen auf eine bestimmte funktionelle Gruppe an das Makromolekül anzubinden 1 enthält chelatisierte 5,6. ONCe aufgeregt, Lanthaniden entspannen in den Grundzustand über die Freisetzung von Photonen mit einer Zerfallsrate im Millisekundenbereich. Da der Zerfall weder ein Singulett-Singulett-zu-Entspannung noch eine Triplett-Singulett-zu-Entspannung, die Emission von Photonen nicht richtig Fluoreszenz oder Phosphoreszenz genannt werden, ist jedoch genauer Lumineszenz 1 bezeichnet. Der lange Verfall der Lanthaniden-Lumineszenz hilft sehr bei Lebensdauermessungen. Lebensdauermessungen können dann verwendet werden, um die Effizienz über folgende Beziehung zu bestimmen:
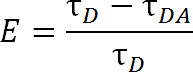 Gl. 2
Gl. 2
wo E ist die Effizienz der Übertragung, ist τ D die Lebensdauer des Donors (chelatisiert Lanthanid), wenn nicht in der Energieübertragung teilnehmen, und τ DA ist die Lebensdauer des Donors bei der Teilnahme an der Energieübertragung mit dem Akzeptor. Mit LRET, kann τ DA alum so die Lebensdauer der sensibilisierten Akzeptor-Emission gemessen werden, da Terbium Lebenszeit so viel größer ist als die eines organischen Akzeptor-Fluorophor. Der Akzeptor emittiert mit der gleichen Laufzeit wie der Anstiftung Anregung (Donor Lanthaniden) und jeder Beitrag auf die Lebensdauer aus der Akzeptor eigene intrinsische Fluoreszenzlebensdauer ist relativ unbedeutend. Durch Messen der sensibilisierten Emission statt Donoremission wir auch die Notwendigkeit der Kennzeichnung an genau einer 1 zu gewährleisten: 1-Verhältnis von Donor zu Akzeptor. Protein kann statt gleichzeitig mit sowohl Akzeptor und Donor Fluorophoren markiert werden. Eine heterogen markiert Bevölkerung resultieren, aber doppelt Donor markierten Proteine nicht in der Akzeptor-Wellenlänge zu emittieren, und doppelklicken Akzeptor markierten Proteine werden nicht angeregt werden. Darüber hinaus ist der Abstand zwischen Fluorophoren sollte unabhängig von der Cystein-Website eine gegebene Fluorophor isst, insbesondere bei Verwendung der isotropen Lanthanide als Donor gleich sein, so dass der geborened, um eine bestimmte Website, um entweder der Spender oder Akzeptor ist unnötig angeben. Intensität kann mit einer heterogenen Population betroffen sein, aber sollte noch mehr als ausreichend, um erkannt zu werden.
Bei der Planung Experimente, sollte die Wahl der Fluorophore von der R 0-Wert des Paares als auch die zu erwartende Reichweite diktiert werden gemessen. Der R 0-Wert wird durch die folgende Gleichung definiert ist:
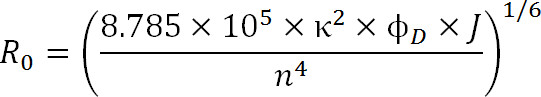 Gl. 3
Gl. 3
wobei R 0 der Förster-Radius in Angström, κ 2 der Orientierungsfaktor zwischen den beiden Farbstoffen (gewöhnlich angenommen 2/3 sein), φ D ist die Quantenausbeute des Donors, j die spektrale Überlappungsintegral zwischen Donor ist Emissionsspektrum und Akzeptor des Absorptionsspektrums in M – 1cm -1 nm 4 und n der Brechungsindex des Mediums 1.
Unser Labor hat eine Modifikation der herkömmlichen LRET Technik durch die Einführung einer Protease-Erkennungsstelle zwischen dem Donor und Akzeptor-Markierung Stellen auf dem Protein, die geprüft wird zugegeben. Diese Modifikation ermöglicht eine Untersuchung nicht gereinigten Systemen wie ganze Säugerzellen 7. Diese Technik ist besonders nützlich, wenn Cysteine als Stellen für die Kennzeichnung, da in dem Verfahren der Markierung mit Maleimid-konjugierten Farbstoffe, die in Cystein Sulfhydrylgruppen, andere Proteine von den Zellen, die Cysteine auch markiert sind binden. Jedoch, indem Proteasespaltstellen an dem Protein von Interesse und Mess Lebensdauer vor und nach der Spaltung der Experimentator kann quantitativ subtrahiert die Hintergrundsignal nach der Protease-Spalt aus dem Rohsignal. Diese Subtraktion isoliert das spezifische Signal aus dem Protein von Interesse (Figure 2). Unter Verwendung der oben beschriebenen Modifikation kann LRET zur Abstandsänderungen zwischen dem Terbium-Chelat-Donor und dem Akzeptor-Sonde auf einem Protein zu messen und zu kontrollieren, Konformationsänderungen in der Nähe von physiologischen Zustand des Proteins ohne das Erfordernis der Reinigung werden.
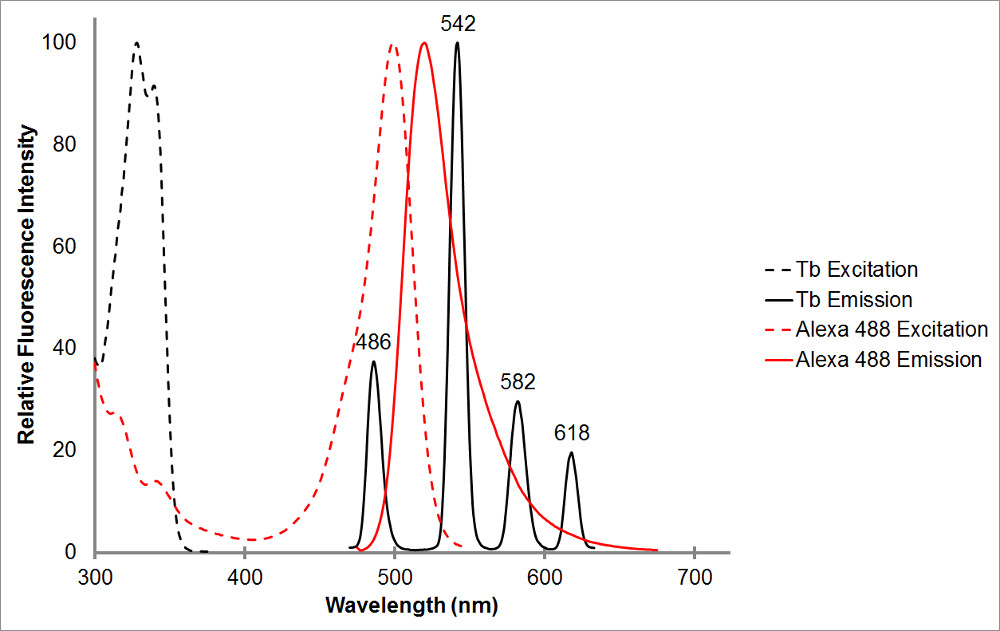
Abbildung 1. Die Absorption und Emissionsspektren von Chelat Terbium in schwarz, sowie einem Vertreter Akzeptor, Alexa 488, rot. Beachten Sie die mehrere Emissionsspitzen und den scharfen, schmalen Emissionsbereich für jeden Höhepunkt der Terbiumchelat. Dieses Muster ermöglicht Terbium, mit einer Vielzahl von Akzeptor-Fluorophore verwendet werden und ermöglicht die Messung der sensibilisierten Emission innerhalb dieser Bereiche, wo Terbium zeigt keine Emission. Terbium der Emissionsmaximum bei 486 nm sehr gut mit der ein überlappt bsorption Spitze des Alexa 488, so dass für Resonanzenergietransfer zwischen den beiden Fluorophoren auftreten. Eine Wellenlänge von 515 nm ist eine ausgezeichnete Wahl an sensibilisierte Emission für dieses Paar zu erkennen, wie es ist im Tal zwischen den Terbium Emissionsspitzen, und ganz in der Nähe des Alexa 488 Emissionsmaximum von 520 nm auf. Beachten Sie, dass die Nähe der Akzeptor-Spitze, obwohl wünschenswert, ist nicht erforderlich-565 nm ist immer noch in der Lage, Alexa 488 Emissions erkennen, ohne auch Erkennen Terbium-Emission.
| Akzeptor-Fluorophor | R 0 (a) | Emissionswellenlänge (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluorescein | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tabelle 1. Liste der am häufigsten verwendeten Akzeptorfluorophore für LRET mit Terbiumchelat als Donor 11. Die R 0-Werte wurden gemessen, wenn der Donor und Akzeptor wurden dem löslichen Agonisten-Bindungsdomäne von AMPA-Rezeptoren gebunden. Es ist ideal, um die R 0-Wert erneut zu messen für jeden neuen System untersucht.
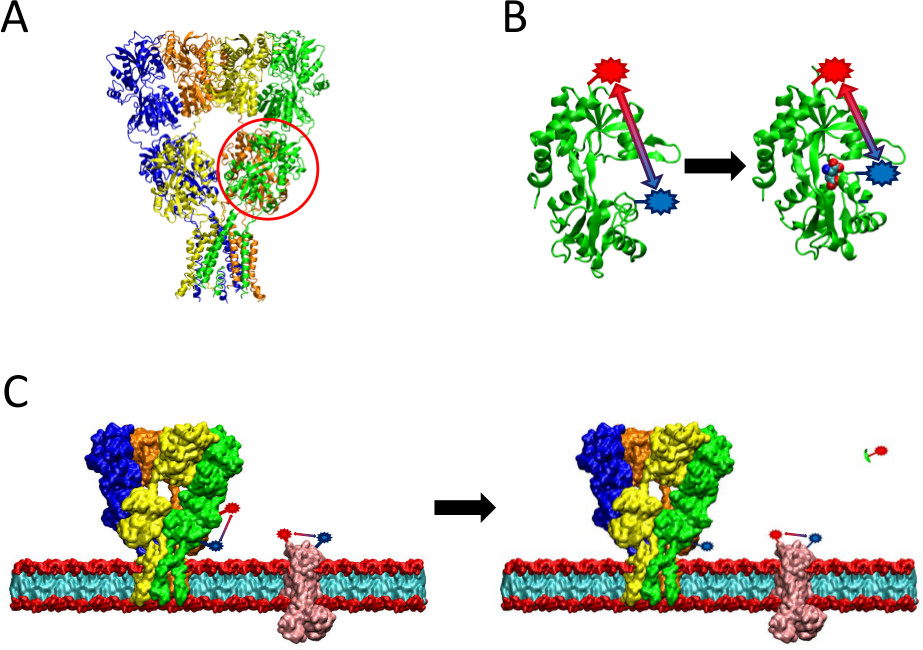
Abbildung 2. Eine Übersicht der Verfahren vorgestellt LRET. (A) Die AMPA-Rezeptor ist ein Membranprotein, das Konformationsänderungen bei Ligandenbindungs erfährt. Das Clamshell-förmigen Liganden-binden Domain ist hier rot eingekreist. (B) Das Liganden-bindende Domäne von AMPA als nicht an Proteine gebunden vorliegt in einer offenen Konformation (links). Wenn gebunden an Glutamat Ligand schließt das Protein um seine Liganden (rechts). Durch Anordnen Fluorophore an Beweisstellen auf der LBD kann die Natur dieser Konformationsänderung, wenn der Abstand zwischen den Fluorophoren Änderungen, die dann beeinflussen Fluoreszenzlebensdauer zu sehen. (C) Wenn die Kennzeichnung ganze Zellen, die Kennzeichnung sowohl der Protein von Interesse sowie Hintergrundmembranproteinen auftreten (links). Nach Protease-Schnittstelle, wird LRET Signal aus dem Protein von Interesse durch die Freisetzung eines löslichen Fragment verschwinden, so dass Hintergrundsignal intakt (rechts). Dieses Hintergrundsignal kann dann von dem Ausgangssignal subtrahiert werden.
Protocol
Representative Results
Discussion
LRET ist eine leistungsfähige Technik, die Wissenschaftler Abstände zwischen Domänen innerhalb eines einzelnen Proteins als auch zwischen Untereinheiten eines multimeren Proteins messen. Als solche LRET auf die Untersuchung der Konformationsänderungen und Dynamik von Proteinen oder anderen Makromolekülen gut geeignet. Das obige Protokoll sollte den entsprechend ausgerüsteten Labor zu ermöglichen, ihre Hypothesen einfach testen; Allerdings gibt es viele gemeinsame Fehlerquellen, die das neue Ermittler plagen könn…
Declarações
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde vom National Institutes of Health Grants GM094246, der American Heart Association Grants 11GRNT7890004, und der National Science Foundation Grant MCB-1110501 unterstützt.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Referências
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Bioquímica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

