Luminiscens Resonance Energy Transfer att studera strukturförändringar i membranproteiner i däggdjursceller
Summary
Vi beskriver här en förbättrad Luminescence resonansenergiöverföring (LRET) metod där vi introducerar ett proteasklyvningsställe mellan donator och acceptorfluorofor sajter. Denna ändring gör det möjligt för oss att skaffa särskilda LRET signaler som härrör från membranproteiner av intresse, vilket möjliggör studier av membranproteiner utan proteinrening.
Abstract
Luminiscens Resonance Energy Transfer, eller LRET, är en kraftfull teknik som används för att mäta avstånd mellan två platser i proteiner inom distans intervallet 10-100 Å. Genom att mäta avstånden under olika ligerade förhållanden kan konformationsförändringar av proteinet lätt bedömas. Med LRET, en lantanid, oftast kelaterad terbium, används som donatorfluoroforen, ger fördelar såsom längre givar enda utsläpp livslängd, flexibilitet att använda flera acceptor fluoroforer, och möjligheten att upptäcka sensibiliserade acceptor utsläpp som ett enkelt sätt för att mäta energiöverföring utan risk för även upptäcka givare endast signal. Här beskriver vi en metod att använda LRET på membranproteiner som uttrycks och analyseras på ytan av intakta däggdjursceller. Vi introducerar en proteasklyvningsställe mellan LRET fluoroforen paret. Efter erhållande av den ursprungliga LRET signalen, klyvning vid detta ställe avlägsnar specifik LRET signalen från proteinet avintresse gör det möjligt att kvantitativt subtrahera bakgrundssignalen som återstår efter klyvning. Denna metod gör det möjligt för flera fysiologiskt relevanta mätningar som skall göras utan behov av rening av protein.
Introduction
Luminiscens Resonance Energy Transfer (LRET) är ett derivat av den välkända Fluorescence Resonance Energy Transfer (FRET) teknik 1. Liknar FRET kan LRET användas för att mäta avstånd och förändringar avstånd mellan donator och acceptor fluoroforer knutna till specifika platser på proteinet av intresse i området 10-100 Å 1-3. Principerna för LRET är också liknande FRET i den resonansenergiöverföring sker mellan två proximala fluoroforema när emissionsspektrum donatorfluoroforen lappar med absorptionsspektrum acceptorfluoroforen. Effektiviteten för denna överföring är relaterad till avståndet mellan de två fluoroforerna genom följande ekvation:
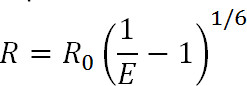 Ekv. 1
Ekv. 1
där R är avståndet mellan de två fluoroforerna, E är effektiviteten i svergi överföring, och R 0, diskuteras nedan, är Förster radien för fluoroforen paret, det vill säga på vilket avstånd effektivisera överföringen är halva maximala. Från denna ekvation kan man se att effektiviteten är relaterad till storleken på avståndet upphöjt till den inversa sjätte strömmen 1. Det är denna omvända sjätte strömberoende som möjliggör FRET och LRET mätningar för att vara utsökt känsliga även för små avstånd ändras när nära R 0 i FRET paret. Förmågan att specifikt märka önskade platser på proteiner eller andra makromolekyler tillåter en att dra fördel av denna känslighet för att övervaka konformationsförändringar.
Vid jämförelse med FRET, som använder konventionella organiska färgämnesmolekyler, LRET erbjuder ytterligare fördelar. I LRET, istället för att använda ett organiskt färgämne som donator fluorofor, en lantanidserien katjon, typiskt Tb3 + eller Eu 3 +, användes 1,4-6. Fluoroforer som faller under denna kategori, t.ex., terbium kelat, är också mycket mångsidig i det att de kan användas med ett brett sortiment av acceptor-fluoroforer. Denna flexibilitet är möjligt eftersom emissionsspektra för kelaterade lantanider innehåller flera skarpa utsläppstoppar, vilket möjliggör en enda art av donatorfluorofor för att användas med en av en mängd olika acceptor fluoroforer. Således kan upptäckas sensibiliserade utsläpp mottagare utan rädsla för kontaminerande genomblödning från givare utsläpp 5. Försöksledaren väljer den specifika acceptor utifrån den förväntade avståndet mellan de två fluoroforema (figur 1 och tabell 1). I dessa kelaterade lantanider fluoroforer är metalljonen kelaterad med en molekyl som innehåller en antenngrupp som sensibiliserar det normalt dåligt absorberande lantanid till exciterings samt ett bioreaktivt funktionell grupp att tjudra jonen till en specifik funktionell grupp på den makromolekyl 1, 5,6. Once upphetsad, lantanider koppla till grundtillståndet genom lanseringen av fotoner med en dämpfaktor i millisekund intervall. Eftersom sönderfallet är varken en sing till sing avslappning eller en triplett-till-sing avslappning, utsläpp av fotoner kan inte riktigt kallas fluorescens eller fosforescens, men är mer korrekt kallas luminiscens 1. Den långa sönderfallet av lantanider luminiscens hjälper mycket i livstidsmätningar. Medellivslängd mätningar kan sedan användas för att bestämma effektivitet med följande förhållande:
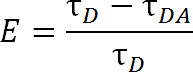 Ekv. 2
Ekv. 2
där är E effektiviteten i överföringen, är τ D livstid donator (kelaterad lantanider) när de inte deltar i energiöverföring, och τ DA är livslängden för givaren när de deltar i energiöverföring med acceptom. Med LRET, τ DA kan alså mätas som livslängd sensibiliserade acceptor utsläpp eftersom terbium livstid är så mycket större än en organisk acceptorfluorofor. Acceptorn avger med samma livslängd som dess anstiftan excitation (donator lantanider), och eventuella bidrag till livstid från acceptorn egen inneboende fluorescens livstid är relativt försumbar. Genom att mäta sensibiliserade utsläpp snarare än utsläpps donator, vi eliminerar också behovet av att säkerställa märkning på exakt en 1: 1 mellan donator till acceptor. Protein kan istället märkas samtidigt med både acceptor och givar fluoroforer. Ett heterogent märkt befolkningen kommer att leda, men dubbelgivar märkta proteiner kommer inte ut i accept våglängd och dubbel acceptor märkta proteiner kommer inte att vara glada. Dessutom bör avståndet mellan fluoroforer vara samma, oavsett vilken cystein webbplats en given fluorofor fäster, speciellt vid användning av isotropa lantaniderna som en donator, så need för att ange en viss plats för att få antingen givaren eller mottagaren är onödigt. Intensitet kan påverkas med en heterogen befolkning, men bör ändå vara mer än tillräckligt för att detekteras.
Vid planering experiment, bör valet av fluoroforer att bestämmas av R 0 värdet i paret och den förväntade avståndet intervall som mäts. R 0-värdet definieras genom följande ekvation:
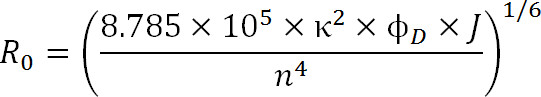 Ekv. 3
Ekv. 3
där är R 0 Förster radie i Ångström, κ 2 är orienteringen faktorn mellan de två färgämnena (vanligen antas vara 2/3), φ D är kvantutbytet av givaren, är J den spektral överlappning gral mellan givarens emissionsspektrum och acceptorn s absorbansspektrum i M – 1cm -1 nm 4, och n är brytningsindex för mediet 1.
Vårt laboratorium har lagt till en modifikation av den konventionella LRET teknik genom att införa ett proteasigenkänningsställe mellan donator och acceptor label ställen på proteinet som sonderas. Denna modifikation möjliggör undersökning i icke-renade system såsom hela däggdjursceller 7. Denna teknik är särskilt användbar vid användning av cysteiner som ställen för märkning, eftersom i processen för märkning med maleimid-konjugerade färgämnen som binder till cystein sulfhydrylgrupper, andra proteiner på de celler som har cysteinerna är också märkta. Men genom att ta med proteas-klyvningsställen på proteinet av intresse och mätning av livstider före och efter klyvning, försöksledaren kan kvantitativt subtrahera bakgrundssignalen efter proteasklyvning från råsignalen. Denna subtraktion isolerar specifika signaler som ges via proteinet av intresse (Figure 2). Använda modifieringen som beskrivs ovan, kan LRET användas för att mäta avstånd förändringar mellan terbium kelat donator och acceptor sonden på ett protein, och på så sätt följa konformationsförändringar i proteinets nära fysiologiska tillstånd utan krav på rening.
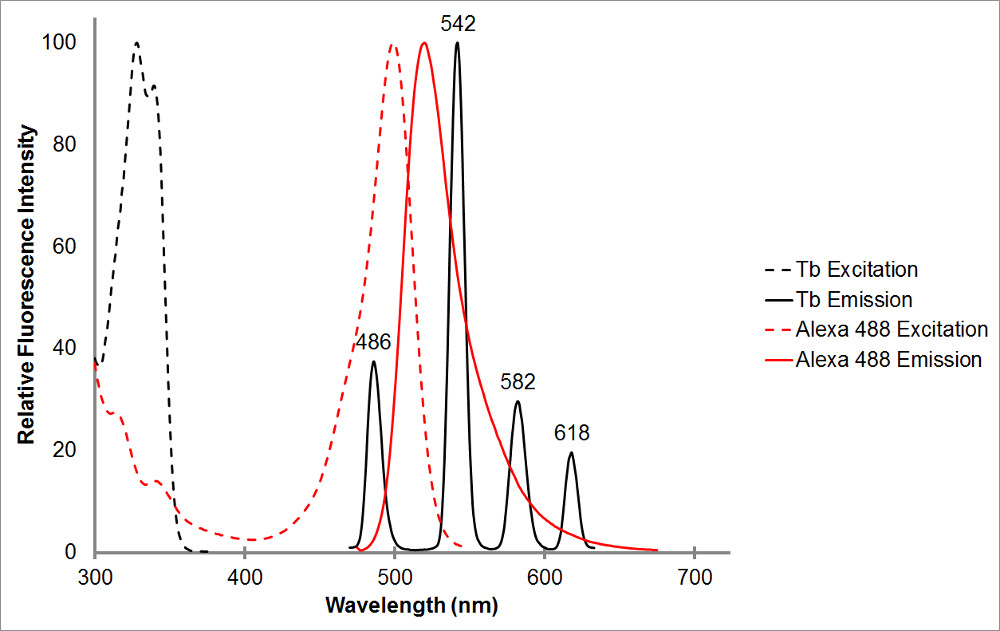
Figur 1.Det absorption och emissionsspektra av kelaterad terbium i svart, samt en representant acceptor, Alexa 488, i rött. Lägg märke till de olika utsläppstoppar och den skarpa, smala utsläppsintervall för varje topp av terbium kelat. Detta mönster medger terbium att användas med en rad olika acceptor fluoroforer och underlättar mätning av sensibiliserade utsläpp inom dessa intervall där terbium visar inget utsläpp. Terbium s emissionstopp vid 486 nm lappar ganska bra med en bsorption topp Alexa 488, vilket möjliggör resonansenergiöverföring ske mellan de två fluoroforerna. En våglängd på 515 nm är ett utmärkt val för att upptäcka sensibiliserade utsläpp för detta par som det är i dalen mellan terbium utsläppstoppar, och ganska nära Alexa 488 utsläpps topp på 520 nm. Notera att vara nära accepttoppen, men önskvärt, inte krävs-565 nm fortfarande kunna upptäcka Alexa 488 utsläpp utan också upptäcka terbium utsläpp.
| Acceptorfluorofor | R 0 (A) | Emission våglängd (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluorescein | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tabell 1 En lista över vanliga acceptor fluoroforer för LRET använder terbium kelat som donator 11. R-0 värdena mättes när donatorn och acceptorn var fästa till den lösliga agonisten bindningsdomän av AMPA-receptorer. Den är idealisk för att mäta R 0 värdet igen för varje nytt system som studeras.
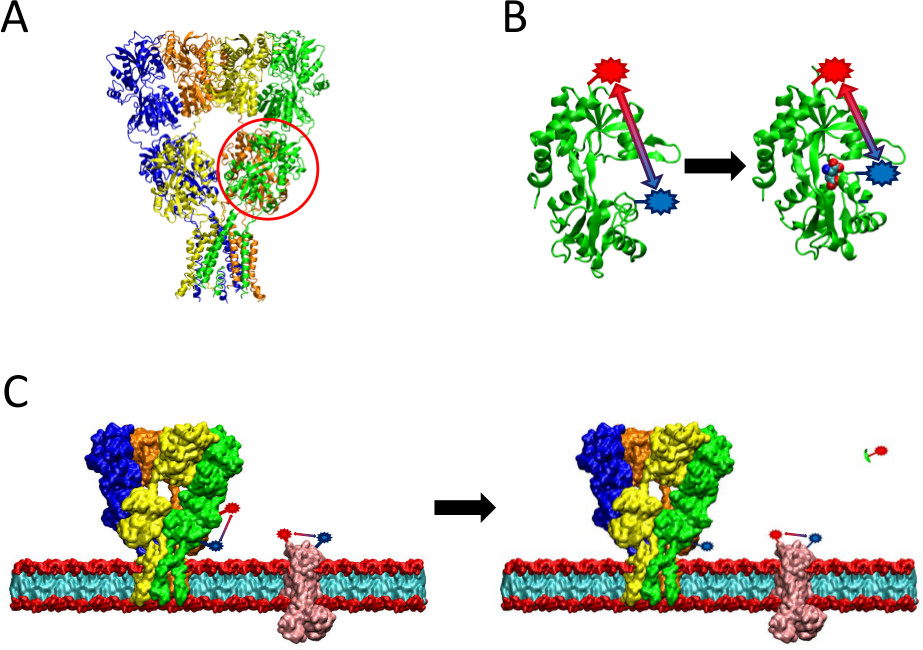
Figur 2 En översikt av LRET metod presenteras. (A) Den AMPA-receptom är ett membranprotein som undergår konformationsförändringar vid ligandbindning. Gripskopan formade ligand-bindning domänen är inringad här i rött. (B) Den ligandbindande domänen av AMPA när den inte är bunden till proteinet existerar i en öppen konformation (vänster). När bunden till ligand glutamat, stänger proteinet runt dess ligand (höger). Genom att placera fluoroforer på bevisvärde platser på LBD, kan denna typ av conformationaländring ses som avståndet mellan fluoroforer förändringar, som sedan kommer att påverka fluorescens livstid. (C) Vid märkning hela celler, märkning av både proteinet av intresse samt bakgrundsmembranproteiner kan förekomma (till vänster). Efter proteasklyvning kommer LRET signal från proteinet av intresse försvinner på grund av utsläpp av ett lösligt fragment, lämnar bakgrundssignalen intakt (höger). Denna bakgrundssignal kan sedan subtraheras från råsignalen.
Protocol
Representative Results
Discussion
LRET är en kraftfull teknik som gör det möjligt för forskare att mäta avstånd mellan områden i ett enda protein samt mellan subenheter i ett multiprotein. Som sådan är LRET väl lämpad för att undersöka de strukturförändringar och dynamik proteiner eller andra makromolekyler. Protokollet ovan bör ge korrekt utrustade labb för att enkelt testa sina hypoteser; emellertid, det finns många gemensamma felkällor som kan plåga den nya utredare. Om lite eller inget LRET signal ses, kontrollera först våglän…
Declarações
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av National Institutes of Health Grant GM094246, American Heart Association Grant 11GRNT7890004, och National Science Foundation Grant MCB-1.110.501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Referências
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Bioquímica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

