Fra Fast Fluorescens Imaging til Molecular Diffusion Lov om Aktive cellemembraner i et kommersielt mikroskop
Summary
Spatial distribution and temporal dynamics of plasma membrane proteins and lipids is a hot topic in biology. Here this issue is addressed by a spatio-temporal image fluctuation analysis that provides conceptually the same physical quantities of single particle tracking, but it uses small molecular labels and standard microscopy setups.
Abstract
Det har blitt stadig tydeligere at den romlige fordeling og bevegelse av membran komponenter som lipider og proteiner er viktige faktorer i reguleringen av mange cellulære funksjoner. Imidlertid, på grunn av den raske dynamikk og de små strukturer som er involvert, blir en meget høy spatio-temporal oppløsning som kreves for å fange den virkelige opptreden av molekyler. Her presenterer vi den eksperimentelle protokollen for å studere dynamikken i fluorescently-merket plasma-membran proteiner og lipider i levende celler med høy spatiotemporal oppløsning. Spesielt, tillater denne metode trenger ikke å spore hvert molekyl, men den beregner populasjon adferd ved bruk av alle molekyler i et gitt område av membranen. Utgangspunktet er en rask avbildning av et gitt område på membranen. Etterpå blir en fullstendig spatio-temporal autokorrelasjonsfunksjonen beregnet korrelering ervervede bilder ved å øke tidsforsinkelser, for eksempel hver 2, 3, N repetisjoner. Det er mulig å vise at breddenfor toppen av de romlige autokorrelasjonen funksjons øker ved økende tidsforsinkelsen som en funksjon av partikkelbevegelser på grunn av diffusjon. Derfor passer av serien av autokorrelasjonsfunksjoner gjør det mulig å trekke ut den faktiske protein betyr kvadratisk forskyvning fra imaging (iMSD), her presentert i form av tilsynelatende diffusiviteten vs gjennomsnittlig forskyvning. Dette gir en kvantitativ visning av gjennomsnittlig dynamikken i enkle molekyler med nanometer nøyaktighet. Ved å bruke en GFP-merket variant av transferrin-reseptor (TfR), og en ATTO488 merket 1-palmitoyl-2-hydroksy-sn -glycero-3-phosphoethanolamine (PPE) er det mulig å observere den tid og rom regulering av protein og lipid på diffusjon mikrometer-størrelse membran regioner i mikro-til-milli-sekunders tidsområde.
Introduction
Starter fra den opprinnelige "flytende mosaikk" modell av Singer og Nicolson, har bildet av mobilnettet plasma membran vært kontinuerlig oppdatert i løpet av de siste tiårene for å inkludere den nye rollen cytoskjelett og lipid-domener 1,2.
De første observasjonene ble innhentet av fluorescerende gjenoppretting etter fotobleking (FRAP) avsløre at en betydelig andel av membran proteiner er immobile 3-5. Disse banebrytende studier, men veldig lærerikt, led av den relativt dårlig oppløsning i verdensrommet (mikron) og (i sekunder) av FRAP oppsett. Også, å være et ensemble gjennomsnittsmåling, mangler FRAP i å gi informasjon om enkelt molekyl atferd.
I denne sammenheng er det mulig å spesifikt merke et enkelt molekyl med svært lyse koder (som tillater studiet av diffusjonsprosess ett molekyl av gangen) har vært meget vellykket. Spesielt, ved å skyvetidsoppløsning av Single Particle Tracking (SPT) tilnærming til mikrosekunder tidsskala, Kusumi, et al. fått tilgang til ukjente funksjoner i lipid og protein dynamikk som i stor grad bidratt til anerkjennelse av den rollen aktin-basert membran skjelett i membran fysiologi 6 7. Disse funnene ble generert i så-kalt «plukket og gjerdet 'modellen, der lipid og protein diffusjon reguleres av aktin-baserte skjelett. Men, for å ha tilgang til den enorme mengden av informasjon gitt av SPT mange eksperimentelle saker må tas opp. Spesielt er merkningsmetode vanligvis består av mange trinn som produksjon, rensing og innføring av de merkede arter inn i systemet. Videre store etiketter, som quantum prikker eller metallnanopartikler, er ofte nødvendig for å nå den undermillisekund tidsskala, og tverrbindingen av målmolekylene av etiketten ikke kunne unngås i mange tilfeller. Til slutt, mange banerhar å bli tatt opp for å passe statistiske kriterier og samtidig en lav tetthet av etiketten er nødvendig for å tillate sporing.
Sammenlignet med SPT, fluorescens korrelasjonsspektroskopi (FCS), å overvinne mange av disse ulempene, utgjør en meget lovende tilnærming for å studere molekyldynamikk. Faktisk fungerer FCS vel også med dim og tette etiketter, slik at å studere dynamikken i fluorescerende protein-merket molekyler i forbigående transfekterte celler. Dessuten gjør det nå høye statistikken i en begrenset tidsperiode. Endelig er, til tross for "høy" densitet på etiketter FCS gir enkle molekyler informasjon. Takk til alle disse egenskapene, FCS representerer en veldig grei tilnærming og har blitt mye brukt til å studere lipid og protein dynamikk både i modellmembraner og i levende celler 8-10. Mange forskjellige metoder er blitt foreslått for å øke evnen til FCS for å avdekke detaljer av molekylær diffusjon. For eksempel, det var shegne som ved å utføre FCS på forskjellig størrelse observasjon områder kan man definere en "FCS diffusjon lov" opplysende skjulte funksjoner i molekylær bevegelse 11,12. Dessuten blir variert i størrelse, ble det sentrale område også duplisert 13, beveges i rommet langs linjene 14-20 eller konjugert med raske kameraer 21,22. Ved hjelp av disse "spatio-temporal 'korrelasjon tilnærminger, ble relevante biologiske parametere av flere membran komponenter kvantitativt beskrevet på både modellmembraner og faktiske biologiske seg, noe som gir innsikt i membran romlige organiseringen.
Men i alle de FRAP FCS og anvendelser som er beskrevet så langt størrelsen på det sentrale området utgjør en begrensning i romlig oppløsning som ikke kan overvinnes. Flere super-Resolution Imaging metoder har nylig blitt utviklet for å omgå denne begrensningen. Noen er basert på lokalisering presisjon, for eksempel stokastisk optisk gjenoppbygging mikroskopi (STORM) <sup> 23,24, fotoaktivering lokalisering mikroskopi (PALM) 25, fluorescens PALM (FPALM) 26, og enkeltpartikkelsporings PALM (sptPALM) 27: den relativt store mengden av fotoner som kreves ved hvert stillbilde, men begrenser tiden oppløsningen disse metodene til minst flere millisekunder, og dermed hindre deres anvendelse i vivo.
I kontrast, har et lovende alternativ for oppløsning super blitt åpnet av romlig moduler fluorescensemisjonen med stimulert emisjon uttømming metoder (STED eller reversible metningsbar optiske fluorescens overganger (RESOLFT)) 28,29. Disse tilnærmingene kombinere utformingen av observasjons volum godt under diffraksjon grensen med muligheten til å bruke rask skanning mikroskoper og deteksjonssystemer. I kombinasjon med fluorescens svingninger analyse, STED mikros lov til å direkte sondere nanoskala tid og rom dynamikken i lipider og proteins i levende cellemembraner 30,31.
De samme fysiske mengder STED-baserte mikroskopi kan oppnås ved en modifisert spatio-temporal bildekorrelasjonsspektroskopi (pinner 32,33) metode som er egnet for undersøkelsen av dynamikken i fluorescensmerket-merkede membranproteiner og / eller lipider i levende celler og ved en kommersielt mikroskop. Den eksperimentelle protokollen som presenteres her er komponert av noen få trinn. Den første krever en rask avbildning av regionen av interesse på membranen. Deretter blir den resulterende stabel av bilder som brukes for å beregne den gjennomsnittlige romlige-tidsmessige korrelasjonsfunksjoner. Ved montering av serien av korrelasjonsfunksjoner, kan den molekylære 'diffusjon lov »fås direkte fra avbildning i form av en tilsynelatende diffusivitet (D app) – vs -average forskyvning plot. Denne tomten kritisk avhengig av miljøet utforsket av molekylene og lar erkjenner direkte selve diffusjon moduserav lipid / protein av interesse.
I flere detaljer, som tidligere er vist 34, den spatio-temporal autokorrelasjonsfunksjonen til ervervet bildeserien kritisk avhengig av dynamikken i molekylene beveger seg i samlet bildeserien (bemerk at den samme resonnement kan anvendes i en linje anskaffelse der bare én dimensjon i verdensrommet er vurdert). Spesielt definerer vi korrelasjonsfunksjon som:
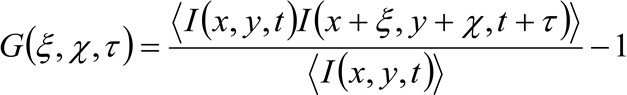 (1)
(1)
hvor 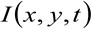 representerer den målte fluorescensintensiteten i posisjon x, y, og ved tidspunktet t,
representerer den målte fluorescensintensiteten i posisjon x, y, og ved tidspunktet t, ![]() og
og ![]() representerer avstanden i x ogy-retningene henholdsvis
representerer avstanden i x ogy-retningene henholdsvis ![]() representerer tidsforsinkelsen, og
representerer tidsforsinkelsen, og ![]() representerer gjennomsnittet. Denne funksjon kan uttrykkes som:
representerer gjennomsnittet. Denne funksjon kan uttrykkes som:
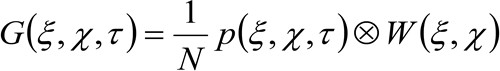 (2)
(2)
hvor n representerer det gjennomsnittlige antall molekyler i observasjonsområdet, ![]() representerer konvolusjon drift i rommet, og
representerer konvolusjon drift i rommet, og 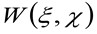 representerer autokorrelasjon av instrumental midjen. Dette siste kan tolkes som et mål på hvordan fotoner av en enkelt emitter er spredt ut i rommet på grunn av den optiske / opptaksoppsettet (den såkalte punktspredefunksjon, PSF, genetrally godt rundet av en Gaussisk funksjon). Endelig
representerer autokorrelasjon av instrumental midjen. Dette siste kan tolkes som et mål på hvordan fotoner av en enkelt emitter er spredt ut i rommet på grunn av den optiske / opptaksoppsettet (den såkalte punktspredefunksjon, PSF, genetrally godt rundet av en Gaussisk funksjon). Endelig 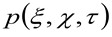 representerer sannsynligheten for å finne en partikkel i en avstand
representerer sannsynligheten for å finne en partikkel i en avstand ![]() og
og ![]() etter en tidsforsinkelse
etter en tidsforsinkelse ![]() . Hvis vi vurdere et diffusiv dynamikk, der partiklene beveger seg tilfeldig i alle retninger og netto fluks ikke er til stede, er denne funksjonen også godt rundet av en Gaussisk funksjon der variansen kan identifiseres som Mean Square Vekt (MSD) av bevegelige partikkel . Således midje av korrelasjonsfunksjon (også omtalt som
. Hvis vi vurdere et diffusiv dynamikk, der partiklene beveger seg tilfeldig i alle retninger og netto fluks ikke er til stede, er denne funksjonen også godt rundet av en Gaussisk funksjon der variansen kan identifiseres som Mean Square Vekt (MSD) av bevegelige partikkel . Således midje av korrelasjonsfunksjon (også omtalt som ![]() ), Kan defineres som summen av de partikkel MSP og den instrument midje og kan måles ved en gaussisk formlingen av korrelasjonsfunksjonen for hvert tidsforsinkelse. Den måles i MSD kan brukes til å beregne en tilsynelatende diffusivitet for de bevegelige molekyler
), Kan defineres som summen av de partikkel MSP og den instrument midje og kan måles ved en gaussisk formlingen av korrelasjonsfunksjonen for hvert tidsforsinkelse. Den måles i MSD kan brukes til å beregne en tilsynelatende diffusivitet for de bevegelige molekyler ![]() og en gjennomsnittlig forskyvning
og en gjennomsnittlig forskyvning ![]() som:
som:
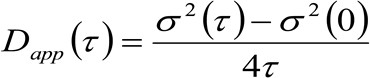 (3)
(3)
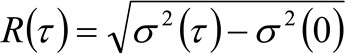 (4)
(4)
Noen betraktninger om den eksperimentelle oppsettet brukt kan veilede leseren gjennom de følgende avsnittene. For selektivt å eksitere fluoroforer i basalmembranen av levende celler vil vi bruke en total intern refleksjon (TIR) belysning, ved hjelp av en kommersiell TIR fluorescens (TIRF) mikroskop (detaljer kan finnes i materialet avsnitt). Videre, for å samle the fluorescens vil vi bruke en høy forstørrelse objektiv (100X NA 1,47, er høy numerisk apertur som kreves for TIRF belysning) og en EMCCD kamera (fysiske størrelsen på pixel på brikken 16 mikrometer). For å nå en pikselstørrelse på 100 nm vi bruke en ekstra forstørrelse linsen på 1.6x. Som omtalt nedenfor, vil en tidsoppløsning under 1 ms være nødvendig å beskrive riktig dynamikken i membranlipider raske under 100 nm. For å nå dette tidsoppløsning må vi velge et område av interesse (ROI) mindre enn hele chip av kameraet (512 x 512). På denne måten, vil kameraet lese et redusert antall linjer øker tidsoppløsning. Men i denne avlesning regime rammen tid ville være begrenset av tiden det tar å skifte summen fra eksponering for avlesning chip på kameraet og er vanligvis i størrelsesorden millisekunder for 512 x 512 pixel EMCCD. Å slå denne grensen, kan en ny teknologi skiftende ROI-linjer bare i stedet for hele rammen, wed en praktisk effektiv reduksjon av chip størrelse eksponert (kalt Cropped Sensor Mode i vår EMCCD). For denne konfigurasjon for å være effektiv, må chip utsiden av ROI dekkes med et par slisser som er montert i den optiske banen. Takket være denne sette opp en tidsoppløsning ned til 10 -4 sekunder kan oppnås. Vær imidlertid oppmerksom på at denne tilnærmingen kan være kombinert med mange ulike forsøksoppsett, som forklart i 'diskusjon' del.
Demonstrasjon av fremgangsmåten vil bli gitt i levende celler, ved å bruke både en ATTO488 merket 1-palmitoyl-2-hydroksy-sn -glycero-3-phosphoethanolamine (ATTO488-PPE) og et GFP-merket variant av transferrinreseptoren (GFP- TfR). I tilfelle av ATTO488-PPE denne tilnærmingen kan med hell gjenvinne en nesten konstant D app som en funksjon av gjennomsnittlig forskyvning indikerer en hovedsakelig fri diffusjon, som tidligere rapportert 30,35. Derimot, viser TfR-GFP en avtagende D <sub> app som en funksjon av gjennomsnittlig forskyvning, noe som tyder delvis begrenset diffusjon 6. Videre, i det sistnevnte tilfelle er det mulig å kvantifisere den lokale diffusjonskonstant og gjennomsnittlig innesperring området over mange mikron på membranplanet.
Protocol
Representative Results
Discussion
Enkelt partikkel tracking (SPT) representerer en av de mest vanlige strategier for å studere molekyldynamikk, og det har den store fordelen av å måle partikkelbaner. Dette i sin tur gjør det mulig for sondering oppførselen selv noen merkede partikler i et komplekst system. Imidlertid, for å oppnå denne fordel SPT må vanligvis en lav tetthet av sonden og meget lyse etiketter. Spesielt, for å oppnå høy tidsoppløsning (usekunder range) uorganisk probe er vanligvis nødvendig (f.eks kvanteprikker eller …
Declarações
The authors have nothing to disclose.
Acknowledgements
This work is supported in part by NIH-P41 P41-RRO3155 and NIH P50-GM076516 (grant to EG), and Fondazione Monte dei Paschi di Siena (grant to FB).
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| iXon Ultra 897 | Andor | DU-897U-CS0 | |
| Solis | Andor | ||
| CHO-K1 | ATCC | CCL-61 | |
| ATTO 488 labeled PPE | ATTO-TEC GmbH | AD 488-151 | |
| DOPE | Avanti Polar Lipids, Inc. | 850725 | |
| DOTAP | Avanti Polar Lipids, Inc. | 890890 | |
| 100X Penicillin-Streptomycin-Glutamine | Gibco | 10378-016 | |
| DMEM/F-12 | Gibco | 21331 | |
| FBS | Gibco | 10082147 | |
| HEPES | Gibco | 15630-106 | |
| PBS | Gibco | 10010-023 | |
| SimFCS 3.0 | Globals Software | the software can be downloaded here: http://www.lfd.uci.edu/globals/ | |
| DMI6000 with TIRF modulus | Leica | ||
| LAS AF | Leica | ||
| Lipofectamine 2000 | Lipofectamine | 11668019 | |
| Matlab | MathWork | ||
| Imagej | NIH | ||
| C-terminal GFP tagged Tranferrin Receptor | OriGene | RG200980 | |
| Agar | Sigma Aldrich | A5306 | |
| Chloroform | Sigma Aldrich | 528730 | |
| Latex beads, fluorescent yellow-green, 30 nm | Sigma Aldrich | L5155 | |
| SONICA Ultrasonic Cleaners | SOLTEC | ETH S3 | |
| Petri Dishes | Willco | GWSt-3522 | |
| Bio-Format importer for Matlab | http://www.openmicroscopy.org/site/support/bio-formats5/users/matlab/ | ||
| ICS-MatLab Tools | https://www.cellmigration.org/resource/imaging/software/ICSMATLAB_28-02-06.zip | ||
| Simulation by Matlab Tutorial | https://www.cellmigration.org/resource/imaging/icsmatlab/ICSTutorial.html | ||
| Simulation by SimFCS Tutorial | https://www.cellmigration.org/resource/imaging/ppt-pdf/RICS%20Simulations.ppt |
Referências
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Vereb, G., et al. yet structured: The cell membrane three decades after the Singer-Nicolson model. Proc. Natl. Acad. Sci. U. S. A. 100 (14), 8053-8058 (1073).
- Ishihara, A., Hou, Y., Jacobson, K. The Thy-1 antigen exhibits rapid lateral diffusion in the plasma membrane of rodent lymphoid cells and fibroblasts. 84 (5), 1290-1293 (1987).
- Axelrod, D., et al. Lateral motion of fluorescently labeled acetylcholine receptors in membranes of developing muscle fibers. Proc. Natl. Acad. Sci. U. S. A. 73 (12), 4594-4598 (1976).
- Jacobson, K., Derzko, Z., Wu, E. S., Hou, Y., Poste, G. Measurement of the lateral mobility of cell surface components in single, living cells by fluorescence recovery after photobleaching. J. Supramol. Struct. 5 (4), 10-1002 (1976).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annu. Rev. Biophys. Biomol. Struct. 34, 351-378 (2005).
- Kusumi, A., Ike, H., Nakada, C., Murase, K., Fujiwara, T. Single-molecule tracking of membrane molecules: plasma membrane compartmentalization and dynamic assembly of raft-philic signaling molecules. Semin. Immunol. 17 (1), 3-21 (2005).
- Schwille, P., Korlach, J., Webb, W. W. Fluorescence correlation spectroscopy with single-molecule sensitivity on cell and model membranes. Cytometry. 36, 176-182 (1999).
- Gielen, E., et al. Diffusion of sphingomyelin and myelin oligodendrocyte glycoprotein in the membrane of OLN-93 oligodendroglial cells studied by fluorescence correlation spectroscopy. C. R. Biol. 328 (12), 1057-1064 (2005).
- Weiss, M., Hashimoto, H., Nilsson, T. Anomalous protein diffusion in living cells as seen by fluorescence correlation spectroscopy. Biophys. J. 84, 4043-4052 (2003).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophys. J. 89 (6), 4029-4042 (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO J. 25 (14), 3245-3256 (2006).
- Ries, J., Schwille, P. Studying slow membrane dynamics with continuous wave scanning fluorescence correlation spectroscopy. Biophys. J. 91 (5), 1915-1924 (2006).
- Ruan, Q., Cheng, M. A., Levi, M., Gratton, E., Mantulin, W. W. Spatial-temporal studies of membrane dynamics: scanning fluorescence correlation spectroscopy (SFCS). Biophys. J. 87 (2), 1260-1267 (2004).
- Berland, K. M., So, P. T., Chen, Y., Mantulin, W. W., Gratton, E. Scanning two-photon fluctuation correlation spectroscopy: particle counting measurements for detection of molecular aggregation. Biophys. J. 71, 410-420 (1996).
- Heinemann, F., Betaneli, V., Thomas, F. A., Schwille, P. Quantifying lipid diffusion by fluorescence correlation spectroscopy: a critical treatise. Langmuir. 28 (37), 13395-13404 (2012).
- Cardarelli, F., Lanzano, L., Gratton, E. Capturing directed molecular motion in the nuclear pore complex of live cells. Proc. Natl. Acad. Sci. U. S. A. 109 (25), 9863-9868 (2012).
- Sanchez, S. A., Tricerri, M. A., Gratton, E. Laurdan generalized polarization fluctuations measures membrane packing micro-heterogeneity in vivo. Proc. Natl. Acad. Sci. U. S. A. 109 (19), 7314-7319 (2012).
- Cardarelli, F., Lanzano, L., Gratton, E. Fluorescence correlation spectroscopy of intact nuclear pore complexes. Biophys. J. 101 (4), 27-29 (2012).
- Di Rienzo, C., et al. Unveiling LOX-1 receptor interplay with nanotopography: mechanotransduction and atherosclerosis onset. Sci. Rep. 3, 10-1038 (2013).
- Unruh, J. R., Gratton, E. Analysis of molecular concentration and brightness from fluorescence fluctuation data with an electron multiplied CCD camera. Biophys. J. 95 (11), 5385-5398 (2008).
- Kannan, B., et al. Electron multiplying charge-coupled device camera based fluorescence correlation spectroscopy. Anal. Chem. 78 (10), 3444-3451 (2006).
- Jones, S. A., Shim, S. H., He, J., Fast Zhuang, X. three-dimensional super-resolution imaging of live cells. Nat. Methods. 8 (6), 499-508 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy. 3 (10), 793-795 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91 (11), 4258-4272 (2006).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nat. Methods. 5 (2), 155-157 (2008).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Klar, T. A., Hell, S. W. Subdiffraction resolution in far-field fluorescence microscopy. Opt. Lett. 24 (14), 954-956 (1999).
- Eggeling, C., et al. Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature. 457 (7233), 1159-1162 (2009).
- Hedde, P. N., et al. Stimulated emission depletion-based raster image correlation spectroscopy reveals biomolecular dynamics in live cells. Nat. Commun. 4, .
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophys. J. 88 (5), 3601-3614 (2005).
- Brown, C. M., et al. Probing the integrin-actin linkage using high-resolution protein velocity mapping. J. Cell Sci. 119, 5204-5214 (2006).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Fast spatiotemporal correlation spectroscopy to determine protein lateral diffusion laws in live cell membranes. Proc. Natl. Acad. Sci. U. S. A. 110 (30), 12307-12312 (2013).
- Mueller, V., et al. STED nanoscopy reveals molecular details of cholesterol- and cytoskeleton-modulated lipid interactions in living cells. Biophys. J. 101 (7), 1651-1660 (2011).
- Kleusch, C., Hersch, N., Hoffmann, B., Merkel, R., Csiszar, A. Fluorescent lipids: functional parts of fusogenic liposomes and tools for cell membrane labeling and visualization. Molecules. 17 (1), 1055-1073 (2012).
- Ries, J., Chiantia, S., Schwille, P. Accurate determination of membrane dynamics with line-scan FCS. Biophys. J. 96 (5), 1999-2008 (2009).
- Kolin, D. L., Wiseman, P. W. Advances in image correlation spectroscopy: measuring number densities, aggregation states, and dynamics of fluorescently labeled macromolecules in cells. Cell Biochem. Biophys. 49 (3), 141-164 (2007).
- Digman, M. A., et al. Measuring fast dynamics in solutions and cells with a laser scanning microscope. Biophys. J. 89 (2), 1317-1327 (2005).
- Ritchie, K., et al. Detection of non-Brownian diffusion in the cell membrane in single molecule tracking. Biophys. J. 88 (3), 2266-2277 (2005).
- Voie, A. H., Burns, D. H., Spelman, F. A. Orthogonal-plane fluorescence optical sectioning: three-dimensional imaging of macroscopic biological specimens. J. Microsc. 170, 229-236 (1993).
- Huisken, J., Swoger, J., Del Bene, ., Wittbrodt, F., J, E. H., Stelzer, Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Wohland, T., Shi, X., Sankaran, J., Stelzer, E. H. Single plane illumination fluorescence correlation spectroscopy (SPIM-FCS) probes inhomogeneous three-dimensional environments. Opt. Express. 18 (10), 10627-10641 (2010).

