Van Fast Fluorescentie Imaging om moleculaire diffusie wet op de Live-celmembranen in een Commercial Microscoop
Summary
Spatial distribution and temporal dynamics of plasma membrane proteins and lipids is a hot topic in biology. Here this issue is addressed by a spatio-temporal image fluctuation analysis that provides conceptually the same physical quantities of single particle tracking, but it uses small molecular labels and standard microscopy setups.
Abstract
Het is steeds duidelijker dat de ruimtelijke verdeling en de beweging van membraan componenten zoals lipiden en proteïnen zijn de belangrijkste factoren in de regulatie van vele cellulaire functies geworden. Vanwege de snelle dynamiek en kleine structuren betrokken zijn, een zeer hoge ruimtelijke resolutie moet het werkelijke gedrag van moleculen te vangen. Hier presenteren we de experimentele protocol voor het bestuderen van de dynamica van fluorescent gelabelde plasma-membraaneiwitten en lipiden in levende cellen met hoge spatiotemporele resolutie. Met name is deze benadering niet te elk molecuul volgen, maar berekent gedrag populatie met alle moleculen in een bepaalde regio van het membraan. Uitgangspunt is een snelle beeldvorming van een bepaald gebied op het membraan. Daarna wordt een volledige spatio-temporeel autocorrelatiefunctie berekend correlatie verkregen beelden met toenemende vertraging, bijvoorbeeld elke 2, 3, n herhalingen. Het kan aangetoond worden dat de breedtevan de piek van de ruimtelijke autocorrelatiefunctie toeneemt met toenemende vertraging als functie van deeltjesbeweging door diffusie. Derhalve passen de reeks autocorrelatiefuncties maakt uittreksel het werkelijke eiwit mean square verplaatsing van imaging (iMSD), hier voorgesteld in de vorm van schijnbare diffusiecoëfficiënt versus gemiddelde verplaatsing. Dit levert een kwantitatief beeld van de gemiddelde dynamica van enkele moleculen met nanometer nauwkeurigheid. Door een GFP-gelabelde variant van de transferrinereceptor (TfR) en een ATTO488 gemerkt 1-palmitoyl-2-hydroxy-sn-glycero-3-fosfoethanolamine (PPE) is het mogelijk om de spatio-temporale regulering van eiwitten en lipiden diffusie observeren urn sized membraan gebieden in de micro-naar milli-seconde tijdbereik.
Introduction
Uitgaande van de originele "vloeistof mozaïek"-model door Singer en Nicolson, heeft het beeld van cellulaire plasmamembraan voortdurend bijgewerkt tijdens de laatste decennia om de opkomende rol van het cytoskelet en lipidedomeinen 1,2 omvatten.
De eerste waarnemingen werden verkregen door TL herstel na fotobleken (FRAP) onthulling dat een aanzienlijk deel van membraaneiwitten immobiel is 3-5. Deze baanbrekende studies, hoewel zeer informatief, last van de relatief slechte resolutie in ruimte (micron) en de tijd (in seconden) van FRAP setups. Ook wordt een ensemble gemiddelde meting, FRAP ontbreekt in het geven van informatie over enkele molecule gedrag.
In deze context, de mogelijkheid specifiek label een molecuul met zeer lichte markeringen (waardoor de studie van het diffusieproces een molecuul tegelijk) is zeer succesvol geweest. In het bijzonder, door op detijdsresolutie van de Single Particle Tracking (SPT) benadering van de microseconde tijdschaal, Kusumi, ea. toegang gekregen tot onbekende eigenschappen van lipiden en eiwitten dynamiek die in belangrijke mate bijgedragen aan de erkenning van de rol van actine gebaseerde membraan skelet in membraan fysiologie 6 , 7. Deze bevindingen gegenereerd zogenaamde het "paal en hek-model, waarbij lipiden en eiwitten diffusie wordt geregeld door actine gebaseerde skelet. Echter, om de toegang tot de enorme hoeveelheid door NBP vele experimentele Bull informatie moet worden aangepakt. In het bijzonder wordt de labelingsprocedure normaliter samengesteld door vele stappen, zoals productie, zuivering en invoering van de gemerkte species in het systeem. Bovendien grote labels, zoals quantum dots of metalen nanodeeltjes, zijn vaak nodig om de sub-milliseconde tijdschaal en de verknoping van de doelgroep moleculen door het label kon niet vermeden worden in veel gevallen te bereiken. Tenslotte vele trajectenmoeten worden opgenomen statistische criteria passen en gelijktijdig een lage dichtheid van het label moet volgen mogelijk.
Vergeleken met SPT, fluorescentie correlatie spectroscopie (FCS), overwinnen veel van deze nadelen is een veelbelovende benadering voor moleculaire dynamica te bestuderen. In feite, FCS werkt goed ook zwak en dichte labels, waardoor de dynamiek van fluorescerend proteïne gemerkte moleculen te bestuderen in transient getransfecteerde cellen. Ook kun bereiken hoog statistieken een beperkte tijd. Tot slot, ondanks de "hoge" dichtheid van labels FCS biedt enkele moleculen informatie. Door al deze eigenschappen, FCS staat voor een zeer rechtlijnige aanpak en is uitgebreid toegepast op lipiden en eiwitten dynamiek te bestuderen, zowel in model membranen en in levende cellen 8-10. Vele verschillende benaderingen zijn voorgesteld om het vermogen van FCS om de details van moleculaire diffusie onthullen verhogen. Zo was sheigen, dat door het uitvoeren van FCS op verschillende afmetingen observatie gebieden kan men een "FCS diffusie wet" verhelderend verborgen eigenschappen van moleculaire beweging 11,12 definiëren. Naast het feit dat varieerde in grootte, werd het aandachtsgebied ook gedupliceerd 13, verhuisde in de ruimte langs de lijnen 14-20 of geconjugeerd met snelle camera's 21,22. Met behulp van deze 'ruimte-tijd' correlatie benaderingen, werden relevante biologische parameters van verschillende membraan componenten kwantitatief beschreven op zowel modelmembranen en werkelijke biologische degenen, waardoor aldus inzicht in de membraan-ruimtelijke organisatie.
In alle FRAP en FCS toepassingen dusver beschreven de grootte van het concentratiegebied is een limiet ruimtelijke resolutie die niet kan worden overwonnen. Verschillende beeldvormende technieken super-resolutie zijn recent ontwikkeld om deze limiet te omzeilen. Sommige zijn gebaseerd op lokalisatie precisie, zoals stochastische optische reconstructie microscopie (STORM) <sup> 23,24, fotoactivering lokalisatie microscopie (PALM) 25, fluorescentie PALM (FPALM) 26 en enkele deeltjes volgen PALM (sptPALM) 27: de relatief grote hoeveelheid fotonen vereist op elke foto, beperkt echter de tijdsresolutie van deze methoden om ten minste enkele milliseconden, waardoor hun toepasbaarheid in vivo belemmeren.
Daar staat tegenover dat een veelbelovend alternatief voor de super-resolutie imaging geopend door ruimtelijk moduleren van de fluorescentie-emissie met gestimuleerde emissie uitputting methoden (STED of omkeerbare verzadigbaar optische fluorescentie overgangen (RESOLFT)) 28,29. Deze benaderingen combineren de vormgeving van de waarneming volume ruim onder de diffractie limiet de mogelijkheid om snelle scanning microscopen en detectiesystemen gebruikt. In combinatie met fluorescentie fluctuatie analyse, STED microscopie toegestaan om direct sonde nanoschaal spatiotemporele dynamiek van lipiden en proteins in levende celmembranen 30,31.
Dezelfde fysische hoeveelheden STED gebaseerde microscopie kan worden verkregen door een gemodificeerde spatio-temporeel beeld correlatie spectroscopie (PEN 32,33) methode die geschikt is voor de studie van de dynamiek van fluorescent-gelabelde membraaneiwitten en / of lipiden in levende cellen en door een commerciële microscoop. Het experimentele protocol hier gepresenteerd is samengesteld door enkele stappen. De eerste vereist een snelle beeldvorming van het gebied van belang op het membraan. Vervolgens wordt de resulterende stapel beelden worden gebruikt om de gemiddelde spatiotemporeel correlatiefuncties berekenen. Door toepassing van de reeksen van correlatiefuncties de moleculaire diffusie recht "kan direct vanuit beeldvorming verkregen in de vorm van een schijnbare diffusiecoëfficiënt (D app) – vs -gemiddelde verplaatsingsplot. Dit perceel kritisch afhankelijk van de omgeving verkend door de moleculen en maakt direct de werkelijke verspreiding modi herkennenvan het lipide / eiwit plaats.
In meer details, zoals eerder aangegeven 34, de tijd-ruimtelijke auto-correlatie-functie van de verworven afbeelding serie kritisch afhankelijk van de dynamiek van de moleculen bewegen in het verzamelde beeld-serie (let op dat dezelfde redenering in een lijn overname kan worden toegepast waar slechts een dimensie in de ruimte wordt beschouwd). In het bijzonder definiëren we de correlatiefunctie als:
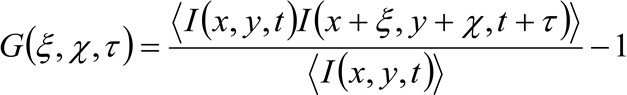 (1)
(1)
waar 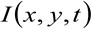 vertegenwoordigt de gemeten fluorescentie-intensiteit in de positie x, y en op tijdstip t,
vertegenwoordigt de gemeten fluorescentie-intensiteit in de positie x, y en op tijdstip t, ![]() pt
pt ![]() is de afstand in de x enrespectievelijk de y-richting,
is de afstand in de x enrespectievelijk de y-richting, ![]() vertegenwoordigt het tijdsverloop, en
vertegenwoordigt het tijdsverloop, en ![]() vertegenwoordigt het gemiddelde. Deze functie kan worden uitgedrukt als:
vertegenwoordigt het gemiddelde. Deze functie kan worden uitgedrukt als:
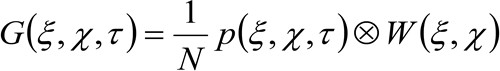 (2)
(2)
waarbij 'N' staat voor het gemiddelde aantal moleculen in de observatie gebied, ![]() is de convolutie-bewerking in de ruimte, en
is de convolutie-bewerking in de ruimte, en 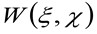 vertegenwoordigt de autocorrelatie van de instrumentale taille. Dit laatste kan worden opgevat als een maat voor hoe de fotonen van een emitter zijn verspreid in de ruimte door de optische / opname opstart (de zogenaamde puntspreidingsfunctie, PSF, generally goed benaderd door een Gauss-functie). Tenslotte
vertegenwoordigt de autocorrelatie van de instrumentale taille. Dit laatste kan worden opgevat als een maat voor hoe de fotonen van een emitter zijn verspreid in de ruimte door de optische / opname opstart (de zogenaamde puntspreidingsfunctie, PSF, generally goed benaderd door een Gauss-functie). Tenslotte 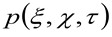 is de kans om een deeltje te vinden op afstand
is de kans om een deeltje te vinden op afstand ![]() pt
pt ![]() na een bepaalde tijd
na een bepaalde tijd ![]() . Als we kijken naar een diffusief dynamiek, waarin deeltjes bewegen willekeurig in alle richtingen en de netto fluxen niet aanwezig zijn, is deze functie ook goed benaderd door een Gauss-functie waarbij de variantie kan worden geïdentificeerd als de Mean Square Verplaatsing (MSD) van het bewegende deeltje . Aldus, de taille van de correlatiefunctie (ook aangeduid als
. Als we kijken naar een diffusief dynamiek, waarin deeltjes bewegen willekeurig in alle richtingen en de netto fluxen niet aanwezig zijn, is deze functie ook goed benaderd door een Gauss-functie waarbij de variantie kan worden geïdentificeerd als de Mean Square Verplaatsing (MSD) van het bewegende deeltje . Aldus, de taille van de correlatiefunctie (ook aangeduid als ![]() ), Kan worden gedefinieerd als de som van het deeltje MSA en instrumentele taille en kan worden gemeten door een Gauss fitting van de correlatie functie voor elke vertraging. De gemeten i MSD kan worden gebruikt om een schijnbare diffusiecoëfficiënt van de bewegende moleculen berekenen
), Kan worden gedefinieerd als de som van het deeltje MSA en instrumentele taille en kan worden gemeten door een Gauss fitting van de correlatie functie voor elke vertraging. De gemeten i MSD kan worden gebruikt om een schijnbare diffusiecoëfficiënt van de bewegende moleculen berekenen ![]() en een gemiddelde verplaatsing
en een gemiddelde verplaatsing ![]() zoals:
zoals:
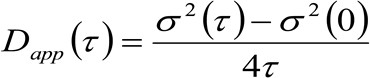 (3)
(3)
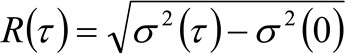 (4)
(4)
Enkele overwegingen op experimentele opstelling gebruikt kan de lezer begeleiden gedurende de volgende secties. Om de fluoroforen selectief exciteren van het basale membraan van levende cellen zullen we een totale interne reflectie (TIR) belichting, onder gebruikmaking van een commercieel TIR fluorescentie (TIRF) microscoop (vindt u bij materialen). Bovendien, teneinde th verzamelene fluorescentie zullen we een sterke vergroting doelstelling gebruiken (100X NA 1,47, wordt hoge numerieke apertuur nodig TIRF verlichting) en een EMCCD camera (fysieke grootte van de pixel op de chip 16 urn). Een pixelgrootte van 100 nm te bereiken passen we een extra vergroting lens van 1,6 x. Zoals hieronder besproken, zou een tijdresolutie dan 1 msec nodig om de dynamiek van snelle membraanlipiden goed beschreven onder 100 nm. Om deze tijdresolutie bereiken moeten we een van belang (ROI) te selecteren kleiner dan de gehele chip van de camera (512 x 512). Op deze manier zal de camera een beperkt aantal regels verhogen de tijdsresolutie lezen. In dit regime uitlezing geschikte lijst beperkte duur door de benodigde tijd en is meestal in de orde van milliseconden 512 x 512 pixel EMCCD tot kosten van de blootstelling verschuiven naar de uitlezing chip op de camera. Om deze limiet te verslaan, een opkomende technologie maakt het verschuiven van de ROI-lijn in plaats van het gehele frame, wet een praktische effectieve vermindering van de blootgestelde chip grootte (genaamd Cropped Sensor Mode in onze EMCCD). Voor deze configuratie om effectief te zijn, moet de chip buiten de ROI worden gedekt door een paar spleten gemonteerd in het optische pad. Dankzij deze opstelling een tijdresolutie tot 10 -4 seconden worden bereikt. Let er echter op dat deze aanpak kan worden gekoppeld met veel verschillende experimentele opstellingen, zoals beschreven in de paragraaf 'discussie'.
Demonstratie van de werkwijze wordt voorzien in levende cellen met zowel een ATTO488 gemerkt 1-palmitoyl-2-hydroxy-sn-glycero-3-fosfoethanolamine (ATTO488-PPE) en een GFP-gelabelde variant van de transferrinereceptor (GFP TfR). Bij ATTO488-PPE kan deze benadering succesvol een nagenoeg constant D app als functie van gemiddelde verplaatsing aangeeft een meestal vrij diffusie herstellen, zoals eerder gemeld 30,35. Daarentegen TfR-GFP vertoont een afnemende D <sub> app als functie van gemiddelde verplaatsing, suggereert gedeeltelijk beperkte diffusie 6. Bovendien, in het laatste geval is het mogelijk om de lokale diffusie en de gemiddelde opsluiting gebied over vele micron op het membraan vlak te kwantificeren.
Protocol
Representative Results
Discussion
Single Particle Tracking (SPT) is een van de meest voorkomende strategieën om moleculaire dynamica te bestuderen en het heeft het grote voordeel van het meten van deeltjestrajecten. Hierdoor kan sonderen het gedrag van zelfs enkele gemerkte deeltjes in een complex systeem. Echter, dit voordeel SPT heeft typisch een lage dichtheid van de probe en zeer helder labels bereikt. In dit geval een ingewikkelde procedure productie, etikettering en insertie in het systeem nodig: bijzonder hoge temporele resolutie (usec range) an…
Declarações
The authors have nothing to disclose.
Acknowledgements
This work is supported in part by NIH-P41 P41-RRO3155 and NIH P50-GM076516 (grant to EG), and Fondazione Monte dei Paschi di Siena (grant to FB).
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| iXon Ultra 897 | Andor | DU-897U-CS0 | |
| Solis | Andor | ||
| CHO-K1 | ATCC | CCL-61 | |
| ATTO 488 labeled PPE | ATTO-TEC GmbH | AD 488-151 | |
| DOPE | Avanti Polar Lipids, Inc. | 850725 | |
| DOTAP | Avanti Polar Lipids, Inc. | 890890 | |
| 100X Penicillin-Streptomycin-Glutamine | Gibco | 10378-016 | |
| DMEM/F-12 | Gibco | 21331 | |
| FBS | Gibco | 10082147 | |
| HEPES | Gibco | 15630-106 | |
| PBS | Gibco | 10010-023 | |
| SimFCS 3.0 | Globals Software | the software can be downloaded here: http://www.lfd.uci.edu/globals/ | |
| DMI6000 with TIRF modulus | Leica | ||
| LAS AF | Leica | ||
| Lipofectamine 2000 | Lipofectamine | 11668019 | |
| Matlab | MathWork | ||
| Imagej | NIH | ||
| C-terminal GFP tagged Tranferrin Receptor | OriGene | RG200980 | |
| Agar | Sigma Aldrich | A5306 | |
| Chloroform | Sigma Aldrich | 528730 | |
| Latex beads, fluorescent yellow-green, 30 nm | Sigma Aldrich | L5155 | |
| SONICA Ultrasonic Cleaners | SOLTEC | ETH S3 | |
| Petri Dishes | Willco | GWSt-3522 | |
| Bio-Format importer for Matlab | http://www.openmicroscopy.org/site/support/bio-formats5/users/matlab/ | ||
| ICS-MatLab Tools | https://www.cellmigration.org/resource/imaging/software/ICSMATLAB_28-02-06.zip | ||
| Simulation by Matlab Tutorial | https://www.cellmigration.org/resource/imaging/icsmatlab/ICSTutorial.html | ||
| Simulation by SimFCS Tutorial | https://www.cellmigration.org/resource/imaging/ppt-pdf/RICS%20Simulations.ppt |
Referências
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Vereb, G., et al. yet structured: The cell membrane three decades after the Singer-Nicolson model. Proc. Natl. Acad. Sci. U. S. A. 100 (14), 8053-8058 (1073).
- Ishihara, A., Hou, Y., Jacobson, K. The Thy-1 antigen exhibits rapid lateral diffusion in the plasma membrane of rodent lymphoid cells and fibroblasts. 84 (5), 1290-1293 (1987).
- Axelrod, D., et al. Lateral motion of fluorescently labeled acetylcholine receptors in membranes of developing muscle fibers. Proc. Natl. Acad. Sci. U. S. A. 73 (12), 4594-4598 (1976).
- Jacobson, K., Derzko, Z., Wu, E. S., Hou, Y., Poste, G. Measurement of the lateral mobility of cell surface components in single, living cells by fluorescence recovery after photobleaching. J. Supramol. Struct. 5 (4), 10-1002 (1976).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annu. Rev. Biophys. Biomol. Struct. 34, 351-378 (2005).
- Kusumi, A., Ike, H., Nakada, C., Murase, K., Fujiwara, T. Single-molecule tracking of membrane molecules: plasma membrane compartmentalization and dynamic assembly of raft-philic signaling molecules. Semin. Immunol. 17 (1), 3-21 (2005).
- Schwille, P., Korlach, J., Webb, W. W. Fluorescence correlation spectroscopy with single-molecule sensitivity on cell and model membranes. Cytometry. 36, 176-182 (1999).
- Gielen, E., et al. Diffusion of sphingomyelin and myelin oligodendrocyte glycoprotein in the membrane of OLN-93 oligodendroglial cells studied by fluorescence correlation spectroscopy. C. R. Biol. 328 (12), 1057-1064 (2005).
- Weiss, M., Hashimoto, H., Nilsson, T. Anomalous protein diffusion in living cells as seen by fluorescence correlation spectroscopy. Biophys. J. 84, 4043-4052 (2003).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophys. J. 89 (6), 4029-4042 (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO J. 25 (14), 3245-3256 (2006).
- Ries, J., Schwille, P. Studying slow membrane dynamics with continuous wave scanning fluorescence correlation spectroscopy. Biophys. J. 91 (5), 1915-1924 (2006).
- Ruan, Q., Cheng, M. A., Levi, M., Gratton, E., Mantulin, W. W. Spatial-temporal studies of membrane dynamics: scanning fluorescence correlation spectroscopy (SFCS). Biophys. J. 87 (2), 1260-1267 (2004).
- Berland, K. M., So, P. T., Chen, Y., Mantulin, W. W., Gratton, E. Scanning two-photon fluctuation correlation spectroscopy: particle counting measurements for detection of molecular aggregation. Biophys. J. 71, 410-420 (1996).
- Heinemann, F., Betaneli, V., Thomas, F. A., Schwille, P. Quantifying lipid diffusion by fluorescence correlation spectroscopy: a critical treatise. Langmuir. 28 (37), 13395-13404 (2012).
- Cardarelli, F., Lanzano, L., Gratton, E. Capturing directed molecular motion in the nuclear pore complex of live cells. Proc. Natl. Acad. Sci. U. S. A. 109 (25), 9863-9868 (2012).
- Sanchez, S. A., Tricerri, M. A., Gratton, E. Laurdan generalized polarization fluctuations measures membrane packing micro-heterogeneity in vivo. Proc. Natl. Acad. Sci. U. S. A. 109 (19), 7314-7319 (2012).
- Cardarelli, F., Lanzano, L., Gratton, E. Fluorescence correlation spectroscopy of intact nuclear pore complexes. Biophys. J. 101 (4), 27-29 (2012).
- Di Rienzo, C., et al. Unveiling LOX-1 receptor interplay with nanotopography: mechanotransduction and atherosclerosis onset. Sci. Rep. 3, 10-1038 (2013).
- Unruh, J. R., Gratton, E. Analysis of molecular concentration and brightness from fluorescence fluctuation data with an electron multiplied CCD camera. Biophys. J. 95 (11), 5385-5398 (2008).
- Kannan, B., et al. Electron multiplying charge-coupled device camera based fluorescence correlation spectroscopy. Anal. Chem. 78 (10), 3444-3451 (2006).
- Jones, S. A., Shim, S. H., He, J., Fast Zhuang, X. three-dimensional super-resolution imaging of live cells. Nat. Methods. 8 (6), 499-508 (2011).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy. 3 (10), 793-795 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91 (11), 4258-4272 (2006).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nat. Methods. 5 (2), 155-157 (2008).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Klar, T. A., Hell, S. W. Subdiffraction resolution in far-field fluorescence microscopy. Opt. Lett. 24 (14), 954-956 (1999).
- Eggeling, C., et al. Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature. 457 (7233), 1159-1162 (2009).
- Hedde, P. N., et al. Stimulated emission depletion-based raster image correlation spectroscopy reveals biomolecular dynamics in live cells. Nat. Commun. 4, .
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophys. J. 88 (5), 3601-3614 (2005).
- Brown, C. M., et al. Probing the integrin-actin linkage using high-resolution protein velocity mapping. J. Cell Sci. 119, 5204-5214 (2006).
- Di Rienzo, C., Gratton, E., Beltram, F., Cardarelli, F. Fast spatiotemporal correlation spectroscopy to determine protein lateral diffusion laws in live cell membranes. Proc. Natl. Acad. Sci. U. S. A. 110 (30), 12307-12312 (2013).
- Mueller, V., et al. STED nanoscopy reveals molecular details of cholesterol- and cytoskeleton-modulated lipid interactions in living cells. Biophys. J. 101 (7), 1651-1660 (2011).
- Kleusch, C., Hersch, N., Hoffmann, B., Merkel, R., Csiszar, A. Fluorescent lipids: functional parts of fusogenic liposomes and tools for cell membrane labeling and visualization. Molecules. 17 (1), 1055-1073 (2012).
- Ries, J., Chiantia, S., Schwille, P. Accurate determination of membrane dynamics with line-scan FCS. Biophys. J. 96 (5), 1999-2008 (2009).
- Kolin, D. L., Wiseman, P. W. Advances in image correlation spectroscopy: measuring number densities, aggregation states, and dynamics of fluorescently labeled macromolecules in cells. Cell Biochem. Biophys. 49 (3), 141-164 (2007).
- Digman, M. A., et al. Measuring fast dynamics in solutions and cells with a laser scanning microscope. Biophys. J. 89 (2), 1317-1327 (2005).
- Ritchie, K., et al. Detection of non-Brownian diffusion in the cell membrane in single molecule tracking. Biophys. J. 88 (3), 2266-2277 (2005).
- Voie, A. H., Burns, D. H., Spelman, F. A. Orthogonal-plane fluorescence optical sectioning: three-dimensional imaging of macroscopic biological specimens. J. Microsc. 170, 229-236 (1993).
- Huisken, J., Swoger, J., Del Bene, ., Wittbrodt, F., J, E. H., Stelzer, Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Wohland, T., Shi, X., Sankaran, J., Stelzer, E. H. Single plane illumination fluorescence correlation spectroscopy (SPIM-FCS) probes inhomogeneous three-dimensional environments. Opt. Express. 18 (10), 10627-10641 (2010).

