기증자의 간을의 현지 외 정상 체온 기계 관류
Summary
여기에서 우리는 기증자 간 이식의 산소 전 현장 기계 관류를 설명하는 프로토콜을 제시한다. 이 문서에서는 조달 및 기계 관류에 대한 간 이식을 준비, 관류 액, 주요 관류 시스템을 준비하고 간 이식의 산소 정상 체온 기계 관류를 수행하는 단계 프로토콜에 의해 단계가 포함되어 있습니다.
Abstract
종래의 정적 저온 보존 (0-4 °의 C)와 대조적으로, 비원 기계 관류 도너 간 더 잘 보존을 제공 할 수있다. 장기 연속 관류 장기 품질을 향상시킬 수있는 기회를 제공하고, 이식하기 전에 공여자의 간 계외 생존력 평가를 허용한다. 이 비디오 기사는 예에 대한 단계 프로토콜에 의해 단계는 간동맥과 문맥의 연속 관류의 압력과 온도 조절 박동성 혈류를 제공하는 장치를 사용하여 인간의 기증자 간의 정상 체온 기계 관류 (37 ° C의)를 현장 제공합니다. 관류 유체는 두 개의 중공 사막의 산소 공급에 의해 산소를 함유하고, 온도 10 ° C, 37 ° C 사이에서 조절 될 수있다. 재관류 동안, 간 대사 활성뿐만 아니라, 부상의 정도는 관류 액으로부터 취한 샘플의 생화학 적 분석에 의해 평가 될 수있다. 기계 관류는 매우 유망한 도구입니다이식에 적합한 간 수를 늘릴.
Introduction
간 이식의 장기 보존 현재의 방법으로 세척하십시오 (예 : 위스콘신 대학교 솔루션 또는 히스티딘 – 트립토판 – 케 토글 루타 레이트 솔루션 등) 저온 (0-4 ℃) 보존 유체 기증자 간 후속 저장합니다. 이 방법은 정적 냉장 (SCS)라고합니다. 0-4 ℃에서의 간 대사 속도는 매우 낮지 만, 여전히 SCS 일 동안 제공 될 수없는 산소 0.27 μmol / 분 / g의 간 조직에 대한 요구가있다. SCS의 종래의 방법에 따라서, 도너 간의 (추가) 어느 정도의 손상을 초래한다. 보존 부상이 금액은 좋은 품질의 기증자의 간에서 문제가되지 않지만, 이미 기증자에 부상 어느 정도의 고통을 최적 간에서 중요하고 제한 요인이 될 수 있습니다. 이 때문에, 품질이 만족스럽지 못한 소위 확장 된 기준 공여체 (ECD) 간으로 간 자주 위험 O 같은 이식 거부F 조기 이식 실패가 너무 높은 것으로 간주된다. 지연 이식 기능, 주요 비 기능, 비 문합 담도 협착 (NAS)의 높은 비율은 순환 죽음 (DCD), 이전 기증자 또는 steatotic 이식 2의 수신자 후 기부에서 간의받는 사람에 기재되어있다. NAS는 간 이식 후의 이환 및 사망률의 주요 원인이다. NAS는 모두 외의의 뜻과 간내 기증자 담관에서 발생할 수 췌관 내 담즙 슬러지와 주조 형성 3,4 동반 될 수있다. NAS의 병인은 다 요인으로 생각되지만, 이식 및 이식시 보존 담관의 허혈 / 재관류 손상은 주요 기전의 2,5-로 확인되었다. DCD 이식의 이식 NAS의 개발을위한 가장 강력한 위험 요인의 하나로서 확인되었다. 장기 보존 동안 DCD 기증자, 냉 허혈 따뜻한 국소 빈혈의 기간의 조합, 이후 재관류수신자의 부상은 담관의 불량한 재생 능력과 조합하여, 간 이식 후 2,5- 섬유증 흉터 및 담관의 협소화를 초래, 담관의 비가역적인 손상, 책임 생각된다. NAS는 DCD 간 6-8를받은 환자의 30 %까지보고되었다. 그것은 이식 간 이식의 SCS의 현재 방법은 DCD 기증자의 것과 같은 preinjured ECD 간은 부족한 것이 분명되고있다. 다른 방법은 증가하고 이식 간은 ECD의 사용을 최적화하기 위해 필요하다.
기계 관류 (MP)는 SCS에 비하여, 도너의 장기 보존을 더 제공 할 수있다 장기 보존하는 방법이다. MP는 ECD 이식의 보존에 특히 관련이있을 수 있습니다. MP의 중요한 장점은 보존 기간 그래프트에 산소를 제공 할 수있는 가능성이다. MP는 다양한 온도에서 수행 될 수있다,(0 ~ 10 ° C의) 저체온 subnormothermic (10-36 ° C의)과 정상 체온 (36 ~ 37 ° C의) MP 피 롤리 돈 (NMP)으로 분류되어있다. MP 사용 온도에 따라, 관류 액의 형태는 조정되어야하고 많은 산소 온도 증가와 함께 제공되어야한다. 인간의 간 이식에 MP의 첫 번째 임상 응용 프로그램은 관류 액 (9, 10)의 활성 산소없이 저체온 관류 기반으로했다. 동물 모델에서 저체온 산소 MP (0-10 ° C는) 허혈에 대한 보호 효과를 표시되었습니다 / 간 재관류 손상은 11 접목 및 담즙의 peribiliary 혈관 총을 더 잘 보존 (12) 덕트 제공합니다. Subnormothermic은 20 ° C에서 MP를 산소 또는 30 ° C는 동물 모델에서 연구되었으며, SCS (13, 14)에 비해, DCD 용의 간 이식 이전 복구 기능을 제공하기 위해 도시되었다. 인간의 간의 subnormothermic 산소 MP의 가능성은 녹화했다고한다면 일곱 폐기 인간 공여자 간 (15)의 직렬로보고 하였다. NMP (37 ° C는) 16, 17을 이식하는 이식 가능성 및 이전 기능의 평가를 할 수 있습니다. 또한, MP는 이식 (18)의 회복과 소생을 용이하게 입증되었다 이식 전에 간 이식의 점진적 재가 온, 수 있습니다.
간 기계 관류에 대한 현재 프로토콜에서 사용되는 관류 장치는 연속 포털 흐름 및 박동성 동맥의 흐름을 제공하는 두 개의 원심 펌프를 사용하여 (간문맥과 간동맥을 통해) 듀얼 관류 할 수있다. 시스템은 압력 제어, 간 통해 흐름의 자동 조절을 허용 간내 저항에 의존한다. 두 중공 사막 산소 공급뿐만 아니라 CO 2의 제거를 위해, 간 이식의 산소화 허용한다. 온도는 MP의 의도 된 형태 (최소 temperat에 기초하여 설정 될 수있다 10 ° C의 URE). 유량, 압력 및 온도는 재관류 과정의 연속적인 제어를 허용 실시간으로 장치 상에 표시된다. 튜브, 저수지 및 산소 공급의 새로운 멸균 일회용 세트는 각각의 이식 (그림 1)의 관류 사용할 수 있습니다.
이 비디오 기술의 목적은이 새로 개발 간 관류 기계를 사용하여 인간 간 도너의 외부 계 정상 체온 기계 관류 단계 프로토콜에 의해 단계를 제공하는 것이다.
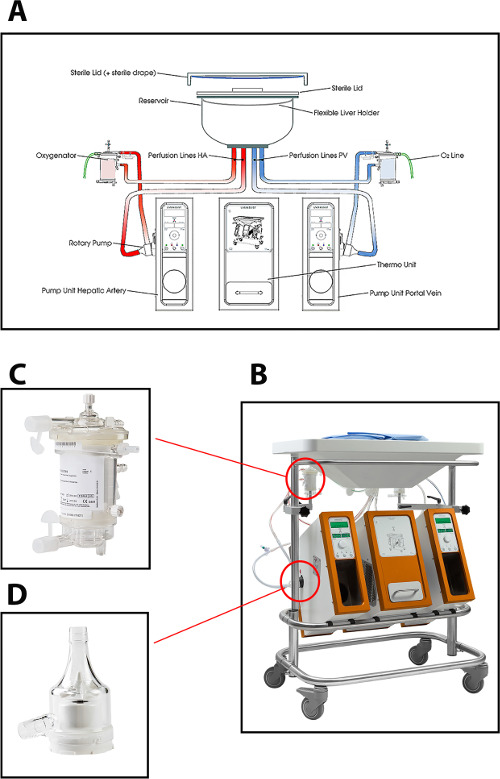
도 1 (A) 개략도, (B) 관류 시스템의 사진, (C) 산화 기의 가까이보기, 및 (D) 간 인간 공여자의 정상 체온 관류에 사용되는 원심 펌프.= "_ 빈"을 얻을>이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
이 동영상은 간동맥과 문맥을 통해 압력 제어 듀얼 관류을 가능하게하는 장치를 사용하여 인간의 기증자 간의 정상 체온 기계 관류에 대한 단계 프로토콜에 의해 단계를 제공합니다. 이 프로토콜에 따라 동안 관류 시스템의 기술적 장애는 발생하지 않았고, 모든 이식 잘 관류 잘 산소화이었다. 전 현장 관류 간 안정적인 혈역학을했고, 담즙 16, 17의 생산에 의해 정의 된대로, 대사 ?…
Declarações
The authors have nothing to disclose.
Acknowledgements
이 연구 작업은 재정적으로 모든 네덜란드, Innovatief Actieprogramma 흐로 닝언 (IAG-3), 월 Kornelis 드 콕에는 Stichting과 Tekke Huizingafonds에서 제공하는 보조금에 의해 지원되었다. 우리는 잠재적 인 폐기 간을 확인하고 동의서를 얻기위한 모든 네덜란드 이식 코디네이터에 감사하고 있습니다.
Materials
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Meredith No.8 | Vygon Nederlands B.V. | 1362082 | Bile duct cannula |
| Human albumin 200g/l / ALBUMAN | Sanquin | 15522598 | 100 ml |
| Modified parenteral nutrition | Baxter Nederland B.V. | N14G30E | 7.35 ml |
| Multivitamins for infusion / CERNEVIT | Baxter International Inc. | 9800927 | 7 ul |
| Concentrated trace elements for infusion / NUTRITRACE | B. Braun Melsungen AG | 14811332 | 7.35 ml |
| Metronidazole 5mg/ml | Baxter Nederland B.V. | 98181882 | 40 ml |
| Cefazoline / SERVAZOLIN | Sandoz B.V. | 15611337 | 2 ml |
| Fast acting insulin | various vendors | 20 ml | |
| Calcium glubionate, intravenous solution 10%, 137.5 mg/mL | Sandoz | 97038695 | 40 ml |
| Sterile H2O | Fresenius Kabi Nederland B.V. | 98084453 | 51.3 ml |
| NaCl 0.9% | Baxter Nederland B.V. | 15262510 | 160 ml |
| Heparin 5000 IE/ml for i.v. administration | LEO Pharma B.V. | 98026178 | 4 ml |
| Sodium bicarbonate 8,4% | B. Braun Melsungen AG | 97973874 | The amount depends on the pH |
| Packed red blood cell (in SAGM) | Blood bank (Sanquin) | N0012000 | 750 ml |
| Fresh frozen plasma | Blood bank (Sanquin) | N04030A0/N04030B0 | 900 ml |
Referências
- Plaats, A., et al. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann. Biomed. Eng. 32 (4), 623-631 (2004).
- op den Dries, S., Sutton, M. E., Lisman, Y., Porte, R. J. Protection of bile ducts in liver transplantation: Looking beyond ischemia. Transplantation. 92 (4), 373-379 (2011).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary complications after liver transplantation: Old problems and new challenges. Am. J. Transplant. 13 (2), 253-265 (2013).
- Buis, C. I., et al. Nonanastomotic biliary strictures after liver transplantation, part 1: Radiological features and risk factors for early vs. late presentation. Liver. Transpl. 13 (5), 708-718 (2007).
- Karimian, N., op den Dries, S., Porte, R. J. The origin of biliary strictures after liver transplantation: Is it the amount of epithelial injury or insufficient regeneration that counts. J. Hepatol. 58 (6), 1065-1067 (2013).
- Gastaca, M. Biliary complications after orthotopic liver transplantation: A review of incidence and risk factors. Transplant. Proc. 44 (6), 1545-1549 (2012).
- Sanchez-Urdazpal, L., et al. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology. 16 (1), 49-53 (1992).
- Dubbeld, J., et al. Similar liver transplantation survival with selected cardiac death donors and brain death donors. Br. J. Surg. 97 (5), 744-753 (2010).
- Guarrera, J. V., et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am. J. Transplant. 10 (2), 372-381 (2010).
- Henry, S. D., et al. Hypothermic machine preservation reduces molecular markers of ischemia/reperfusion injury in human liver transplantation. Am. J. Transplant. 12 (9), 2477-2486 (2012).
- Schlegel, A., Rougemont, O., Graf, R., Clavien, P. A., Dutkowski, P. Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts. J. Hepatol. 58 (2), 278-286 (2013).
- op den Dries, S., et al. Hypothermic oxygenated machine perfusion prevents arteriolonecrosis of the peribiliary plexus in pig livers donated after circulatory death. PLoS. One. 9 (2), e88521 (2014).
- Tolboom, H., et al. Subnormothermic machine perfusion at both 20 degrees C and 30 degrees C recovers ischemic rat livers for successful transplantation. J. Surg. Res. 175 (1), 149-156 (2012).
- Gringeri, E., et al. Subnormothermic machine perfusion for non-heart-beating donor liver grafts preservation in a swine model: A new strategy to increase the donor pool? Transplant. Proc. 44 (7), 2026-2028 (2012).
- Bruinsma, B. G., et al. Subnormothermic machine perfusion for ex vivo preservation and recovery of the human liver for transplantation. Am. J. Transplant. 14 (6), 1400-1409 (2014).
- op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am. J. Transplant. 13 (5), 1327-1335 (2013).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS. One. 9 (11), (2014).
- Minor, T., Efferz, P., Fox, M., Wohlschlaeger, J., Luer, B. Controlled oxygenated rewarming of cold stored liver grafts by thermally graduated machine perfusion prior to reperfusion. Am. J. Transplant. 13 (6), 1450-1460 (2013).
- Makowka, L., et al. Surgical technique of orthotopic liver transplantation. Gastroenterol. Clin. North. Am. 17 (1), 33-51 (1988).
- Hansen, T., et al. Histological examination and evaluation of donor bile ducts received during orthotopic liver transplantation–a morphological clue to ischemic-type biliary lesion?. Virchows Arch. 461 (1), 41-48 (2012).
- Monbaliu, D., Brassil, J. Machine perfusion of the liver: Past, present and future. Curr. Opin. Organ. Transplant. 15 (2), 160-166 (2010).
- Oldani, G., et al. Pre-retrieval reperfusion decreases cancer recurrence after rat ischemic liver graft transplantation. J. Hepatol. 61 (2), 278-285 (2014).
- Tromans, D. Temperature and pressure dependent solubility of oxygen in water: A thermodynamic analysis. Hydrometallurgy. 48 (3), 327-342 (1998).

