Ex-situ-normothermen Maschine Perfusion von Spenderlebern
Summary
Hier präsentieren wir ein Protokoll beschreibt, sauerstoffreiches ex situ Maschine Perfusion der Spenderleber Transplantate. Dieser Artikel enthält eine Schritt für Schritt-Protokoll zu beschaffen und bereiten den Lebertransplantat für Maschinendurchblutung, bereiten Sie die Perfusionsflüssigkeit, prime die Perfusion Maschine und durchzuführen, mit Sauerstoff angereicherten normothermen Maschine Perfusion des Transplantats.
Abstract
Im Gegensatz zu herkömmlichen statischen kalten Konservierung (0-4 ° C), kann ex situ-Perfusion Maschine eine bessere Konservierung von Spenderlebern. Kontinuierliche Perfusion von Organen die Möglichkeit bietet, Organqualität zu verbessern und ermöglicht ex situ Lebensfähigkeit Beurteilung der Spenderlebern vor der Transplantation. Dieses Video Artikel enthält eine Schritt für Schritt-Protokoll für Ex-situ-normothermen Maschine Perfusion (37 ° C) der menschlichen Spenderlebern mit einem Gerät, das einen Druck und Temperatur gesteuert pulsatile Perfusion der Leberarterie und kontinuierliche Perfusion der Pfortader stellt. Die Perfusionsflüssigkeit wird durch zwei Hohlfasermembran-Oxygenatoren mit Sauerstoff angereichert und die Temperatur zwischen 10 ° C und 37 ° C geregelt werden. Während der Perfusion kann die metabolische Aktivität in der Leber als auch der Grad der Schädigung durch die biochemische Analyse von Proben aus der Perfusionsflüssigkeit genommen beurteilt werden. Maschinendurchblutung ist ein sehr vielversprechendes Werkzeugum die Anzahl von Lebern, die zur Transplantation geeignet sind, zu erhöhen.
Introduction
Die aktuelle Methode der Organkonservierung in Lebertransplantation ist spülen mit und anschließende Lagerung von Spenderlebern in kaltem (0-4 ° C) Konservierungsfluid (wie University of Wisconsin Lösung oder Histidin-Tryptophan-Ketoglutarat-Lösung). Dieses Verfahren wird als statisches Kühllager (SCS) bezeichnet. Obwohl die Stoffwechselrate von Lebern bei 0-4 ° C sehr gering ist, besteht immer noch die Nachfrage nach Sauerstoff 0,27 umol / min / g Lebergewebe, die bei der SCS 1 nicht bereitgestellt werden kann. Das herkömmliche Verfahren zum SCS führt daher zu einem gewissen Grad von (zusätzlichen) Verletzung des Spenderlebern. Während diese Menge an Konservierungsschaden ist nicht ein Problem in Spenderlebern von guter Qualität kann eine kritische und begrenzende Faktor bei suboptimalen Lebern, die bereits einen gewissen Grad der Schädigung im Spender erlitten werden. Aus diesem Grund werden Lebern mit suboptimaler Qualität oder sogenannten erweiterten Kriterien Donor (ECD) Leber zur Transplantation häufig das Risiko, o abgelehntf frühen Transplantatversagen wird als zu hoch zu sein. Hohe verzögerten Transplantatfunktion, primäre nicht-Funktion, und nicht-Anastomosen Gallengangstenosen (NAS) haben bei Empfängern von Lebern von der Spende nach dem Kreislauf Tod (DCD), ältere Spender oder Empfänger von Transplantaten steatotic 2 beschrieben. NAS sind eine Hauptursache von Morbidität und Mortalität nach einer Lebertransplantation. NAS kann in beiden extra- und intrahepatischen Gallengänge Spender auftreten und kann durch intraduktale Gallenschlamm und Guss Bildung 3,4 begleitet werden. Obwohl die Ätiologie von NAS wird gedacht multifaktoriell zu sein, hat Ischämie / Reperfusion Verletzungen der Gallengänge bei Transplantaterhaltung und Transplantation als eine wichtige zugrunde liegende Mechanismus 2,5 identifiziert. Transplantation eines DCD Transplantats wurde als einer der stärksten Risikofaktoren für die Entwicklung von NAS identifiziert. Die Kombination von einer Periode warmer Ischämie in einem DCD Donor Kaltischämiezeit während Organkonservierung und nachfolgende ReperfusionVerletzung im Empfänger gedacht für irreversible Schädigung der Gallenwege, die in Kombination mit einem schlechten regenerative Kapazität der Gallenwege, ergibt fibrotische Narbenbildung und Verengung der Gallengänge nach einer Lebertransplantation 2,5 verantwortlich. NAS wurden in bis zu 30% der Patienten, die eine Leber DCD 6-8 berichtet. Es ist deutlich geworden, dass die aktuelle Methode der SCS von Lebertransplantationen für eine Transplantation nicht ausreichend für preinjured ECD Lebern wie die von DCD Spender ist. Alternative Methoden nötig sind, um zu steigern und optimieren den Einsatz von ECD Lebern für Transplantationen.
Maschine Perfusion (MP) ist ein Verfahren zur Organkonservierung, die eine bessere Konservierung von Spenderorganen bereitstellen kann, verglichen mit SCS. MP kann zur Konservierung von Transplantaten ECD besonders relevant sein. Ein wichtiger Vorteil der MP ist die Möglichkeit, Sauerstoff an das Transplantat während der Konservierungsdauer bereitzustellen. MP kann bei verschiedenen Temperaturen durchgeführt werden,die als hypo (0-10 ° C), subnormothermic (10-36 ° C) und normothermic (36-37 ° C), MP (NMP) klassifiziert wurden. Je nach dem für MP verwendeten Temperatur, hat die Art der Perfusionsflüssigkeit angepaßt werden und mit steigender Temperatur mehr Sauerstoff zugeführt werden sollte. Die erste klinische Anwendung von MP in menschlichen Lebertransplantation wurde am hypothermen Perfusion ohne aktive Sauerstoffversorgung des Perfusionsflüssigkeit 9,10 basiert. In Tiermodellen hat hypo oxygenierten MP (0-10 ° C) wurde gezeigt, dass schützenden Wirkungen gegen Ischämie / Reperfusion von Lebertransplantationen 11 und eine bessere Konservierung des peribiliären Gefäßplexus von den Gallengängen 12 zur Verfügung zu stellen. Subnormothermic oxygenierten MP bei 20 ° C oder 30 ° C ist auch in Tiermodellen untersucht worden, und es wurde gezeigt, um eine schnellere Genesung von Transplantatfunktion DCD Lebern bereitzustellen, im Vergleich zu 13,14 SCS. Die Machbarkeit subnormothermic Sauerstoff angereichert MP menschlicher Lebern war recständig in einer Reihe von sieben verworfen menschlichen Spenderlebern 15 gemeldet. NMP (37 ° C) ist für die Beurteilung der Transplantatüberlebensfähigkeit und Funktionalität vor der Transplantation 16,17. Darüber hinaus ermöglicht die schrittweise MP Wiedererwärmung des Transplantats vor der Transplantation, die gezeigt wurde, dass die Verwertung und Wiederbelebung des Transplantats 18 zu erleichtern.
Die Perfusionsvorrichtung im aktuellen Protokolls für hepatische Perfusion Maschine verwendet ermöglicht Dual Perfusion (über die Pfortader und die Leberarterie) mit zwei Kreiselpumpen, die einen kontinuierlichen Pfortaderflusses und eine pulsierende arterielle Strömung bereitzustellen. Das System ist druckgesteuert, so dass die automatische Regulierung der Strömung durch die Leber, in Abhängigkeit von der intrahepatischen Beständigkeit. Zwei Hohlfasermembran-Oxygenatoren ermöglichen die Sauerstoffversorgung des Transplantats, als auch für die Entfernung von CO 2. Die Temperatur kann auf Basis der beabsichtigten Art der MP (Minimum temperat eingestellt werden ure von 10 ° C). Fluss, Druck und Temperatur werden auf der Vorrichtung in Echtzeit, die eine kontinuierliche Kontrolle der Perfusion Vorgangs angezeigt. Eine neue sterile Einweg-Schlauchsatz, Behälter und Oxygenatoren für die Perfusion von jedem Transplantat (Abbildung 1) zur Verfügung.
Das Ziel dieses Artikels ist es, Video eine Schritt für Schritt-Protokoll für ex situ normothermen Maschine Perfusion des menschlichen Spenderlebern mit dieser neu entwickelten Leberperfusion Maschine bereitzustellen.
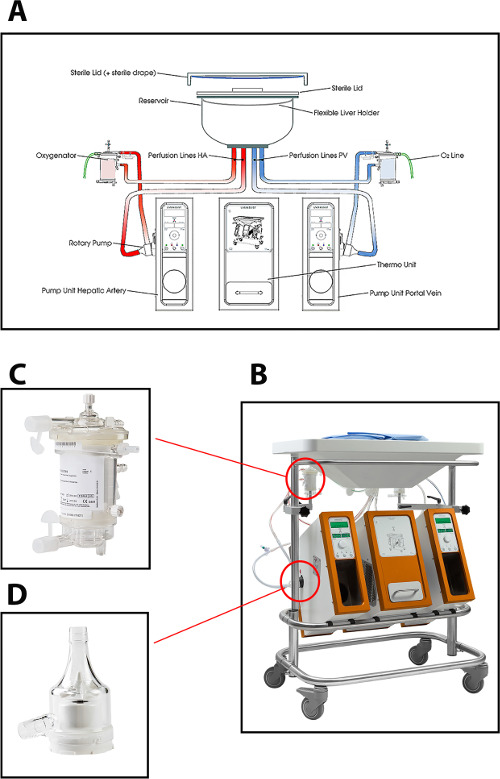
Figur 1: (A) Eine schematische Zeichnung, (B) ein Foto der Perfusion Maschine (C) eine genauere Ansicht des Oxygenators, und (D) Zentrifugalpumpe zum normothermic Perfusion von menschlichem Spenderlebern verwendet.bekommen = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
Dieses Video bietet eine Schritt für Schritt-Protokoll für normothermen Maschine Perfusion des menschlichen Spenderlebern mit einem Gerät, das druckgesteuerten Zwei Perfusion durch die Leberarterie und Pfortader ermöglicht. Während nach diesem Protokoll, habe technische Störungen der Perfusion Maschine nicht auf, und alle Transplantate waren gut perfundierten und gut mit Sauerstoff. Die Ex-situ perfundierten Lebern hatte stabile Hämodynamik und waren metabolisch aktiv, wie die Produktion von Gallenflüss…
Declarações
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde finanziell durch Zuschüsse von Innovatief Actieprogramma Groningen (IAG-3), Jan de Cock Kornelis Stichting und Tekke Huizingafonds vorgesehen, die alle in den Niederlanden unterstützt. Wir sind dankbar für alle niederländischen Transplantation Koordinatoren für die Ermittlung der potentiellen verworfen Leber und informierte Zustimmung erhalten.
Materials
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Meredith No.8 | Vygon Nederlands B.V. | 1362082 | Bile duct cannula |
| Human albumin 200g/l / ALBUMAN | Sanquin | 15522598 | 100 ml |
| Modified parenteral nutrition | Baxter Nederland B.V. | N14G30E | 7.35 ml |
| Multivitamins for infusion / CERNEVIT | Baxter International Inc. | 9800927 | 7 ul |
| Concentrated trace elements for infusion / NUTRITRACE | B. Braun Melsungen AG | 14811332 | 7.35 ml |
| Metronidazole 5mg/ml | Baxter Nederland B.V. | 98181882 | 40 ml |
| Cefazoline / SERVAZOLIN | Sandoz B.V. | 15611337 | 2 ml |
| Fast acting insulin | various vendors | 20 ml | |
| Calcium glubionate, intravenous solution 10%, 137.5 mg/mL | Sandoz | 97038695 | 40 ml |
| Sterile H2O | Fresenius Kabi Nederland B.V. | 98084453 | 51.3 ml |
| NaCl 0.9% | Baxter Nederland B.V. | 15262510 | 160 ml |
| Heparin 5000 IE/ml for i.v. administration | LEO Pharma B.V. | 98026178 | 4 ml |
| Sodium bicarbonate 8,4% | B. Braun Melsungen AG | 97973874 | The amount depends on the pH |
| Packed red blood cell (in SAGM) | Blood bank (Sanquin) | N0012000 | 750 ml |
| Fresh frozen plasma | Blood bank (Sanquin) | N04030A0/N04030B0 | 900 ml |
Referências
- Plaats, A., et al. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann. Biomed. Eng. 32 (4), 623-631 (2004).
- op den Dries, S., Sutton, M. E., Lisman, Y., Porte, R. J. Protection of bile ducts in liver transplantation: Looking beyond ischemia. Transplantation. 92 (4), 373-379 (2011).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary complications after liver transplantation: Old problems and new challenges. Am. J. Transplant. 13 (2), 253-265 (2013).
- Buis, C. I., et al. Nonanastomotic biliary strictures after liver transplantation, part 1: Radiological features and risk factors for early vs. late presentation. Liver. Transpl. 13 (5), 708-718 (2007).
- Karimian, N., op den Dries, S., Porte, R. J. The origin of biliary strictures after liver transplantation: Is it the amount of epithelial injury or insufficient regeneration that counts. J. Hepatol. 58 (6), 1065-1067 (2013).
- Gastaca, M. Biliary complications after orthotopic liver transplantation: A review of incidence and risk factors. Transplant. Proc. 44 (6), 1545-1549 (2012).
- Sanchez-Urdazpal, L., et al. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology. 16 (1), 49-53 (1992).
- Dubbeld, J., et al. Similar liver transplantation survival with selected cardiac death donors and brain death donors. Br. J. Surg. 97 (5), 744-753 (2010).
- Guarrera, J. V., et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am. J. Transplant. 10 (2), 372-381 (2010).
- Henry, S. D., et al. Hypothermic machine preservation reduces molecular markers of ischemia/reperfusion injury in human liver transplantation. Am. J. Transplant. 12 (9), 2477-2486 (2012).
- Schlegel, A., Rougemont, O., Graf, R., Clavien, P. A., Dutkowski, P. Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts. J. Hepatol. 58 (2), 278-286 (2013).
- op den Dries, S., et al. Hypothermic oxygenated machine perfusion prevents arteriolonecrosis of the peribiliary plexus in pig livers donated after circulatory death. PLoS. One. 9 (2), e88521 (2014).
- Tolboom, H., et al. Subnormothermic machine perfusion at both 20 degrees C and 30 degrees C recovers ischemic rat livers for successful transplantation. J. Surg. Res. 175 (1), 149-156 (2012).
- Gringeri, E., et al. Subnormothermic machine perfusion for non-heart-beating donor liver grafts preservation in a swine model: A new strategy to increase the donor pool? Transplant. Proc. 44 (7), 2026-2028 (2012).
- Bruinsma, B. G., et al. Subnormothermic machine perfusion for ex vivo preservation and recovery of the human liver for transplantation. Am. J. Transplant. 14 (6), 1400-1409 (2014).
- op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am. J. Transplant. 13 (5), 1327-1335 (2013).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS. One. 9 (11), (2014).
- Minor, T., Efferz, P., Fox, M., Wohlschlaeger, J., Luer, B. Controlled oxygenated rewarming of cold stored liver grafts by thermally graduated machine perfusion prior to reperfusion. Am. J. Transplant. 13 (6), 1450-1460 (2013).
- Makowka, L., et al. Surgical technique of orthotopic liver transplantation. Gastroenterol. Clin. North. Am. 17 (1), 33-51 (1988).
- Hansen, T., et al. Histological examination and evaluation of donor bile ducts received during orthotopic liver transplantation–a morphological clue to ischemic-type biliary lesion?. Virchows Arch. 461 (1), 41-48 (2012).
- Monbaliu, D., Brassil, J. Machine perfusion of the liver: Past, present and future. Curr. Opin. Organ. Transplant. 15 (2), 160-166 (2010).
- Oldani, G., et al. Pre-retrieval reperfusion decreases cancer recurrence after rat ischemic liver graft transplantation. J. Hepatol. 61 (2), 278-285 (2014).
- Tromans, D. Temperature and pressure dependent solubility of oxygen in water: A thermodynamic analysis. Hydrometallurgy. 48 (3), 327-342 (1998).

