Nanopartículas Lipídicas Sólidas (NLS) para intracelular Segmentação Aplicações
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
Veículos de entrega baseado em nanopartículas têm mostrado uma grande promessa para aplicações dirigidas intracelulares, fornecendo um mecanismo para alterar especificamente sinalização celular e expressão gênica. Estes veículos podem ser carregados com medicamentos, proteínas, ácidos nucleicos e concebidos para influenciar as respostas celulares e conseguir um efeito desejado em tecidos-alvo. Muitos tipos de nanocarriers têm sido exploradas para benefício terapêutico e de diagnóstico, incluindo lipidos, polímeros, silício e materiais magnéticos. Estes sistemas são atraentes devido ao seu potencial para a entrega da droga localizada, aumento da concentração terapêutica em tecidos-alvo e redução de toxicidade sistêmica.
Nanopartículas de lípidos sólidas (NLS) são um exemplo bem estudado de um sistema de entrega de nanopartículas que surgiu como um veículo de entrega de droga promissora nos últimos anos. SLNs pode ser facilmente formulado para várias aplicações, incluindo bio-sensor 1, cosméticos 2, e tentrega herapeutic 3-7. A sua utilidade advém do facto de que eles são constituídos inteiramente de reabsorvíveis, lípidos não tóxicos, resultando em melhor biocompatibilidade. Durante a síntese, os fármacos lipofilicos podem ser incorporados em veículos SLN, aumentando assim a solubilidade do fármaco e da aptidão para administração parentérica. SLN veículos também ajudam a estabilizar terapêuticas encapsuladas, reduzindo sua degradação e depuração, e maximizando a ação terapêutica. Estes veículos são particularmente bem adequados para longa actuação, preparações de libertação controlada devido à sua estabilidade à temperatura do corpo 3,4,8,9. Importante, a encapsulação de fármacos em nanopartículas de lípidos altera os perfis farmacocinéticos intrínsecas das moléculas de fármaco. Isto proporciona uma vantagem potencial de permitir a libertação controlada de fármacos com um índice terapêutico estreito. A taxa de libertação de agentes terapêuticos incorporados-NLS pode ser regulado com base na taxa de degradação do lípido ou a taxa de difusão da droga namatriz lipídica.
SLNs são muitas vezes modificados para se acumular nos tecidos alvo específicos. Por exemplo, o tamanho (tipicamente maior do que 10 nm) potencia a retenção na circulação, em que a vasculatura de tecido tumoral gotejante facilita a deposição. Além disso, a via de administração da partícula foi mostrado para alterar a biodistribuição com o potencial para segmentar estruturas fisiológicas específicas tais como os nódulos linfáticos 10,11. Após a deposição nos tecidos alvo, conseguindo interacções celulares apropriados e eventual internalização de nanopartículas é um desafio devido à capacidade das membranas celulares para controlar selectivamente o fluxo de iões e moléculas para dentro e para fora da célula 12. Para facilitar a absorção celular, é possível modificar nanocarriers com ligandos específicos, incluindo péptidos, moléculas pequenas, anticorpos monoclonais e 13,14. Vários mecanismos incluindo tanto passiva penetração e transporte activo de nanopartículasatravés da membrana celular foram previamente descritos 3,12,15. Em geral, demonstrou-se que as interacções célula-nanopartículas são influenciadas pelas propriedades físico-químicas das nanopartículas, incluindo o tamanho, forma, carga de superfície e a química de superfície, além de parâmetros específicos de células, tais como tipo de célula ou a fase do ciclo celular 12.
Uma investigação anterior demonstrou a síntese de sub-10 SLNs nm para 16 tópicos e aplicações de detecção de biomarcadores 1 utilizando o método de 17 temperatura de inversão de fase (PIT). Este é um método de síntese 2 suave onde a composição permanece constante enquanto a temperatura é gradualmente alterado. Agitação contínua da solução aquecida, à medida que arrefece a resultados de RT em uma nanoemulsão. Este processo resulta na síntese de NLS com tamanho de partícula menor do que 1 relatado anteriormente usando vários métodos para a síntese do lípido nanoparticles 17-22. A escala de tamanho resultante, menos de 20 nm, proporciona uma vantagem para aplicações de segmentação intracelulares devido ao aumento da área superficial eo potencial para interações celulares avançados.
Um esquema de NLS, concebido para proporcionar um corante fluorescente ou terapêutico, é mostrado na Figura 1. Os SLNs consistem de um lípido interior (por exemplo, alcano linear), que permite a incorporação de compostos lipófilos (por exemplo, corantes ou agentes terapêuticos) e um exterior surfactante (surfactante não iónico por exemplo, linear) rodeada por água. Neste estudo, SLNs foram carregadas com um corante fluorescente e utilizado como um modelo para investigar interacções célula-partículas. Fibroblastos dérmicos humanos primários e células dendríticas de rato foram expostos a corante carregado-NLS ao longo do tempo, a fim de caracterizar as interacções com respeito à toxicidade e a absorção das partículas. Um grupo 3- (4,5-dimetiltiazol-2-il) -2,5-diphenylphenyltetrazolium (MTT) foi utilized, a fim de estabelecer níveis de dosagem adequados. A microscopia de fluorescência e citometria de fluxo foram utilizados dois métodos para analisar a absorção de partículas in vitro.
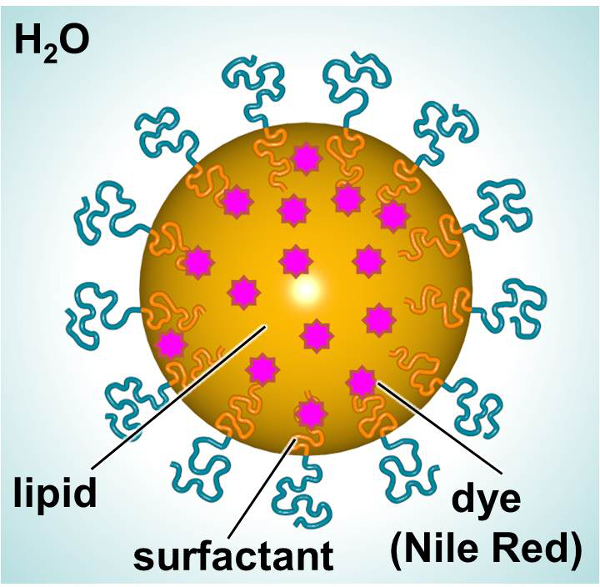
Figura 1. Esquema da SLN mostrando os principais constituintes. Por favor clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Neste estudo, a síntese de NLS e a sua aplicabilidade para aplicações destinadas intracelulares foram exploradas. Estas nanopartículas biocompatíveis têm mostrado promissores como veículos de entrega para várias aplicações, incluindo a entrega de drogas, o silenciamento do gene, e tecnologias de vacina 25-30. Ultra-pequenas SLNs foram sintetizados usando um processo fácil, e as suas interacções com células epiteliais primárias e células imunitárias primárias foram exploradas. SLNs foram conc…
Declarações
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
Referências
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

