Een endotheliale Planar Cell Model for Imaging Immunologische Synapse Dynamics
Summary
Adaptive immunity is controlled by dynamic ‘immunological synapses’ formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of ‘planar cellular APC model’.
Abstract
Adaptieve immuniteit wordt geregeld door dynamische interacties tussen T-cellen en antigeen-presenterende cellen ("APC's") genoemd "immunologische synapsen. Binnen deze intieme cel-cel-interfaces discrete sub-cellulaire clusters van MHC / Ag-TCR, F-actine, hechting en signaalmoleculen vormen en snel te verbouwen. Deze dynamiek wordt gedacht dat ze kritische factoren voor zowel de efficiëntie en kwaliteit van de immuunresponsen die zich ontwikkelen en dus van beschermende immuniteit tegen pathologische. Huidige begrip van immunologische synapsen met fysiologische APC's wordt beperkt door de ontoereikendheid van de verkregen beeldresolutie. Hoewel kunstmatig substraat modellen (bijvoorbeeld vlakke lipidendubbellagen) bieden een uitstekende resolutie en zijn zeer waardevolle hulpmiddelen geweest, ze zijn inherent niet-fysiologische en ongenuanceerd. Vasculaire en lymfatische endotheelcellen naar voren zijn gekomen als een belangrijke perifere weefsels (of stromale) compartiment van 'semi-beroepal APCs. Deze APC's (die het merendeel van de moleculaire machinerie van professionele APC's tot expressie) hebben de unieke eigenschap van het vormen nagenoeg vlak celoppervlak en gemakkelijk te transfecteren (bijvoorbeeld met fluorescente proteïne reporters). Hierin een fundamentele benadering van endotheelcellen als nieuw en fysiologische "vlakke cellulaire APC model" voor verbeterde beeldvorming en ondervraging van fundamentele antigene signaleringsprocessen uitvoering worden beschreven.
Introduction
T lymfocyten een tak van het adaptieve immuunsysteem gekenmerkt door het vermogen om efficiënt te herkennen peptide-antigeen (Ag) gebonden aan major histocompatibility complex (MHC) moleculen door hun T-celreceptoren (TCR's) 1. Naïeve lymfocyten constitutief migreren en scannen 'professionele Ag presenterende cellen (APC's, bijvoorbeeld, dendritische cellen) in lymfeklieren, terwijl het geheugen / effector-T-cellen nodig hebben om effectief te overzien een zeer breed scala van APC's en potentieel doelwit cellen in perifere weefsels.
In de min na de eerste opname van verwante Ag op een APC, lymfocyten arresteren hun migratie en beginnen aan een gespecialiseerde intieme cel-cel-interface genaamd 'immunologische synaps' vormen (IS). Aanhoudende (dwz 30-60 min) IS contacten nodig zijn om te versterken en te ondersteunen signalering 2-7. Opkomende studies identificeren die binnen de IS, is de continue vorming en snelle remodeling van discrete sub-cellulaire signalering micro-clusters (dwz bevattende MHC / Ag-TCR, F-actine, adhesie en signaalmoleculen) de sterkte en de kwaliteit van de verkregen immuunreacties 07/02 bepalen. Echter, dynamische details en regulerend mechanisme van dit proces onvolledig begrepen 8,9. Dit vloeit grotendeels voort uit de technische uitdagingen in verband met onregelmatige topologieën van APC oppervlakken en slecht gecontroleerde oriëntatie van de cel-cel interactie vliegtuigen, kwesties die diep beperken de vereiste spatiotemporele imaging benaderingen 8-10 (Figure1A).
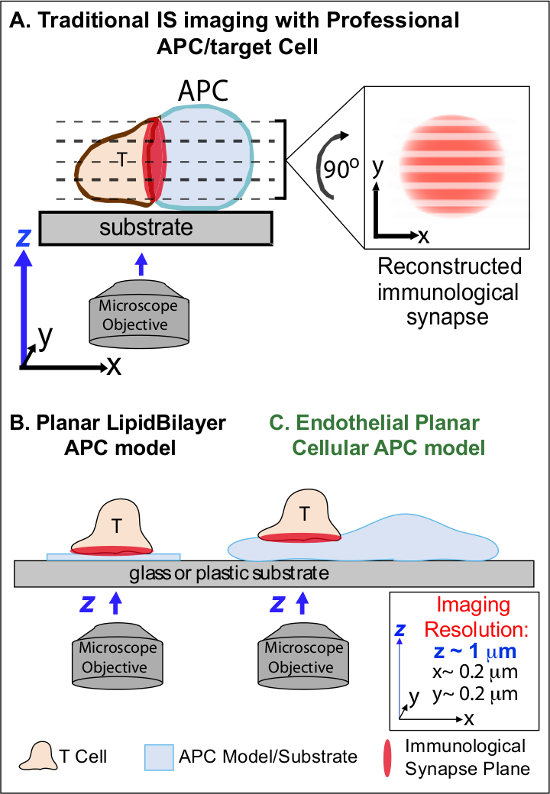
Figuur 1. Een Fysiologische Planar Cell APC Model for Imaging Immunologische Synapse Dynamics. Het schema illustreert traditionele beeldvorming van immunologische synaps tussen een T-cel en een professio nal APC (A) en T-cel en een traditionele vlakke lipide dubbellaag APC model (B) in relatie tot deze nieuwe endotheliale vlakke APC model (C). Professionele APCs bieden fysiologische immunologische synapsen maar bieden weinig georiënteerde cel-interface (dat wil zeggen ten opzichte van de optimale xy beeldvlak; resolutie ~ 0,2 pm), die dramatisch compromissen ruimtelijke (z beeldvlak resolutie ~ 1 micrometer) en tijd (dat wil zeggen, vanwege de noodzaak om herhaaldelijk gescand door alle z beeldvlakken) oplossing van beeldvorming. Bilaag modellen hebben een vlakke topologie die optimale spatiotemporele beeldvorming resolutie voorziet, maar ook sterk vereenvoudigd, niet-fysiologische en rigide. Deze endotheelcellen model combineert de vlakke topologie van lipidendubbellagen met de fysiologische substraat van een klassieke APC om een optimale ruimtelijke en temporele beeldvorming resolutie leveren in een fysiologische omgeving.m / files / ftp_upload / 53.288 / 53288fig1large.jpg "target =" _ blank "> Klik hier om een grotere versie van deze figuur te bekijken.
Vorige werk is gedeeltelijk omzeild deze obstakels door het ontwikkelen vlakke ondergrond modellen (dwz lipidendubbellagen en antilichaam-gecoate oppervlakken) die optimale spatiotemporele resolutie (dwz bieden, via de vaststelling van de T-cel activatie oppervlak in een enkel plan dat parallel aan de optimale xy beeldvorming vliegtuig) 11-15 (Figuur 1B). Deze modellen hebben belangrijke inzichten vergemakkelijkt in de subcellulaire / moleculaire dynamica dat antigene signalering in T-cellen, met inbegrip van de ontdekking van dynamische actine / TCR signalering micro-clusters 7,11-14 controleren. Echter, dergelijke modellen inherent oversimplified, evenals stijve (evenwel de ontwikkeling / studie van 3-dimensionale topologische kenmerken) (Figuur 1B). Daarom blijft het onzeker hoe dergelijke bevindingen aan phy betreffensiologic cel-cel immune surveillance.
Hoewel nog weinig bestudeerd, vasculaire en lymfatische endotheelcellen zijn in opkomst als een grote (dwz, groter in aantal dan alle professionele APC's, door ~ 1000-voudig) perifere compartiment van 'semi-professioneel "APC's 16-18. Deze cellen brengen MHC-I, MHC-II en een veelheid aan co-stimulator moleculen (bijvoorbeeld CD40, LFA3, ICOSL, 4-1BB, OX40L, TL1A, PD-L1, maar niet CD80 en CD86) en strategisch gepositioneerd aan de bloed-weefsel interface waar ze dienen gespecialiseerde sentinel functies 16-18. Vorige studies aangetoond dat endotheelcellen effectief opnieuw stimuleren effector / geheugen, maar niet naïeve T-cellen 19-25. Aldus endotheelcellen waarschijnlijk unieke APC rollen in effector fase van adaptieve immuunreacties in de perifere weefsels, zoals lokale invloed op T-celactivering, differentiatie, geheugen en tolerantie 16,17,26. Critisch, wanneer gekweekt in vitro endotheliale cellen vormen vrijwel vlakke celoppervlakken en gemakkelijk te transfecteren (bijvoorbeeld met fluorescente proteïne reporters). Deze functies zijn ideaal voor hoge spatiotemporele resolutie beeldvorming van topologische dynamiek in cel-cel interacties 19,27. Zo endotheelcellen kunnen dienen als een fysiologische "vlakke cellulaire APC-model duidelijk geschikt voor het onderzoek van de subcellulaire / moleculaire remodeling mechanismen antigeenherkenning drijven en te reguleren responsen (figuur 1C) 19,20.
Eerder vastgestelde complementaire beeldvormingstechnieken (waaronder transfectie van endotheel cellen met fluorescent eiwit makers van de plasmamembraan en cytosol) voor het bestuderen van de details van leukocyt-endotheel interactie tijdens hechting en transendotheliale migratie 27, bleek dat leukocyten actief sonde het oppervlak van het endotheel door dynamische inbrengen van eend terugtrekken van sub-micron-schaal, actine-rijke cilindrische uitsteeksels (~ 200-1000 nm in diameter en diepte) genoemd invadosome-achtige uitsteeksels (dat wil zeggen, 'POPs') 27,28. Deze beeldvormingstechnieken zijn verder uitgebreid met de creatie protocollen te profiteren van endotheliale APC functie om de eerste werkwijzen voor spatiotemporele hoge resolutie afbeelding van de T-cel-endotheliale immunologische synaps gerapporteerde 19,20 ontwikkelen en verder hierin beschreven. Een centrale bevinding afgeleid van deze nieuwe vlakke cellulaire APC model is dat T-cel POPs functioneren, zowel in het bevorderen van de initiële Ag detectie en bij het instandhouden van de daaropvolgende signalering. Inderdaad, arrays van meerdere POPs (die werden gestabiliseerd en opgebouwd in reactie op calciumflux initiële) tonen verrijking in TCR en moleculen die wijzen op actieve signalering zoals PKC-Q, ZAP-70, fosfotyrosine en HS1. Daarom POPs lijken een driedimensionale fysiologische equivalent aan het TCR-signalering micro vertegenwoordigenclusters gezien op vlakke dubbellaag modellen. Deze aanpak, dus onthult gevoelig / rapporten moleculaire en architecturale (en impliciete biomechanische) dynamiek anders niet aantoonbaar.
De hierin beschreven werkwijze moet nuttig zijn om de kloof tussen professionele APC en kunstmatige APC substraat modellen om ons vermogen om fundamentele mechanismen van adaptieve immuunreacties ondervragen verbeteren zijn. Hoewel hier de nadruk op de activatie van CD4 + Th1-type effector / geheugencel kan deze basisaanpak gemakkelijk worden aangepast aan een breed scala van T-cel soorten en Ags bestuderen, zoals hieronder besproken.
Protocol
Representative Results
Discussion
Kortom, dit protocol beschrijft methoden voor het onderzoeken van endotheelcellen als i) weinig bestudeerd fysiologische APC's en ii) als een nieuw type 'vlakke cellulaire APC model'. Wat het eerstgenoemde is geworden steeds duidelijk zijn dat niet-hematopoietische perifere (of "stromale") APCs spelen cruciale, niet-redundante functies (bijv tegenover hematopoietische APCs) de vormgeving adaptieve immuunreacties 16-18. Onder dergelijke 'semi-professioneel "APC's, va…
Declarações
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
Referências
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell – dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by ‘invadosome-like protrusions’. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).

