Ein Endothelial Planar Zellmodell für Imaging immunologischen Synapse Dynamics
Summary
Adaptive immunity is controlled by dynamic ‘immunological synapses’ formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of ‘planar cellular APC model’.
Abstract
Adaptiven Immunität wird von dynamischen Wechselwirkungen zwischen T-Zellen und Antigen-präsentierenden Zellen ("APCs") reguliert die so genannte "immunologischen Synapsen. Innerhalb dieser intimen Zell-Zell-Schnittstellen diskreten subzellulärer Cluster von MHC / Ag-TCR, F-Actin, Adhäsion und Signalmoleküle bilden und umgestalten schnell. Diese Dynamik werden gedacht, um kritische Determinanten der sowohl die Effizienz und die Qualität der Immunantwort, die sich entwickeln und damit der Schutz gegen pathologische Immunität. Aktuelle Verständnis der immunologischen Synapsen mit physiologischer APCs wird durch die Unzulänglichkeit der erhältliche Bildauflösung beschränkt. Obwohl künstlichen Substrat-Modelle (zB planaren Lipid-Doppelschichten) bieten hervorragende Auflösung und waren äußerst wertvolle Instrumente, sie sind von Natur aus nicht-physiologischen und vereinfacht. Vaskulären und lymphatischen Endothelzellen haben sich als wichtige peripheren Gewebe (oder Stroma) Abteil "semi-Beruf entstandenal APCs ". Diese APCs (die meisten der molekularen Maschinerie der professionellen APCs Express) haben die einzigartige Eigenschaft von nahezu planaren Zelloberfläche bilden und sind (mit fluoreszierenden Proteins Reportern zB) leicht transfizierbar. Hier ein grundlegendes Konzept für Endothelzellen als neuartige und physiologische 'planaren Zell APC-Modell "für eine verbesserte Bildverarbeitung und Abfrage der Grundantigenen Signalprozesse zu implementieren beschrieben.
Introduction
T-Lymphozyten sind ein Zweig des adaptiven Immunsystems gekennzeichnet durch die Fähigkeit, Peptidantigen (Ag) effizient zu erkennen Haupthistokompatibilitätskomplex (MHC) gebundenen Moleküle durch ihre T-Zell-Rezeptoren (TCRs) 1. Naive Lymphozyten konstitutiv migrieren und scannen Berufs Ag-präsentierende Zellen "(APC; zB dendritische Zellen) innerhalb von Lymphknoten, während Memory / Effektor-T-Zellen benötigen, um eine extrem breite Palette von APCs und potentiellen Zielzellen im peripheren Gewebe effektiv zu überwachen.
Im min nach dem erstmaligen Ansatz des verwandten Ag auf einer APC, Lymphozyten zu verhaften ihre Migration und beginnen, eine spezialisierte intime Zell-Zell-Schnittstelle genannt 'immunologischen Synapse' zu bilden (IS). Anhaltende (dh 30-60 min) Kontakte sind erforderlich, um zu verstärken und zu erhalten Signalisierungs 2-7. Schwellen Studien identifizieren, die innerhalb der IS, ist es die kontinuierliche und schnelle Bildung remodeling diskreter subzellulären Signalisierungsmikrocluster (dh enthaltend MHC / Ag-TCR, F-Actin, Adhäsion und Signalmolekülen), die die Stärke und Qualität der resultierenden Immunantworten 2-7 zu bestimmen. Allerdings sind dynamische Details und regulatorischen Mechanismus dieses Prozesses unvollständig verstanden 8,9. Dies ergibt sich im Wesentlichen aus technischen Herausforderungen mit unregelmäßigen Topologien von APC Oberflächen und schlecht kontrollierte Ausrichtung der Zell-Zell-Interaktion Flugzeuge, Fragen, die zutiefst begrenzen die erforderliche Raumzeit-Bildgebung assoziiert nähert 8-10 (Abbildung 1a).
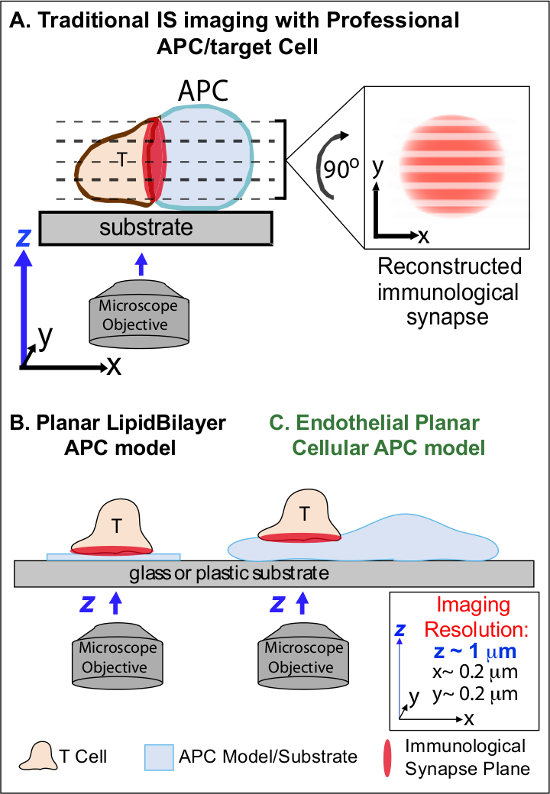
Abbildung 1. Ein Physiologische Planar Handy APC-Modell für Imaging immunologischen Synapse Dynamics. Die Abbildung zeigt, traditionellen Bildgebung von immunologischen Synapse zwischen einer T-Zelle und einer professio nal APC (A) und T-Zell-und ein traditionelles planaren Lipid-Doppelschicht APC-Modell (B) im Vergleich zu diesem Roman Endothelzellen planar APC-Modell (C). Professionelle APCs bereitzustellen physiologischen immunologischen Synapsen bieten aber schlecht orientierte Zell-Zell-Schnittstelle (dh in Bezug auf die optimale xy Abbildungsebene; Auflösung ~ 0,2 & mgr; m), die dramatisch beeinträchtigt räumliche (z Abbildungsebene Auflösung ~ 1 & mgr; m) und zeitliche (dh aufgrund der Notwendigkeit, immer wieder zu scannen durch alle z Abbildungsebenen) Auflösung der Bildgebung. Doppelschicht-Modelle haben eine planare Topologie, die eine optimale Raumzeit-Bildauflösung bietet, werden aber auch in stark vereinfachter, nicht-physiologischen und starr. Diese Endothelzellen-Modell vereint die planare Topologie der Lipid-Doppelschichten mit dem physiologischen Substrat eines klassischen APC, um eine optimale räumliche und zeitliche Bildauflösung in einer physiologischen Umgebung zu liefern.m / files / ftp_upload / 53288 / 53288fig1large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Frühere Arbeiten haben zum Teil diese Hindernisse durch Entwicklung planaren Substrat Modellen (dh Lipiddoppelschichten und Antikörper-beschichteten Oberflächen), welche optimale Raum-Zeit-Auflösung (dh bereitzustellen umgangen über Fixierung des T-Zell-Aktivierungsfläche in einem einzigen Plan, die parallel zu der optimalen xy Bildgebung Ebene) 11-15 (1B). Diese Modelle haben wichtige Einblicke in die subzelluläre / Molekulardynamik, die Antigen-Signalisierung in T-Zellen, einschließlich der Entdeckung der dynamischen Aktin / TCR Signalisierung Mikro-Clustern 7,11-14 Kontrolle erleichtert. Allerdings sind solche Modelle von Natur aus stark vereinfacht, sowie starre (Ausschluss der Entwicklung / Untersuchung der 3-dimensionale topologische Merkmale) (1B). Daher bleibt es unsicher, wie man solche Feststellungen phy beziehensiologic Zell-Zell-Immunüberwachung.
Obwohl noch under werden vaskulären und lymphatischen Endothelzellen als großen Schwellen (dh mehr in den Zahlen als alle professionellen APCs, die von ~ 1.000-fach) Peripheriefach 'semi-professionellen "APCs 16-18. Diese Zellen exprimieren MHC-I- MHC-II- und einer Vielzahl von Co-Stimulator Moleküle (zB CD40, LFA3, ICOSL, 4-1BB, OX40L, TL1A, PD-L1, nicht aber CD80 und CD86) und sind strategisch an der Blut-Gewebe-Grenzfläche, wo sie dienen spezialisierte Sentinel-Funktionen 16-18 positioniert. Frühere Studien zeigten, dass Endothelzellen wirksam neu zu stimulieren Effektor / Memory, aber nicht naiv, T-Zellen 19-25. Somit sind Endothelzellen wahrscheinlich einzigartig APC Rollen in Effektorphase adaptive Immunantworten in den peripheren Geweben, wie etwa lokale Einfluss auf T-Zellaktivierung, Differenzierung, Speicher und Toleranz 16,17,26 spielen. Crimatisch, wenn sie in vitro gezüchtet, Endothelzellen bilden praktisch planaren Zelloberflächen und leicht transfektierbare (beispielsweise mit fluoreszierenden Reporterproteine). Diese Eigenschaften sind ideal für hohe Raum-Zeit-auflösende Bildgebung der topologischen Dynamik während der Zell-Zell-Wechselwirkungen 19,27. So Endothelzellen als physiologische 'planaren Zell APC-Modell ausgesprochen geeignet für die Untersuchung der subzellulären / molekulare Umbaumechanismen, die Antigen-Erkennung zu fahren und zu regulieren Antworten (1C) 19,20 dienen könnte.
Vorher festgelegten komplementären Bildgebungstechniken (einschließlich Transfektion der Endothelzellen mit fluoreszierenden Protein Trägern der Plasmamembran und Cytosol) zur Untersuchung der Details der Leukozyten-Endothel-Interaktion während der Adhäsion und transendotheliale Migration 27, zeigte, daß Leukozyten die Oberfläche des Endothels Sonde aktiv durch dynamische Insertion eind Einfahren der Submikron-Maßstab, Actin-reiche zylindrischen Vorsprünge (~ 200-1000 nm Durchmesser und Tiefe) bezeichnet invadosome artigen Vorsprüngen (dh "ILPs ') 27,28. Diese bildgebenden Ansätze wurden weitere mit der Erstellung von Protokollen erweitert, um die Vorteile der endothelialen APC-Funktion, um die ersten Methoden zur hohen Raum-Zeit-auflösende Bildgebung des T-Zell-endothelialen immunologischen Synapse wie berichtet 19,20 entwickeln und weiter zu beschreiben hier. Eine zentrale Erkenntnis aus diesem neuartigen planaren Zell APC-Modell abgeleitet ist, dass T-Zell-ILPs funktionieren sowohl bei der Förderung der anfänglichen Ag Nachweis und bei der Aufrechterhaltung nachfolgende Signalisierung. Tatsächlich Arrays von mehreren ILPs (die stabilisiert und als Reaktion auf aufgelaufene Calciumfluss initial wurden) zeigen die Anreicherung in TCR und Molekülen andeutend aktives Melde wie PKC-Q, ZAP-70, Phosphotyrosin und HS1. Daher ILPs scheinen eine dreidimensionale physiologischen äquivalent der TCR-Signalgebung Mikro darstellenCluster in planare Doppelschicht-Modellen gesehen. Dieser Ansatz, so zeigt sensibel / Berichte molekularen und architektonischen (und stillschweigende biomechanischen) Dynamik sonst nicht nachweisbar.
Das hier beschriebene Verfahren ist nützlich, um die Lücke zwischen professionellen APC und künstliche APC-Substrat-Modelle, um unsere Fähigkeit, grundlegende Mechanismen der adaptiven Immunantwort zu verhören zu verbessern. Während hier der Schwerpunkt auf der Aktivierung von CD4 + Th1-Typ-Effektor / Speicherzelle kann dieser Ansatz leicht modifiziert werden, um eine breite Palette von T-Zell-Typen und Ags zu studieren, wie unten diskutiert.
Protocol
Representative Results
Discussion
Insgesamt ist dieses Protokoll beschreibt Methoden zur Untersuchung Endothelzellen als i) under physiologischen APCs und ii) als eine neue Art von "planare Zell APC-Modell". In Bezug auf die frühere, wurde es zunehmend klar, daß nicht-hämatopoetischen peripheren (oder "Stromazellen") APCs spielen kritische, nicht redundanten Rollen (dh gegenüber hämatopoetischen APCs) bei der Gestaltung der adaptiven Immunantwort 16-18. Unter solchen 'semi-professionellen "APCs, vask…
Declarações
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
Referências
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell – dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by ‘invadosome-like protrusions’. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).

