인간 Subcortex의 고해상도 구조 자기 공명 영상<I> 생체</I> 및 사후
Summary
Here we present a protocol to determine the minimum number images that needed to be registered and averaged to resolve subcortical structures and test whether the individual layers of the LGN could be resolved in the absence of physiological noise.
Abstract
본 연구의 초점은 인간의 두뇌 생활에 비해 사후 뇌의 구조적 자기 공명 영상의 해상도 한계를 테스트하는 것이 었습니다. 생체 내에서 구조적 자기 공명 영상의 해상도는 궁극적으로 맥박, 호흡과 머리의 움직임을 포함하여 생리적 잡음에 의해 제한된다. 이미징 하드웨어가 계속 향상 있지만 밀리미터 스케일 구조를 해결하는 것은 여전히 어렵다. 예를 들어, 측면 geniculate 핵의 일차 시각 감각 경로의 시냅스 (LGN), 일반적으로 여섯 인터리브 단안 층으로 구성되어 시상에서 시각적 릴레이 및 제어 핵. 뇌 영상 연구를 확실하게 1 mm 미만의 두께이다 작은 크기로 인해 이들 층을 구별 할 수 없었다.
사후 뇌의 구조적 자기 공명 영상의 해결 제한, 사용하여 여러 이미지가 오랜 기간 (~ 24 시간)에 걸쳐 평균을 시험 하였다. 목적은 각각의 L를 해결하는 것이 가능 여부를 테스트하는 것이었다생리 잡음의 부재의 LGN 즈. 프로톤 밀도 (PD) (1) 가중 된 펄스 시퀀스를 등록 할 필요가 이미지의 최소 수를 결정하는 해상도 및 다른 파라미터를 변경하여 사용하고 확실 LGN 다른 피질 영역을 구별하기 위해 평균화 하였다. 결과는 인간 뇌 생활에서 획득 된 영상을 비교 하였다. 생체 피험자는 임상 적용에 유용한 피질 하 구조 등을 구별 할 필요 PD 스캔의 최소 개수에 생리 잡음의 추가 효과를 결정하기 위하여 검사 하였다.
Introduction
이 연구의 목적은 생리적 잡음의 부재하에 구조적 MRI의 해상도 한계를 테스트하는 것이었다. 프로톤 밀도 (PD) 가중 된 이미지를 등록 할 필요가 이미지의 최소 수를 결정하는 데 긴 시간 (24 시간 ~ 두 세션)을 통해 사후 뇌에서 획득 및 피질 하 구조를 해결하기 위해 평균화 하였다. 비교를 위해, PD 가중 이미지는 또한 세션에 걸쳐 인간 생활에 인수했다. 특히, 대물 렌즈는 약 1mm의 두께 (도 1)에있는 인간 LGN의 여섯 개별 층을 해결하기 위해 최상의 시나리오에서 가능한 것 여부를 확인하는 것이었다.
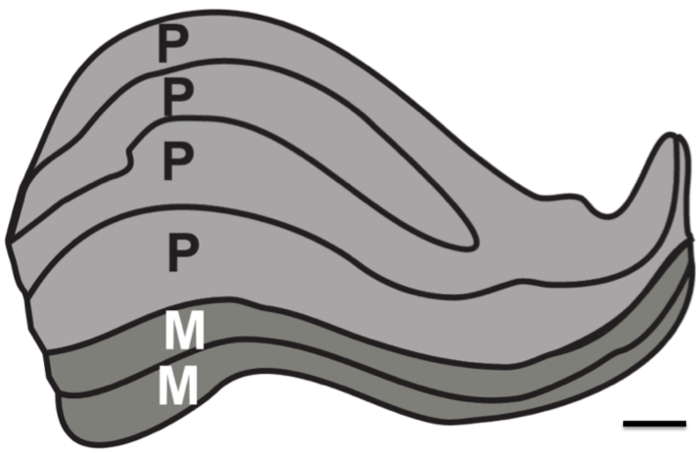
그림 1. 인간의 측면 Geniculate 핵 층. LGN의 판상 구조의 개략도. Magnocellular (M) 층은 큰 신경 세포로 구성되어있다(어두운 회색을 묘사 층 1-2) 모션 물론 윤곽을 해결하기위한 책임이 있습니다 셀 크기와 작은 세포 밀도. Parvocellular 층 (P)는 (밝은 회색으로 묘사 층 4-6) 미세 형태와 색상을 해결하기위한 책임이 있습니다 작은 신경 세포의 크기와 큰 세포 밀도로 구성된다. 스케일 바 1mm. 스테인드 인간 LGN (12)을 기준으로 그림.
행렬의 크기가 증가 될 때 MRI에서 공간 해상도는 향상되고, 시야 – (FOV) 및 슬라이스 두께가 감소되는 경우. 그러나, 증가 된 해상도는 복셀 체적에 비례 잡음비 (SNR)에 대한 신호를 감소시킨다. SNR은 또한 측정 횟수의 제곱근에 비례한다. 여러 이미지 별도 촬상 세션에 걸쳐 획득 할 수 있지만, 살아있는 사람에서, 궁극적 인 분해능은 그러한 호흡 순환기 맥동과 머리의 움직임으로, 생리 잡음에 의해 제한된다.
높은-resolution (0.35 mm 평면 복셀)는 가중 스캔 취득한 PD. PD 스캔은 시상 1 회색과 흰색 대비를 강화하고, T 1과 T 2 영향을 최소화 이미지를 얻을 수. 그 화상은 촬상 공간의 단백질 및 지방과 같은 물과 고분자 형태의 양성자 농도에 의존한다. 인해 자화 (2)의 길이 방향 성분에 더 밝은 이미지 신호 티슈 결과 양자의 수가 증가.
그들이 주변 조직과 피질 하 구조의 높은 콘트라스트를 제공하기 때문에 PD 가중 스캔을 수집 하였다. 이러한 T2 및 T1- 강조 영상 다른 대조 1,3- ƒ 결정된 인해 작은 콘트라스트 잡음비에 LGN 피질 하 구조 등을 서술하는데 어려움을 초래할.
마찬가지로, 이전의 연구는 포르말린의 PD 강조 영상이 사후 뇌가 resulte 고정 발견회색과 흰색 물질 사이에 높은 콘트라스트의 차이에서 D T1-과 비슷한 회색과 흰색 물질 이미지 강도 3,4 있었다 T2 강조 영상 비교. 기본 생물 물리학 결정은 이러한 차이를 설명 할 수 있습니다. 수소 양성자 (세로) T1 및 T2 (가로) 휴식 시간은 조직 내에서 어떻게 물 이동에 따라 달라집니다. 이러한 가교 단백질에 의한 포르말린 작품으로 고정 제. 고정 제를 사용하는 경우 물 이동성 사이의 차이는 서로 다른 조직 유형 사이에서 감소된다. 감소 T1 조직 대비, 정착 후에 관찰 된 반면 더 분화 3,4- 제공 정착 증가 뇌 조직 내의 프로톤의 상대 밀도의 차이, 반면.
이전의 연구는 1.5 T 5,6,7를 사용하여 PD 가중 검사에서 LGN을 식별하고 3 T 스캐너 8,9에있다. 그것은 정확하게의 범위를 개설 할 수 있도록 이러한 검사를 구하는 것이 중요LGN. 피질 핵의 전체 범위를 유지하기 위해, (18) PD-가중 조각은 시상에서 얻었다. 각 볼륨은, 배 해상도 1,024 행렬로 재 샘플링 (0.15 mm 면내 복셀 사이즈), 연접, 모션 보정 및 피질 하 구조 고해상도 3D 이미지를 생성하기 위해 평균화 하였다. 다음 슬라이스 처방 PD에 필요한 이미지의 최적의 수는 살아있는 인간에서 15 분 미만으로 스캔 시간을 감소, 5였다. 만 1 PD의 이미지는보다 3 분에 스캔 시간을 단축, 명확하게 사후 뇌의 피질 영역을 구별하는 데 필요한되었다 (그림 2, 3).
전체 포르말린 고정 사후 뇌 표본 82 세에서 심폐 정지로 사망 한 여성에서 스캔했다. 의료 기록의 검토 밝혀 그녀는 것으로 만성 폐쇄성 폐 질환, 협심증, 트리플 우회 수술 팔년 전에 죽음에, 자궁암은 자궁 절제술로 치료칠년 죽음, 고지혈증, 녹내장, 백내장 수술 전에. 사후 뇌 시료는 동일한 촬상 프로토콜뿐만 아니라 화질 비교를위한 많은 시간에 걸쳐 다른 파라미터들에서 스캔 된 4 ° C.The의 사후 뇌에서 최소 3 주 동안 10 % 중성 완충 포르말린에 침지 고정시켰다 . 단지 최적화 파라미터는 프로토콜에 대해 기술한다.
Protocol
Representative Results
Discussion
본 연구는 피질 영역 고해상도 PD 강조 영상을 얻기 위해 수집 및 분석 기술에 최적화 된 프로토콜을 설명한다. 스캐닝 파라미터의 개수는 테스트 SNR을 증가 인수의 수, 고해상도 피질 하 구조를 결정할 수있는에서 중요한 단계를 감소 매트릭스 크기, 복셀 사이즈 및 대역폭에 관한 가장 중요한 것들로 수정 하였다. 살아있는 인간 내에서 최적의 매개 변수를 찾는와 함께,이 연구는 사후 뇌를 스캔?…
Declarações
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge the following funding sources, the Natural Sciences and Engineering Research Council of Canada (NSERC), the Dorothy Pitts Research Fund (NG), and the Nicky and Thor Eaton Research Fund. The authors acknowledge Kevin DeSimone, and Aman Goyal and for their knowledge in MRI acquisition and analysis expertise.
Materials
| Magnetom Trio 3T MRI | Siemens (Erlangen, Germany). | ||
| Vacuum cushion hand | Siemens | Mat No: 4765454 | Manufactured by: Johannes-Stark-Stk. 8 D-92224 Amberg |
Referências
- Devlin, J. T., et al. Reliable identification of the auditory thalamus using multi-modal structural analyses. NeuroImage. 30 (4), 1112-1120 (2006).
- Fellner, F., et al. True proton density and T2-weighted turbo spin-echo sequences for routine MRI of the brain. Neuroradiology. 36 (8), 591-597 (1994).
- Schumann, C. M., Buonocore, M. H., Amaral, D. G. Magnetic resonance imaging of the post-mortem autistic brain. J Autism Dev Disord. 31 (6), 561-568 (2001).
- Tovi, M., Ericsson, A. Measurements of T1 and T2 over time in formalin-fixed human whole-brain specimens. Acta Radiol. 33 (5), 400-404 (1992).
- Fujita, N., et al. Lateral geniculate nucleus: anatomic and functional identification by use of MR imaging. Am J Neuroradiol. 22 (9), 1719-1726 (2001).
- Bridge, H., Thomas, O., Jbabdi, S., Cowey, A. Changes in connectivity after visual cortical brain damage underlie altered visual function. Brain. 131 (6), 1433-1444 (2008).
- Gupta, N., et al. Atrophy of the lateral geniculate nucleus in human glaucoma detected by magnetic resonance imaging. Br J Opthalmol. 93 (1), 56-60 (2009).
- Dai, H., et al. Assessment of lateral geniculate nucleus atrophy with 3T MR imaging and correlation with clinical stage of glaucoma. Am J Neuroradiol. 32 (7), 1347-1353 (2011).
- McKetton, L., Kelly, K. R., Schneider, K. A. Abnormal lateral geniculate nucleus and optic chiasm in human albinism. J Comp Neurol. 522 (11), 2680-2687 (2014).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Dietrich, O., Raya, J. G., Reeder, S. B., Reiser, M. F., Schoenberg, S. O. Measurement of signal-to-noise ratios in MR images: influence of multichannel coils, parallel imaging, and reconstruction filters. J Magn Reson Imaging. 26 (2), 375-385 (2007).
- Andrews, T. J., Halpern, S. D., Purves, D. Correlated size variations in human visual cortex, lateral geniculate nucleus, and optic tract. J Neurosci. 17 (8), 2859-2868 (1997).
- Pfefferbaum, A., Sullivan, E. V., Adalsteinsson, E., Garrick, T., Harper, C. Postmortem MR imaging of formalin-fixed human brain. NeuroImage. 21 (4), 1585-1595 (2004).

