Визуализации мембранного потенциала с двумя типами генетически кодируемых флуоресцентных датчиков напряжения
Summary
A method for imaging changes in membrane potential using genetically encoded voltage indicators is described.
Abstract
Genetically encoded voltage indicators (GEVIs) have improved to the point where they are beginning to be useful for in vivo recordings. While the ultimate goal is to image neuronal activity in vivo, one must be able to image activity of a single cell to ensure successful in vivo preparations. This procedure will describe how to image membrane potential in a single cell to provide a foundation to eventually image in vivo. Here we describe methods for imaging GEVIs consisting of a voltage-sensing domain fused to either a single fluorescent protein (FP) or two fluorescent proteins capable of Förster resonance energy transfer (FRET) in vitro. Using an image splitter enables the projection of images created by two different wavelengths onto the same charge-coupled device (CCD) camera simultaneously. The image splitter positions a second filter cube in the light path. This second filter cube consists of a dichroic and two emission filters to separate the donor and acceptor fluorescent wavelengths depending on the FPs of the GEVI. This setup enables the simultaneous recording of both the acceptor and donor fluorescent partners while the membrane potential is manipulated via whole cell patch clamp configuration. When using a GEVI consisting of a single FP, the second filter cube can be removed allowing the mirrors in the image splitter to project a single image onto the CCD camera.
Introduction
Основное внимание в этой статье является демонстрация оптических изображений изменений в мембранных потенциалов в пробирке с использованием генетически закодированные флуоресцентные белки. Изменения визуализации мембранного потенциала предлагает захватывающие возможности изучения деятельности нейронов схем. При внесении изменений в мембранного потенциала приводит к изменению интенсивности флуоресценции, каждый пиксель камеры становится суррогатной электрод позволяет ненавязчивая измерения активности нейронов. На протяжении более сорока лет, органические красители напряжения чувствительных были полезны для наблюдения изменений мембранного потенциала 1-4. Тем не менее, эти красители не хватает клеточную специфичность. Кроме того, некоторые типы клеток трудно окрасить. Генетически кодируемые индикатор напряжения (GeViS) преодолеть эти ограничения, имея клетки должны быть изучены конкретно выразить флуоресцентный напряжения чувствительных зонд.
Есть три класса GeViS. Первый класс Gevi использует ВОltage зондирования домен из напряжения зондирования фосфатазы либо одной флуоресцентного белка (FP) 5-9 или передача энергия резонанса Ферстер (лад) пары 10-12. Второй класс датчиков использует микробного родопсина в качестве флуоресцентного индикатора непосредственно 13-15 или через электрохромное FRET 16,17. Третий класс использует два компонента, генетический компонент является мембрана закреплена ФП и второй компонент, будучи связанный с мембраной закалки краситель 18-20. В то время как второй и третий классы полезны для в пробирке и нарезать экспериментов 19,20, только первый класс датчиков в настоящее время полезно в естественных условиях анализов 6.
В этом докладе мы продемонстрируем визуализацию мембранного потенциала с использованием первого класса GeViS (рис 1) в пробирке. Это первый класс датчиков напряжения является самым простым для перехода в режим визуализации в естественных условиях. Так GeViS уtilizing домен напряжения зондирования, слитый с FP являются около 50 раз ярче, чем класс родопсина датчиков, они могут быть отображены с помощью дуговой лампы подсветки, не требуя чрезвычайно мощный лазер. Другим следствием неравенства в яркости, что первый класс GeViS может легко превысить автофлуоресценции мозга. Родопсина основе зонды не могут. Третий класс датчика так же ярко, как в первый класс, но требует добавления химических гасителем который трудно вводить в естественных условиях.
Мы, следовательно, демонстрируют приобретение зонда с одним FP (Bongwoori) 8 и зонда, состоящей из пары FRET (Nabi 2) 12. FRET строит в настоящем докладе, бабочки версии ВМРП-CR (напряжение чувствительных флуоресцентных белков – клевер-mRuby2) 11, состоящей из зеленого флуоресцентного донора, клевер, и красного флуоресцентного акцептора, mRuby2, названный Наби 2,242 и 2,244 Наби <sдо> 12. Введение этих типов записей следует дать исследователям лучшее понимание типа информационных GeViS может обеспечить.
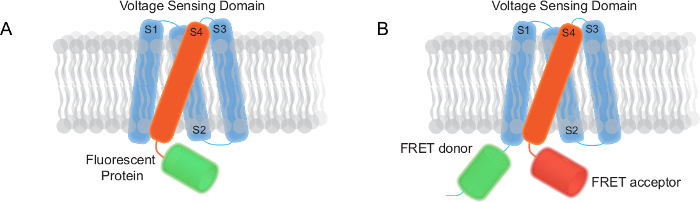
Рисунок 1. Два типа генетически кодируемых указателей напряжения (GeViS) отображается в этом отчете (а) моно FP основе Gevi имеющий трансмембранный напряжения зондирования домен и флуоресцентный белок. (B) на основе Gevi FRET состоит из транс-мембранного напряжения зондирования домена, донора и акцептора FRET. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
Protocol
Representative Results
Discussion
Нервная система использует напряжение несколькими различными способами, ингибирование вызывает небольшое гиперполяризации, синаптической вход вызывает небольшое деполяризацию и действие потенциальных результатов в относительно большом изменении напряжения. Возможность измерени…
Declarações
The authors have nothing to disclose.
Acknowledgements
This work was supported by the World Class Institute (WCI) program of the National Research Foundation of Korea funded by Ministry of Education, Science, and Technology of Korea Grant WCI 2009-003 and Korea Institute of Science and Technology Institutional Program Project 2E24210. Sungmoo Lee was supported by Global Ph.D. Fellowship program (NRF-2013H1A2A1033344) of the National Research Foundation (NRF) under the Ministry of Education (MOE, Korea).
Materials
| Inverted Microscope | Olympus | IX71 | |
| 60X objective lens (numerical aperture = 1.35) | Olympus | UPLSAPO 60XO | |
| Excitation filter | Semrock | FF02-472/30 | For voltage imaging of super ecliptic pHluorin in Bongwoori |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Semrock | FF01-497/LP | |
| 75W Xenon arc lamp | CAIRN | OptoSource Illuminator | LEDs and lasers are also effective light sources |
| Slow speed CCD camera | Hitachi | KP-D20BU | |
| Dual port camera adaptor | Olympus | U-DPCAD | |
| High speed CCD camera | RedShirtImaging, LLC | NeuroCCD-SM | |
| Image splitter | CAIRN | Optosplit 2 | |
| Excitation filter | Semrock | FF01-475/23-25 | For voltage imaging of FRET pair based GEVI consisting of Clover and mRuby2) |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Chroma | ET520/40 | |
| Dichroic mirror | Semrock | FF560-FDi01-25X36 | |
| Emission filter | Chroma | ET645/75 | |
| Vibration isolation system | Kinetic systems | 250BM-IC, 5702E-3036-31 | |
| Patching chamber | Warner instruments | RC-26G, 64-0235 | |
| #0 Micro Coverglass (22x40mm) | Electron Microscopy Sciences | 72198-20 | |
| Temperature controller | Warner instruments | TC-344B | |
| #0 (0.08~0.13mm) – 10mm diameter glass coverslip | Ted Pella | 260366 | |
| Lipofection agent | Life Technologies | 11668-027 | |
| Calcium phosphate reagent | Clontech – Takara | 631312 | |
| Patch clamp amplifier | HEKA | EPC 10 USB amplifier | |
| Multi-channel data acquisition software | HEKA | Patchmaster | |
| Image acquisition and analysis software | RedShirtImaging | Neuroplex | |
| Spreadsheet application software | Microsoft | Microsoft Excel 2010 | |
| Data analysis software | OriginLab | OriginPro 8.6.0 | |
| Demagnifier | Qioptiq LINOS | Optem standard camera coupler 0.38x SC38 J clamp | |
| Confocal microscope | Nikon | Nikon A1R confocal microscope | |
| Anti-fade reagent | Life Technologies | P36930 |
Referências
- Salzberg, B. M., Davila, H. V., Cohen, L. B. Optical recording of impulses in individual neurones of an invertebrate central nervous system. Nature. 246, 508-509 (1973).
- Cohen, L. B., et al. Changes in axon fluorescence during activity: molecular probes of membrane potential. J. Membrane Biol. 19, 1-36 (1974).
- Tasaki, I., Warashina, A. Dye-membrane interaction and its changes during nerve excitation. Photochem Photobiol. 24, 191-207 (1976).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5, 874-885 (2004).
- Jin, L., Han, Z., Platisa, J., Wooltorton, J. R., Cohen, L. B., Pieribone, V. A. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75, 779-785 (2012).
- Cao, G., Platisa, J., Pieribone, V. A., Raccuglia, D., Kunst, M., Nitabach, M. N. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154, 904-913 (2013).
- St-Pierre, F., Marshall, J. D., Yang, Y., Gong, Y., Schnitzer, M. J., Lin, M. Z. High-fidelity optical reporting of neuronal electrical activity with an ultrafast fluorescent voltage sensor. Nat Neurosci. 17, 884-889 (2014).
- Piao, H. H., Rajakumar, D., Kang, B. E., Kim, E. H., Baker, B. J. Combinatorial mutagenesis of the voltage-sensing domain enables the optical resolution of action potentials firing at 60 Hz by a genetically encoded fluorescent sensor of membrane potential. J Neurosci. 35, 372-385 (2015).
- Jung, A., Garcia, J. E., Kim, E., Yoon, B. J., Baker, B. J. Linker length and fusion site composition improve the optical signal of genetically encoded fluorescent voltage sensors. Neurophoton. 2, 021012 (2015).
- Dimitrov, D., et al. Engineering and characterization of an enhanced fluorescent protein voltage sensor. PLoS One. 2, e440 (2007).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9, 1005-1012 (2012).
- Sung, U., et al. Developing fast fluorescent protein voltage sensors by optimizing FRET interactions. PLoS One. 10, e0141585 (2015).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., Maclaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nat Methods. 9, 90-95 (2012).
- Flytzanis, N. C., et al. Archaerhodopsin variants with enhanced voltage-sensitive fluorescence in mammalian and Caenorhabditis elegans neurons. Nat Commun. 5, 4894 (2014).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nat Methods. 11, 825-833 (2014).
- Gong, Y., Wagner, M. J., Zhong Li, J., Schnitzer, M. J. Imaging neural spiking in brain tissue using FRET-opsin protein voltage sensors. Nat Commun. 5, 3674 (2014).
- Zou, P., et al. Bright and fast multicoloured voltage reporters via electrochromic FRET. Nat Commun. 5, 4625 (2014).
- Chanda, B., Blunck, R., Faria, L. C., Schweizer, F. E., Mody, I., Bezanilla, F. A hybrid approach to measuring electrical activity in genetically specified neurons. Nat Neurosci. 8, 1619-1626 (2005).
- Wang, D., McMahon, S., Zhang, Z., Jackson, M. B. Hybrid voltage sensor imaging of electrical activity from neurons in hippocampal slices from transgenic mice. J Neurophysiol. 108, 3147-3160 (2012).
- Weigel, S., Flisikowska, T., Schnieke, A., Luksch, H. Hybrid voltage sensor imaging of eGFP-F expressing neurons in chicken midbrain slices. J Neurosci Methods. 233, 28-33 (2014).
- Waters, J. C., Sluder, G., Wolf, D. E. Live-Cell Fluorescence Imaging. Methods in Cell Biology Volume 81. , 115-140 (2007).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nat Protoc. 7, 1741-1754 (2012).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nat Protoc. 1, 695-700 (2006).
- Molleman, A. . Patch clamping: an introductory guide to patch clamp electrophysiology. , 101-102 (2003).
- Osorio, N., Delmas, P. Patch clamp recording from enteric neurons in situ. Nat Protoc. 6, 15-27 (2010).
- Schroder, M., Kaufman, R. J. The mammalian unfolded protein response. Annu Rev Biochem. 74, 739-789 (2005).
- Wilt, B. A., Fitzgerald, J. E., Schnitzer, M. J. Photon shot noise limits on optical detection of neuronal spikes and estimation of spike timing. Biophys J. 104, 51-62 (2013).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knopfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3, e2514 (2008).
- Peterka, D. S., Takahashi, H., Yuste, R. Imaging voltage in neurons. Neuron. 69, 9-21 (2011).

