Desenvolvimento de um Backbone cíclica Biblioteca de Peptídeos como potencial antiparasitário Therapeutics Usando Microondas Irradiação
Summary
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
Abstract
Interacções proteína-proteína (IBPs) estão intimamente envolvidos em quase todos os processos biológicos e estão ligadas a muitas doenças humanas. Portanto, há um grande esforço para atingir os IPP em pesquisa básica e na indústria farmacêutica. As interfaces proteína-proteína são geralmente grande e plana, e muitas vezes não têm bolsos, o que complica a descoberta de pequenas moléculas que têm como alvo tais sites. Abordagens alternativas de segmentação utilizando anticorpos têm limitações devido à baixa biodisponibilidade oral, baixa de células-permeabilidade, e ineficiência de produção.
Usando péptidos alvo para interfaces de PPI tem várias vantagens. Os péptidos têm maior flexibilidade conformacional, o aumento da selectividade, e são geralmente baratos. No entanto, os péptidos têm suas próprias limitações incluindo a má estabilidade e ineficiência atravessar membranas celulares. Para superar estas limitações, o péptido de ciclização pode ser realizada. A ciclização foi demonstrado melhorar a selectividade peptídeo, A estabilidade metabólica e biodisponibilidade. No entanto, a previsão da conformação bioactiva de um péptido cíclico não é trivial. Para ultrapassar esta dificuldade, uma abordagem atractiva para o rastreio de uma biblioteca focada para a tela no qual todos os péptidos cíclicos da espinha dorsal tem a mesma sequência primária, mas diferem nos parâmetros que influenciam a sua conformação, como o tamanho do anel e posição.
Nós descrevemos um protocolo detalhado para a síntese de uma biblioteca de péptidos cíclicos de segmentação de estrutura de parasitas específicos de IPP. Utilizando uma abordagem de design racional, foi desenvolvido a partir de péptidos derivados do receptor de G eishmania proteína C activada para andaime-quinase (ausência). Colocámos a hipótese de sequências em FALTA que são conservadas em parasitas, mas não no homólogo de hospedeiro mamífero, podem representar sítios de interacção para proteínas que são críticas para a viabilidade dos parasitas. Os péptidos cíclicos foram sintetizados utilizando a irradiação de microondas para reduzir os tempos de reacção e aumentareficiência. O desenvolvimento de uma biblioteca de backbone peptídeos cíclicos com diferentes tamanhos de tela de toque facilita uma sistemática para a conformação activa mais biológica. Este método oferece uma maneira geral, rápido e fácil de sintetizar péptidos cíclicos.
Introduction
Interacções proteína-proteína (IBPs) desempenham um papel essencial na maioria dos processos biológicos, de transdução de sinal intracelular para a morte de células 1. Assim, visando IPP é de fundamental importância para a pesquisa básica e aplicações terapêuticas. IPP pode ser regulada por meio de anticorpos específicos e estáveis, mas os anticorpos são caros e difíceis de fabricar e têm uma fraca biodisponibilidade. Alternativamente, IPP pode ser alvo de moléculas pequenas. As moléculas pequenas são mais fáceis de sintetizar e barata em comparação com anticorpos; no entanto, eles são relativamente menos flexível e encaixar melhor do que para as pequenas cavidades grandes para as interfaces proteína-proteína 2,3. Diversos estudos demonstraram que os péptidos, que são mais simples e mais barata do que os anticorpos e mais flexível do que as moléculas pequenas, as interfaces de proteína pode ligar-se e regulam IPP 4,5. O mercado global de peptídeo terapêutico foi avaliada em torno de quinze bilhões de dólares em 2013 e está crescendo 10,5% annually 6. Além disso, existem mais do que 50 péptidos comercializados, cerca de 270 péptidos em diferentes fases de ensaios clínicos, e cerca de 400 péptidos em fases pré-clínicos avançados 7. Apesar de numerosos peptídeos estão sendo usados como drogas, peptídeos ainda representam vários desafios que limitam a sua aplicação generalizada, incluindo fraca biodisponibilidade e estabilidade, a ineficiência nas membranas celulares cruzamento, e flexibilidade conformacional 8,9. Uma alternativa para superar estes inconvenientes é a aplicação de diferentes modificações, tais como (D-amino ácido e N-alquilação) local e global (ciclização) constrangimentos 8,10-12. Estas alterações também ocorrem naturalmente. Por exemplo, a ciclosporina A, um péptido imunossupressor naturais cíclica, contém um único ácido aminado D e sofre modificações de N-alquilação 13,14.
Modificação de amino ácidos naturais para induzir constrangimentos locais, tais como D e N-alquilação, muitas vezes afecta o peptídeo9; s atividade biológica. No entanto, a ciclização, na qual a sequência de interesse pode permanecer a mesma, é mais provável para preservar a actividade biológica. A ciclização é uma forma altamente atraente para restringir o espaço conformacional péptido, reduzindo o equilíbrio entre diferentes conformações. Geralmente, aumenta a actividade biológica e selectividade ao restringir o péptido para a conformação activa que medeia apenas uma função. A ciclização também melhora a estabilidade do péptido, mantendo o peptídeo numa conformação que é reconhecida pelos menos as enzimas degradantes. Com efeito, os péptidos cíclicos foram mostrados como tendo uma melhor estabilidade metabólica, biodisponibilidade, e a selectividade em relação aos seus equivalentes lineares 15-17.
No entanto, a ciclização pode ser uma espada de dois gumes, uma vez que, em alguns casos, a restrição pode impedir que os péptidos de atingir uma conformação bioactiva. Para superar este obstáculo, uma biblioteca focada no qual todos os péptidos possuem o mesmo sequenc primárioE e consequentemente constante farmacóforos podem ser sintetizados. Os péptidos da biblioteca diferem em parâmetros que influenciam a sua estrutura, tais como o tamanho do anel e posição, a fim de rastrear, subsequentemente, para a conformação bioactiva mais 9,18.
Os péptidos podem ser sintetizados tanto em solução como por uma abordagem de síntese de péptidos em fase sólida (SPPS), que é agora a abordagem de síntese de péptidos mais prevalente e será discutido mais adiante. SPPS é um processo pelo qual as transformações químicas são realizadas sobre um suporte sólido através de um ligante para preparar uma vasta gama de compostos sintéticos 19. SPPS de montagem permite que os péptidos por acoplamento consecutivo de ácidos aminados de uma forma passo a passo a partir do terminal C, que está ligado a um suporte sólido, para a extremidade N-terminal. As cadeias laterais de ácido N-a-amino deve ser mascarados com grupos protectores que são estáveis nas condições de reacção utilizadas durante péptido alongamento para assegurar a adição de um aminoácido por rep. No passo final, o péptido é libertado a partir da resina e a cadeia lateral de grupos protectores são removidos simultaneamente. Enquanto o péptido está a ser sintetizado, todos os reagentes solúveis podem ser removidos a partir da matriz de suporte sólida de péptido-se por filtração e lavado no final de cada passo de acoplamento. Com um tal sistema, um grande excesso de reagentes a uma concentração elevada pode conduzir a reacções de acoplamento e a conclusão de todas as etapas de síntese pode ser realizada no mesmo recipiente, sem transferência de material 20.
Embora SPPS apresenta algumas limitações, tais como a produção de reacções incompletas, reacções secundárias, reagentes impuros, bem como dificuldades de controlo da reacção 21, as vantagens de SPPS fez-se o "padrão de ouro" para a síntese de péptidos. Estas vantagens incluem a opção de incorporar ácidos aminados não naturais, automação, fácil purificação, perdas físicas minimizadas, e a utilização de reagentes em excesso, resultando emrendimentos elevados. SPPS demonstrou ser extremamente útil na síntese de sequências difíceis, 21,22 modificações fluorescentes 23, e bibliotecas de péptidos 24,25. SPPS também é muito útil para outras montagens de cadeia poli, tais como os oligonucleótidos, oligossacáridos 28,29 26,27, e ácidos nucleicos peptídicos 30,31. Curiosamente, em alguns casos, a SPPS foi demonstrado ser vantajoso para a síntese de moléculas pequenas que são tradicionalmente feitas em solução de 32,33. SPPS é usado tanto em pequena escala para pesquisa e ensino, bem como 34,35 larga escala na indústria 36-38.
Duas estratégias de síntese que são usados principalmente em SPPS metodologia para a síntese de péptidos são butiloxicarbonilo (Boc) e 9-fluorenilmetoxicarbonilo (Fmoc). A estratégia original introduzido para a SPPS Boc foi, o que requer condições fortemente ácidas para remover os grupos protectores da cadeia lateral e clivagem do péptido da resin. A síntese de péptidos de Fmoc-baseado, no entanto, utiliza condições base moderada e é uma alternativa mais leve ao protocolo Boc ácido-lábil 39. A estratégia de Fmoc utiliza ortogonal de t-butilo (tBu) protecção da cadeia lateral que é removido no último passo da síntese, enquanto a clivagem do péptido a partir da resina sob condições ácidas.
O princípio geral para a síntese de péptidos sobre suporte sólido é apresentado na Figura 1. O aminoácido inicial, mascarada por um grupo protector temporário na N-α-terminal, é carregada sobre a resina a partir da extremidade C-terminal. Um grupo de protecção semi-permanente para mascarar a cadeia lateral é também utilizado, se necessário (Figura 1, Passo 1). A síntese do péptido alvo é montado a partir do terminal C para o terminal N de ciclos repetitivos de desprotecção do grupo de protecção N-α-temporária (Figura 1, Passo 2) e o acoplamento do aminoácido seguinte protegido (Figura 1 </str ong>, Passo 3). Após o último aminoácido está carregado (Figura 1, Passo 4), o péptido é clivado do suporte de resina e os grupos de protecção semi-permanentes são removido (Figura 1, Passo 5).
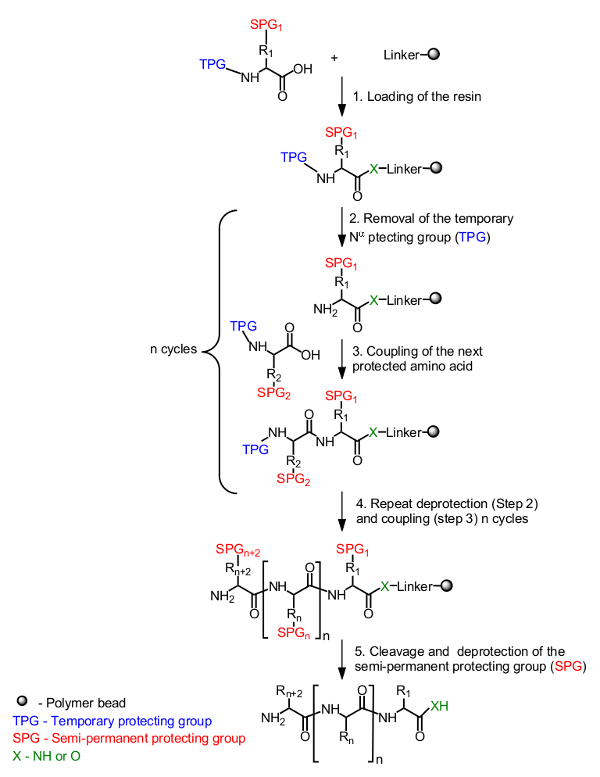
Figura 1. Esquema geral de síntese de péptidos em fase sólida. O aminoácido protegido por N-α está ancorada usando o grupo carboxilo através de um ligante à resina (Passo 1). O péptido desejado é montado de um modo linear a partir do terminal C para o terminal N de ciclos repetitivos de desprotecção do grupo de protecção temporária (TPG) a partir do N-α (Passo 2) e o acoplamento de aminoácidos (Passo 3). Após realização da síntese (Passo 4), os grupos de protecção semi-permanentes (SPG) são desprotegidos durante a clivagem do péptido (Passo 5).obter = "_ blank"> Clique aqui para ver uma versão maior desta figura.
Após a montagem da cadeia peptídica completa, ciclização pode ser conseguido por várias alternativas: (A) head-to-tail ciclização – Esta é uma maneira conveniente, mas limitado, uma vez que fornece apenas uma opção para ciclização (Figura 2A), (B) ciclização utilizando os aminoácidos da sequência de interesse que contêm grupos funcionais bioactivos – no entanto, a utilização destes aminoácidos pode influenciar a actividade biológica (Figura 2B), e (C) a ciclização através da adição de aminoácidos (ou de outros blocos de construção), sem perturbar a sequência bioactivo. A introdução destas moléculas é generalizado, uma vez que permite a produção de bibliotecas focadas, sem modificar a sequência de interesse (Figura 2C).
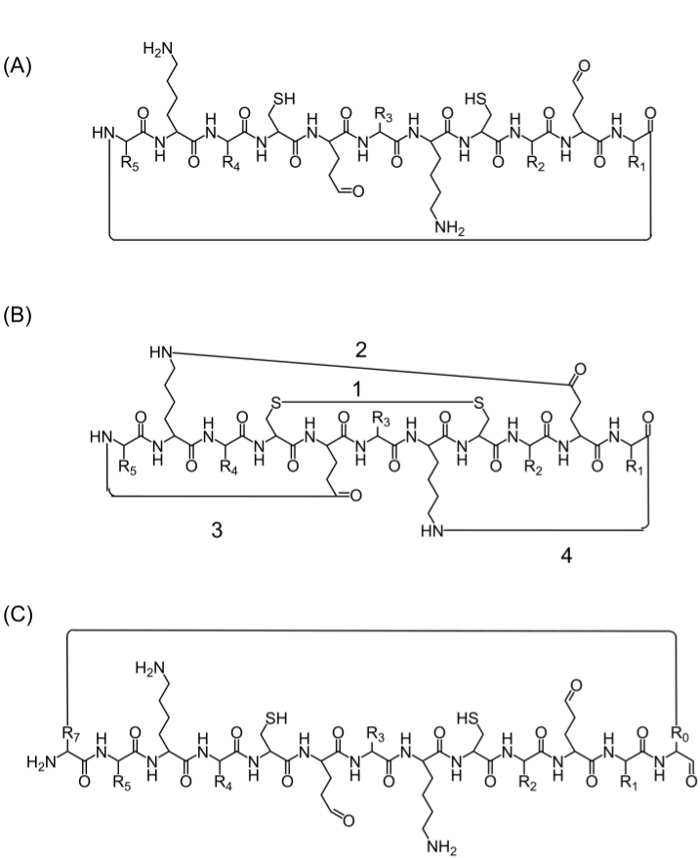
Figura 2. estratégias de ciclização de péptido A alternativa (a) ciclização cabeça à cauda através de uma ligação peptídica entre o C-terminal e N-terminal.; (B) a ciclização entre os grupos funcionais, tais como uma ponte de dissulfureto entre resíduos de cisteína (1), ou uma ligação amida entre as cadeias laterais de lisina para aspártico / ácido glutâmico (2), ou a cadeia lateral de N ou C-terminal (3 -4); (C) ciclização adicionando aminoácidos extras ou derivados de aminoácidos ou moléculas pequenas, por exemplo, antes (R0) e depois (R7) a seqüência bioativa. Por favor clique aqui para ver uma versão maior desta figura.
Síntese utiliza irradiação de microondas para aquecer reações, acelerando assim a química orgânica assistida por microondas transformações 40,41. Microondas química baseia-se na capacidade de o reagente / solvente para absorver omicroondas energia e convertê-lo para aquecer 42. Antes de a tecnologia se tornou generalizada, grandes inconvenientes tiveram que ser superados, incluindo a controlabilidade e reprodutibilidade dos protocolos de síntese e falta de sistemas disponíveis para temperatura e pressão controles adequados 43,44. O primeiro relatório de síntese de peptídeos assistida por microondas foi feito usando um microondas cozinha para sintetizar vários péptidos curtos (7-10 aminoácidos) com melhoria significativa da eficiência de acoplamento e pureza 45. Além disso, a energia de microondas foi demonstrado para diminuir a agregação de cadeia, reduzir as reacções secundárias, limitar a racemização, e melhorar as taxas de acoplamento, que são todos críticos para sequências longas e difíceis 46-53.
Actualmente a utilização de irradiação de microondas para a síntese de péptidos ou compostos relacionados, um suporte sólido é extensiva, incluindo (a) síntese em água em vez de solvente orgânico 54; (B) a síntese de peptídeos commodificações pós-traducionais comuns, tais como os glicopéptidos 55-58 ou 59-61 fosfopéptidos, cuja síntese é tipicamente difícil, devido à baixa eficiência de acoplamento dos derivados de aminoácidos estereoquimicamente impedidas; (C) a síntese de péptidos com modificação no esqueleto, tal como azapeptides, que pode ser formado pela substituição do C (α) de um resíduo de aminoácido com um átomo de azoto 62, ou peptóides, cuja cadeia lateral está ligada ao azoto da amida em vez do átomo de Ca 63,64; (D) a síntese de péptidos cíclicos 65-71; e (E) a síntese de bibliotecas combinatórias 51,72. Em numerosos casos, os autores relataram uma maior eficiência e reduziu o tempo de síntese que utilizam a irradiação de microondas, em comparação com o protocolo convencional.
Usando um desenho racional 73-75, desenvolvemos peptídeos anti-parasitários que foram derivadas do receptor do andaime L de eishmania foR-quinase C activada (ausência). FALTA desempenha um papel importante na fase inicial de infecção por Leishmania 76. Parasitas que expressam níveis mais baixos de FALTA deixar de parasitar mesmo ratos imunocomprometidos 77 como FALTA está envolvida em processos de parasitas sinalização essenciais e síntese de proteínas 78. Portanto, FALTA é uma chave de proteínas scaffold 79 e um alvo de drogas valiosas. Focando em FALTA sequências que são conservadas em os parasitas, mas não no hospedeiro mamífero CREMALHEIRA homólogo, identificou-se um péptido de 8 amino ácidos (RNGQCQRK) que diminuiu Leishmania sp. Viabilidade em cultura.
Aqui, nós descrevemos um protocolo para a síntese de esqueleto cíclico péptidos derivados da sequência da proteína FALTA descrito acima. Os péptidos foram sintetizados num suporte sólido utilizando o aquecimento por microondas através da metodologia de SPPS com o protocolo Fmoc / tBu. Os péptidos foram conjugados com um péptido 47-57 (YGRKKRRQRRR) transportadora TAT através de uma ligação amida comoparte da SPPS. Transporte baseado no TAT de uma variedade de cargas em células tem sido usado por mais de 15 anos e entrega da carga em organelas subcelulares foi confirmada 80. Quatro ligantes diferentes, succínico e anidrido glutárico, bem como adípico e ácido pimélico, foram usadas para efectuar a ciclização para gerar ligantes de ácidos carboxílicos de dois a cinco carbonos. A ciclização foi realizada por meio de energia de microondas, e a clivagem de cadeia lateral e passos de desprotecção final foi feita manualmente, sem energia de microondas. A utilização de um sintetizador de microondas automatizada melhora a pureza do produto, aumentou o rendimento do produto, e reduziu a duração da síntese. Este protocolo geral pode ser aplicada a outros estudos que utilizam péptidos compreender importante mecanismo molecular in vitro e in vivo e ainda desenvolver drogas potenciais para as doenças humanas.
Protocol
Representative Results
Discussion
A síntese de uma biblioteca focada backbone de péptidos cíclicos derivados da proteína falta de parasita Leishmania usando a um sintetizador de microondas é descrita completamente automatizado. Uma biblioteca orientada de péptidos cíclicos foi desenvolvido com farmacóforos conservada e vários ligantes. A adição de vários ligantes, tais como o anidrido glutárico, anidrido succínico, ácido adípico, ácido pimélico, lisina, ornitina, e outros blocos de construção podem ser utilizados para aument…
Declarações
The authors have nothing to disclose.
Acknowledgements
Agradecemos Lauren Van Wassenhove, Sunhee Hwang, e Daria Mochly-Rosen para discussões úteis. O trabalho foi financiado pelos Institutos Nacionais de Saúde Grant NIH RC4 TW008781-01 C-IDEA (SPARK) para nq Os financiadores não tiveram nenhum papel no desenho do estudo, coleta de dados e análise, decisão de publicar ou preparação do manuscrito.
Materials
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic |
| Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. | |||
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′-tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’- | Sigma | 38370 | Caution Flammable/ Toxic |
| Diisopropylcarbodiimide (DIC) | |||
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Name | Company | Catalog Number | Comments |
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams™ nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials – micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP |
Referências
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Bioquímica. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Bioquímica. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O’Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using ‘safety catch’ methodology. J Vis Exp. (63), e4112 (2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based ‘building block’ approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O’Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis – A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710 (2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373 (2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).

