Быстрый метод обработки крови для увеличения выхода плазмы пептидных уровней в крови человека
Summary
Способ обработки крови БЫСТРОГО может быть использован в организме человека и дает более высокие уровни пептидов, а также позволяет для оценки правильной молекулярной форме. Таким образом, этот метод будет ценным инструментом в пептидной исследования.
Abstract
Исследования в области регулирования потребления пищи приобретает все большее значение. Это часто включает в себя измерение пептидов, регулирующих потребление пищи. Для правильного определения концентрации с пептидом, то он должен быть стабильным во время обработки крови. Тем не менее, это не так для нескольких пептидов, которые быстро разлагаются эндогенными пептидаз. В последнее время мы разработали метод обработки крови с использованием R температуры, развита cidification, P rotease торможение, я sotopic экзогенные управления и D ilution (Рапид) для использования у крыс. Здесь мы установили эту технику для использования в организме человека и исследовали восстановление, молекулярную форму и циркулирующую концентрацию приема пищи регуляторных гормонов. Экспресс метод значительно улучшает восстановление для 125 I-меченый соматостатин-28 (+ 39%), глюкагон-подобный пептид-1 (+ 35%), ацил грелин и глюкагон (+ 32%), инсулин и kisspeptin (+ 29% ), nesfatin-1 (+ 28%), лептин(+ 21%) и пептид YY 3-36 (+ 19%) по сравнению со стандартной обработкой (ЭДТА крови на льду, р <0,001). Высокоэффективная жидкостная хроматография показала элюирование эндогенного ацил грелина в ожидаемом положении после быстрой обработки, в то время как после стандартной обработки 62% ацильных грелина деградировали в результате более раннего пика, вероятно, что составляет desacyl грелина. После быстрой обработки отношение грелин ацил / desacyl в крови с нормальной массой тела составляло 1: 3 по сравнению с 1:23 следуя стандартной обработке (р = 0,03). Также эндогенные kisspeptin уровни были выше , после того, как быстро по сравнению со стандартной обработкой (+ 99%, р = 0,02). Способ обработки крови БЫСТРОГО может быть использован в организме человека, дает более высокие уровни пептида и позволяет для оценки правильной молекулярной форме.
Introduction
В свете растущей во всем мире распространенность ожирения 1,2, исследования в области регулирования потребления пищи приобретает все большее значение. Хотя до сих пор только один пептид известно , что периферически производится и централизованно действуя , чтобы стимулировать потребление пищи, а именно грелин 3, в течение последних десятилетий, широкий спектр пептидов было установлено , что уменьшить потребление пищи, например. лептин, пептид YY (PYY) , а также глюкагон-подобный пептид-1 (GLP-1) и инсулина 4. Таким образом, в исследованиях , посвященных регуляторные механизмы голода и сытости пептидных уровней часто оцениваются и в то же время предполагается, что пептид изученным является стабильным и восстанавливается при высоких урожаев в процессе образования плазмы. Тем не менее, очень часто это не так из – за быстрого эндогенного пробоя , как показано выше для например. грелин , который деградирует из ацила до desacyl грелин 5. Таким образом, мы недавно описал быстрый метод предпосе кровипоют у крыс , использующих R температуры, развита cidification, P rotease торможение, я sotopic экзогенные управления и D ilution 6. Этот метод улучшил восстановление для 11 из 12 6 пептидов испытанных и разрешенных для определения правильной циркулирующей молекулярной форме по сравнению со стандартной обработкой крови (ЭДТА крови на льду). Этот метод был использован в нескольких последующих работах 7-12 для выявления циркулирующих грелин, а также кортикотропин-рилизинг-фактора 13. Таким образом, метод оказался полезным для пептидного исследований у грызунов. Однако, поскольку исследования на грызунах не всегда переводимых к другому виду, этот метод должен быть создан для использования в человеческой крови, а также.
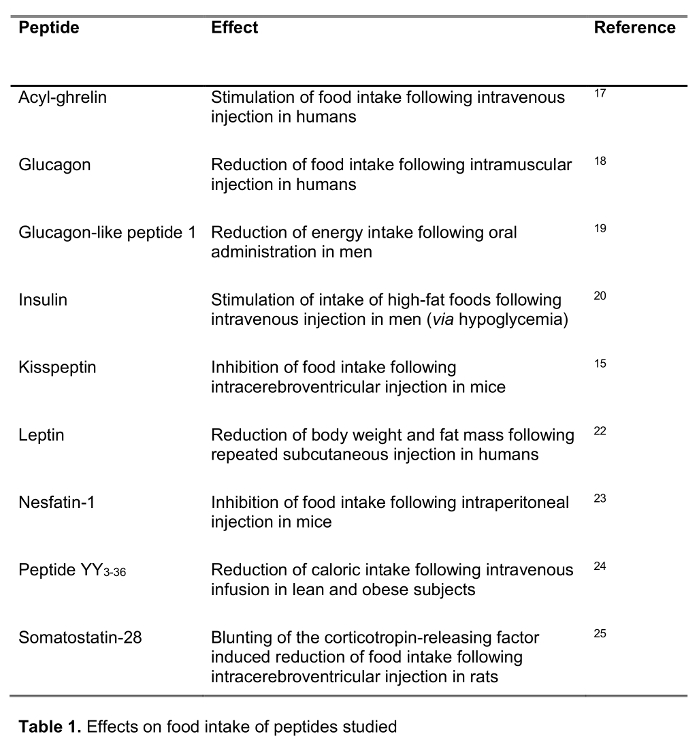
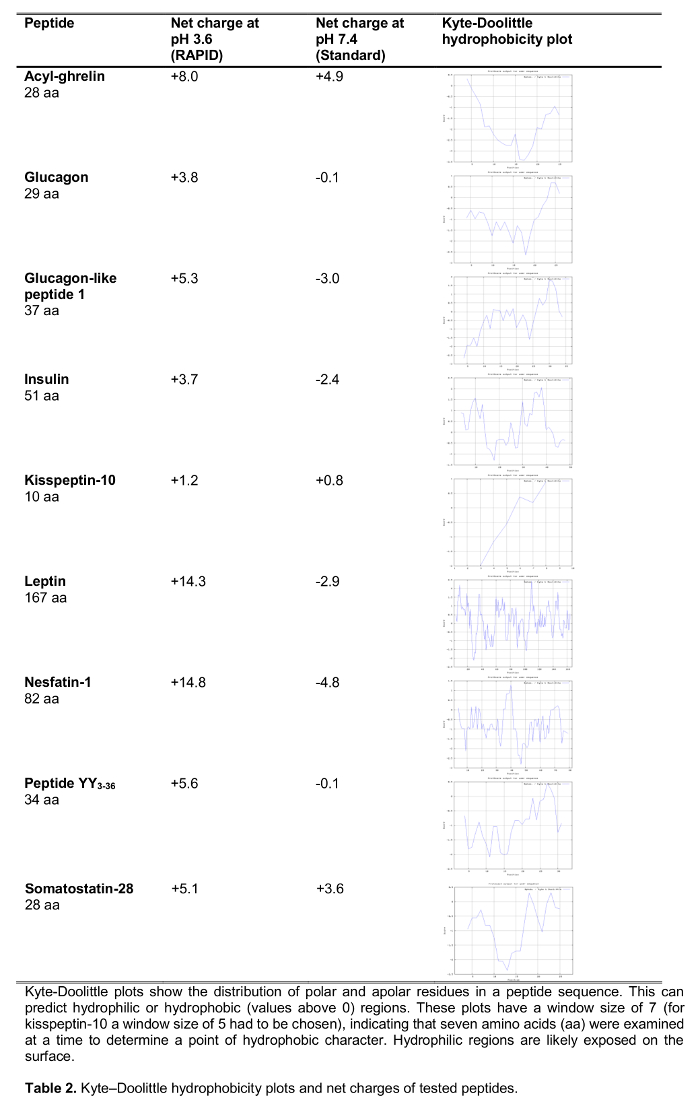
Цель настоящего исследования состояла в том, чтобы проверить быстрый метод обработки крови в организме человека по сравнению со стандартной обработкой крови, ЭДТА крови на льду, который широко рекомендуется 14 и часто уСЭД в клинической практике, а также условий исследования. Мы тестировали восстановление выбора 125 I-меченных пептидов , участвующих в регуляции потребления пищи , включая установленные пептиды, а также новых кандидатов недавно предложил , чтобы играть роль в питании регулирования (воздействие на потребление пищи приведены в таблице 1) следующую обработку с обоими методами. Гормоны были также выбраны для представления пептиды различной длины и заряда (таблица 2). Кроме того, для грелина мы исследовали молекулярную форму (ы) в соответствии со стандартными и экспресс-метод. И, наконец, мы провели оценку эндогенного грелин (ацил и desacyl грелина), а также уровни kisspeptin, пептид также недавно предложил играть определенную роль в регуляции потребления пищи 15,16 после быстрого или стандартной обработки. Кроме того, мы также исследовали эти уровни пептида в популяции субъектов с широким диапазоном индекса массы тела ( в диапазоне от 10.2-67.6 кг / м 2) для изучения possibле различия, связанные с хроническими измененном веса тела.
Диагностика, оценка и план:
участники исследования
Все участники исследования были недавно госпитализированных пациентов (включение было в течение двух дней с момента поступления в стационар) Отдела психосоматической медицины Шарите-Universitätsmedizin Берлине и дали письменное информированное согласие. Для того, чтобы избежать какого-либо влияния пола только пациентов женского пола были включены. В общей сложности 42 субъектов участвовали в этом исследовании и были разделены на три группы: с нормальным весом (ИМТ 18.5-25 кг / м 2, п = 12), анорексии (ИМТ <17,5 кг / м 2, п = 15) и ожирение (ИМТ> 30 кг / м 2, п = 15). Anorexic и ожирением пациентов былидиагноз в соответствии с Международной классификацией болезней-10 и госпитализированы для увеличения веса (анорексии) или снижения веса (ожирение), соответственно. Все пациенты с нормальным весом были госпитализированы из-за исключительно симптомами соматоформных без соответствующих соматических расстройств. У больных с желудочно-кишечными симптомами соматоформных или в анамнезе желудочно-кишечной хирургии были исключены. Критерии исключения также охватывает возраст <18 лет, текущая беременность и без лечения психотических заболеваний. Сбор крови проводили на день 2 или 3, после того, как госпитализации до получения диетического лечения с целью увеличения или снижения массы тела, соответственно. Антропометрические параметры оценивались в тот же день.
Protocol
Representative Results
Discussion
Мы сообщали ранее , что экспресс – метод для обработки крови улучшается восстановление для 11/12 пептидов по сравнению со стандартной обработкой крови у крыс 6. В настоящем исследовании мы показали, что этот метод также подходит для использования в организме человека. После быстрой ?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана STE Research Foundation German 1765 / 3-1 (AS) и германским министерством по образованию и научным исследованиям 03IPT614A (CG). Мы благодарим Reinhard Ломмель и Петра Буссе за отличную техническую поддержку, а также Карин Йоханссон и Кристины Hentzschel за помощь в организации и проведения антропометрических измерений
Materials
| diprotin A | Peptides International, Louisville, KY, USA | IDP-4132 | |
| E-64-d | Peptides International, Louisville, KY, USA | IED-4321-v | |
| antipain | Peptides International, Louisville, KY, USA | IAP-4062 | |
| leupeptin | Peptides International, Louisville, KY, USA | ILP-4041 | |
| chymostatin | Peptides International, Louisville, KY, USA | ICY-4063 | |
| Sep-Pak C18 cartridges | Waters Corporation, Milford, MA, USA | WAT051910 | 360 mg, 55-105 µm |
| acyl-ghrelin | Millipore, Billerica, MA, USA | 9088-HK | Radioactive |
| GLP-1 | Millipore, Billerica, MA, USA | 9035-HK | Radioactive |
| glucagon | Millipore, Billerica, MA, USA | 9030 | Radioactive |
| insulin | Millipore, Billerica, MA, USA | 9011S | Radioactive |
| leptin | Millipore, Billerica, MA, USA | 9081-HK | Radioactive |
| kisspeptin-10 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-048-56 | Radioactive |
| nesfatin-1 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-003-26 | Radioactive |
| PYY3-36 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-059-02 | Radioactive |
| somatostatin-28 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-060-16 | Radioactive |
| ZORBAX Rapid Resolution HT SB-C18 column | Agilent Technologies, Santa Clara, CA, USA | 822700-902 | 2.1 x 50 mm, 1.8 µm |
| Agilent 1200 LC | Agilent Technologies, Santa Clara, CA, USA | HPLC, several components, therefore no single catalog number | |
| Kisspeptin RIA | Phoenix Pharmaceuticals, Burlingame, CA, USA | # RK-048-56 | Radioactive |
| Total ghrelin RIA | Millipore, Billerica, MA, USA | # GHRT-89HK | Radioactive |
| Active ghrelin RIA | Millipore, Billerica, MA, USA | # GHRA-88HK | Radioactive |
| SigmaStat 3.1 | Systat Software, San Jose, CA, USA | online download |
Referências
- Finucane, M. M., et al. National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants. Lancet. 377 (9765), 557-567 (2011).
- James, W. P. The epidemiology of obesity: the size of the problem. J Intern Med. 263 (4), 336-352 (2008).
- Stengel, A., Taché, Y. Gastric peptides and their regulation of hunger and satiety. Curr Gastroenterol Rep. 14 (6), 480-488 (2012).
- Hussain, S. S., Bloom, S. R. The regulation of food intake by the gut-brain axis: implications for obesity. Int J Obes (Lond). 37 (5), 625-633 (2013).
- Hosoda, H., et al. Optimum collection and storage conditions for ghrelin measurements: octanoyl modification of ghrelin is rapidly hydrolyzed to desacyl ghrelin in blood samples). Clin Chem. 50 (6), 1077-1080 (2004).
- Stengel, A., et al. The RAPID method for blood processing yields new insight in plasma concentrations and molecular forms of circulating gut peptides. Endocrinology. 150 (11), 5113-5118 (2009).
- Stengel, A., et al. Lipopolysaccharide differentially decreases plasma acyl and desacyl ghrelin levels in rats: Potential role of the circulating ghrelin-acylating enzyme GOAT. Peptides. 31 (9), 1689-1696 (2010).
- Stengel, A., et al. Cold ambient temperature reverses abdominal surgery-induced delayed gastric emptying and decreased plasma ghrelin levels in rats. Peptides. 31, 2229-2235 (2010).
- Stengel, A., et al. Central administration of pan-somatostatin agonist ODT8-SST prevents abdominal surgery-induced inhibition of circulating ghrelin, food intake and gastric emptying in rats. Neurogastroenterol Motil. 23 (7), e294-e308 (2011).
- Stengel, A., et al. Abdominal surgery inhibits circulating acyl ghrelin and ghrelin-O-acyltransferase levels in rats: role of the somatostatin receptor subtype 2. Am J Physiol Gastrointest Liver Physiol. 301, G239-G248 (2011).
- Wang, L., et al. Intravenous injection of urocortin 1 induces a CRF2 mediated increase in circulating ghrelin and glucose levels through distinct mechanisms in rats. Peptides. 39, 164-170 (2013).
- Goebel-Stengel, M., Stengel, A., Wang, L., Taché, Y. Orexigenic response to tail pinch: role of brain NPY(1) and corticotropin releasing factor receptors. Am J Physiol Regul Integr Comp Physiol. 306 (3), R164-R174 (2014).
- Goebel, M., Stengel, A., Wang, L., Reeve, J., Taché, Y. Lipopolysaccharide increases plasma levels of corticotropin-releasing hormone in rats. Neuroendocrinology. 93 (3), 165-173 (2011).
- Banfi, G., Salvagno, G. L., Lippi, G. The role of ethylenediamine tetraacetic acid (EDTA) as in vitro anticoagulant for diagnostic purposes. Clin Chem Lab Med. 45 (5), 565-576 (2007).
- Stengel, A., Wang, L., Goebel-Stengel, M., Taché, Y. Centrally injected kisspeptin reduces food intake by increasing meal intervals in mice. Neuroreport. 22 (5), 253-257 (2011).
- De Bond, J. A., Smith, J. T. Kisspeptin and energy balance in reproduction. Reproduction. 147 (3), R53-R63 (2014).
- Wren, A. M., et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab. 86 (12), 5992 (2001).
- Schulman, J. L., Carleton, J. L., Whitney, G., Whitehorn, J. C. Effect of glucagon on food intake and body weight in man. J Appl Physiol. 11 (3), 419-421 (1957).
- Steinert, R. E., Poller, B., Castelli, M. C., Drewe, J., Beglinger, C. Oral administration of glucagon-like peptide 1 or peptide YY 3-36 affects food intake in healthy male subjects. Am J Clin Nutr. 92 (4), 810-817 (2010).
- Dewan, S., et al. Effects of insulin-induced hypoglycaemia on energy intake and food choice at a subsequent test meal. Diabetes Metab Res Rev. 20 (5), 405-410 (2004).
- Schlogl, M., et al. Increased 24-hour ad libitum food intake is associated with lower plasma irisin concentrations the following morning in adult humans. Appetite. 90, 154-159 (2015).
- Heymsfield, S. B., et al. Recombinant leptin for weight loss in obese and lean adults: a randomized, controlled, dose-escalation trial. JAMA. 282 (16), 1568-1575 (1999).
- Shimizu, H., et al. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 150, 662-671 (2009).
- Batterham, R. L., et al. Inhibition of food intake in obese subjects by peptide YY3-36. N Engl J Med. 349 (10), 941-948 (2003).
- Shibasaki, T., et al. Antagonistic effect of somatostatin on corticotropin-releasing factor-induced anorexia in the rat. Life Sci. 42 (3), 329-334 (1988).
- Goebel-Stengel, M., Stengel, A., Taché, Y., Reeve, J. R. The importance of using the optimal plasticware and glassware in studies involving peptides. Anal Biochem. 414 (1), 38-46 (2011).
- Smets, E. M., et al. Decreased plasma levels of metastin in early pregnancy are associated with small for gestational age neonates. Prenat Diagn. 28 (4), 299-303 (2008).
- Kojima, M., et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 402 (6762), 656-660 (1999).
- Stengel, A., Yin Taché, Y., Yang, the Gastric X/A-like Cell as Possible Dual Regulator of Food Intake. J Neurogastroenterol Motil. 18 (2), 138-149 (2012).
- Inhoff, T., et al. Desacyl ghrelin inhibits the orexigenic effect of peripherally injected ghrelin in rats. Peptides. 29, 2159-2168 (2008).
- Hirayama, H., et al. Contrasting effects of ghrelin and des-acyl ghrelin on the lumbo-sacral defecation center and regulation of colorectal motility in rats. Neurogastroenterol Motil. 22 (10), 1124-1131 (2011).
- Horikoshi, Y., et al. Dramatic elevation of plasma metastin concentrations in human pregnancy: metastin as a novel placenta-derived hormone in humans. J Clin Endocrinol Metab. 88 (2), 914-919 (2003).
- Yang, Y. U., Xiong, X. Y., Yang, L. I., Xie, L., Huang, H. Testing of kisspeptin levels in girls with idiopathic central precocious puberty and its significance. Exp Ther Med. 9 (6), 2369-2373 (2015).
- Hosoda, H., Kojima, M., Matsuo, H., Kangawa, K. Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue. Biochem Biophys Res Commun. 279 (3), 909-913 (2000).
- Raff, H. Total and active ghrelin in developing rats during hypoxia. Endocrine. 21 (2), 159-161 (2003).
- Evans, M. J., Livesey, J. H., Ellis, M. J., Yandle, T. G. Effect of anticoagulants and storage temperatures on stability of plasma and serum hormones. Clin Biochem. 34 (2), 107-112 (2001).
- Nabuchi, Y., Fujiwara, E., Kuboniwa, H., Asoh, Y., Ushio, H. The stability and degradation pathway of recombinant human parathyroid hormone: deamidation of asparaginyl residue and peptide bond cleavage at aspartyl and asparaginyl residues. Pharm Res. 14 (12), 1685-1690 (1997).
- White, A., Handler, P., Smith, E. L. . Principles of Biochemistry. , (1973).

