Формирование гигантского размера Polymersomes гель-регидратация при содействии
Summary
We present a protocol to rapidly form giant polymer vesicles (pGVs). Briefly, polymer solutions are dehydrated on dried agarose films adhered to coverslips. Rehydration of the polymer films results in rapid formation of pGVs. This method greatly advances the preparation of synthetic giant vesicles for direct applications in biomimetic studies.
Abstract
Polymer vesicles, or polymersomes, are being widely explored as synthetic analogs of lipid vesicles based on their stability, robustness, barrier properties, chemical versatility and tunable physical characteristics. Typical methods used to prepare giant-sized (> 4 µm) vesicles, however, are both time and labor intensive, yielding low numbers of intact polymersomes. Here, we present for the first time the use of gel-assisted rehydration for the rapid and high-yielding formation of giant (>4 µm) polymer vesicles (polymersomes). Using this method, polymersomes can be formed from a wide array of rehydration solutions including several different physiologically-compatible buffers and full cell culture media, making them readily useful for biomimicry studies. This technique is also capable of reliably producing polymersomes from different polymer compositions with far better yields and much less difficulty than traditional methods. Polymersome size is readily tunable by altering temperature during rehydration or adding membrane fluidizers to the polymer membrane, generating giant-sized polymersomes (>100 µm).
Introduction
Создание синтетических клеток размера, гигантских однослойных везикул (GUVs) представляет все больший интерес в восстановлении в пробирке различных клеточных процессов для создания основы для генерации клеточного типа 1,2 искусственной системы. В то время как GUVs, состоящие из липидных мембран являются отличными подражает природных, биологических мембран, они неустойчивы против экологических колебаний и имеют достаточно короткий срок годности. Из-за этих ограничений, амфифильные блок-сополимеры, которые были использованы в качестве липидного мимике с образованием полимерных везикул, или polymersomes. В этом контексте polymersomes имеют преимущество в развитии биомиметические клеточных систем , из – за их повышенной стабильности 3, химической универсальностью 4,5 и модифицируемые физические черты 6 – 8.
Современные методы для формирования гигантских размеров polymersomes включают electroformation 9 и шаблонного регидратант 10, оба из шHICH отнимают много времени, трудоемкими, требуют специализированного оборудования и производить низкие урожаи нетронутых гигантских polymersomes. Простой гель-полуавтоматическим методом регидратации недавно был разработан для производства липидных GUVs 11. Здесь мы описываем адаптацию геля при содействии метода регидратации для создания гигантских polymersomes с различными полимерных композиций, регулируемый размер, а также в различных буферных композиций.
Вкратце, 1% вес / объем стандартной гель-электрофореза в агарозном ДНК пленок обезвоживают на покровным стеклом. Полимерные растворы, полученные в хлороформе, затем распространяются по всей обезвоженной агарозном пленки и дают испариться. После полного удаления растворителя, полимерные пленки регидратации в буфере выбора при умеренном нагревании (40-70 ° C) и гигантских (> 4 мкм) образуются размером polymersomes в течение 30 мин. Этот метод быстро производит сотни полностью неповрежденных, хорошо образованных polymersomes с использованием стандартного лабораторного оборудования и ReageNTS при минимальных затратах.
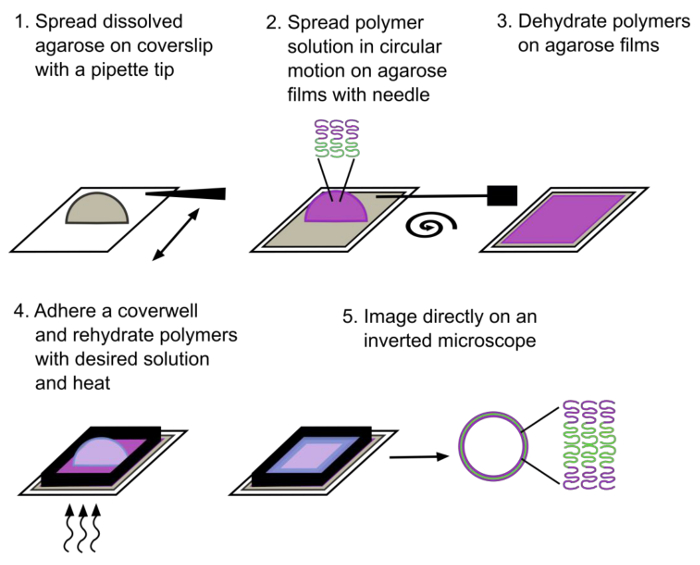
Рисунок 1. Схема изображающая гелю полуавтоматическим методом регидратации. Гигантские polymersomes , состоящие из диблоксополимером образуются после ~ 30 мин регидратации. Гидрофильный блок обозначается пурпурным цветом и гидрофобный блок обозначается зеленым цветом. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Protocol
Representative Results
Discussion
Polymersomes становятся широко изучены в качестве биологических мембран мимике. Надежные и универсальные свойства полимеров делают их широко привлекательными для исследований, требующих мембранного функционализации, долговечность и настроенную реагирования. Традиционные методы формирования гигантских размеров polymersomes 9,10 (> 4 мкм) являются трудоемкими и требуют дорогостоящего и специализированного оборудования. Здесь мы представляем впервые, быстрый, универсальный и надежный метод для формирования polymersomes гигантских размеров, используя стандартные недорогие лабораторные реагенты и оборудование.
С помощью гель-помощь регидратации, однослойные polymersomes может быть сформирован быстро (<30 мин), в различных регидратации растворов (в том числе среды для культивирования клеток) и с множеством различных полимеров (данные не показаны). Формирование мультиламеллярными или асимметричных везикулы не наблюдалось с помощью этой методики. На протяжении всей этой работы, мы использовали поли (окиси этилена) – поли (b-бутадиена) (ПЭО-PBD, EO 22 -BD 37) нейтральный диблок – сополимер. Много различных полимерных композиций (в том числе заряженных диблоксополимеров) работают хорошо с помощью этого метода (не показан). Тем не менее, некоторые коммерчески доступные триблок-сополимеры и высшие сополимеры молекулярной массой диблок (~> 5000 дальтонов) не образуют отдельных polymersomes. Для всех экспериментов в этой рукописи, низкая концентрация меченых липидов легировался в растворах полимеров только в целях визуализации. Также могут быть использованы и другие методы визуализации, в том числе полимеры, непосредственно функционализованных флуоресцентным красителем. Polymersomes может быть также визуализируют с помощью яркой микроскопии, хотя флуоресцентной микроскопии обеспечивает более высокое разрешение.
Большинство незначительных модификаций протокола, как правило, не изменяют результаты. Например, небольшие различия в концентрации раствора полимера, высевали на покровные не изменяют образование полимера FILM формируется. В то время как полный диапазон концентраций , не была определена, образование polymersome будет успешно происходить с большим диапазоном концентраций пленки полимера (например, 1-10 мг / мл). Тем не менее, есть некоторые изменения протокола, которые негативно повлиять на формирование polymersome. Наиболее примечательным является то, что круглые покровные стекла (вместо квадрата) в результате очень низкого образования polymersomes. Мы объясняем это чрезвычайно даже пальто агарозы на стекле, который фактически препятствует образованию polymersomes.
Одним из наиболее заметных проблем этого метода является возможность восстановить polymersomes с поверхности с высоким выходом. Есть определенные случаи, в которых удаление polymersomes от исходной поверхности, может быть выгодным. Из-за высокой фоновой флуоресценции из обезвоженной полимерной пленки, удаление отдельных polymersomes и приклеивание их очистки покровные увеличит качество изображений и характеристика (Партикулярно во время анализа FRAP). Чтобы сделать это, осторожно пипеткой с наконечником пипетки, в котором конец был отрезан десорбируется с polymersomes от поверхности (хотя количество везикул извлекаемых значительно ниже, чем те, что изначально сформирован). Polymersomes затем могут быть размещены на модифицированных поверхностях покровное, позволяя polymersome взаимодействовать с новым покровным. Как правило, для нейтральных polymersomes ПЭО-PBD, покровные обрабатывают озоном в течение 15 мин позволяют polymersomes упасть на поверхность для работы с изображениями. Различные модификации поверхности требуется для различных polymersome композиций (например, отрицательно или положительно заряженные полимеры).
Большинство материалов, используемых в данном протоколе успешно хранятся и используются в течение нескольких дней до нескольких недель. Застывший агарозы может быть повторное испарение и повторно использовать до тех пор, пока агарозном начинает иметь агрегатов даже после кипячения, или затвердевший агарозы начинает сохнуть. Покровные с высушенными агарозных пленок можно хранить и использоватьd на неопределенный срок (например, месяцы). Полимер растворили в хлороформе можно хранить при -20 ° С в течение нескольких месяцев. После того, как полимерная пленка высушивается на агарозном пленках, однако, пленки необходимо хранить под вакуумом и использовать в течение двух недель (более длительный срок хранения не был непосредственно определен, но существуют заметные различия в polymersomes, образованные из полимерных пленок старше двух недель).
Использование геля при содействии протокола регидратации, представленный здесь, сотни равномерно-образных polymersomes образуются быстро с помощью всего лишь нескольких часов труда с использованием стандартного оборудования и недорогих лабораторных реагентов. Кроме того, polymersomes могут быть сформированы в различных физиологических буферных растворов и из различных полимерных композиций (не показаны). Незначительные изменения в метод не оказывали негативного изменяют образование polymersomes, оказание гелевого помощь Регидратационные универсальный и доступный метод для ученых с той или иной технической еxpertise.
Возможность легко создавать гигантские polymersomes на шкале размеров ячеек имеет важное значение для создания искусственных клеточных подобных систем. Простота использования и универсальность гелеобразной помощь регидратации, чтобы сделать эти polymersomes предлагает огромный прогресс в области биомиметического для создания надежной клеточной мембраны, мимике. Например, с помощью этой методики, стратегии для инкапсуляции различных внутриклеточных компонентов, функционализации полимера с клеточной мембраной белков и включения мембранных транспортных белков, просто назвать несколько, может быть предназначена для построения polymersome на основе искусственных клеток.
Declarações
The authors have nothing to disclose.
Acknowledgements
We would like to gratefully acknowledge Dr. Ian M. Henderson, Andrew Gomez and Dr. Walter F. Paxton for their technical expertise, advice and help in this work. This work was supported by the U.S. Department of Energy, Office of Basic Energy Sciences, Division of Materials Sciences and Engineering (BES-MSE). ACG, DYS and GDB were supported by BES-MSE. This work was performed, in part, at the Center for Integrated Nanotechnologies, an Office of Science User Facility operated for the U.S. Department of Energy (DOE) Office of Science (user project number RA2015A0004, PI: ACG).
Materials
| 125 mL Erlenmeyer flask | VWR | 89000-360 | |
| 18 guage needle | VWR | BD-305196 | |
| 25 mm square coverslips | VWR | 48366-089 | |
| Agarose | Sigma | A9539 | A standard agarose for DNA gel electrophoresis |
| Chloroform | Sigma | 288306-2L | |
| Commerical coverwell | Electron Microscopy Sciences | 70336 | Press-to-Seal Silicone Isolators |
| Fiji Image Analysis Software | ImageJ | Free Download: http://fiji.sc/Fiji | |
| Glass vial with Teflon Lid | VWR | 66009-556 | 1.9mL capacity, case of 144 |
| Liss-rhodamine B PE Lipid | Avanti Polar Lipids | 810150C | 1 mg of lipid at 1 mg/ml concentration in chloroform |
| Parafilm | VWR | 52858-000 | 10.2 cm x 38.1 m |
| poly(ethylene oxide)-b-poly(butadiene) or PEO-PBD (with a molecular weight of 2,940) | Polymer Source | P2904-BdEO | http://polymersource.com/dataSheet/P2904-BdEO.pdf |
| Pastic Petri Dish | VWR | 25384-092 | |
| Teflon tape | VWR | 300001-057 | 1/2" width |
Referências
- Streicher, P., et al. Integrin reconstituted in GUVs: A biomimetic system to study initial steps of cell spreading. Biochim. Biophys. Acta. 1788 (10), 2291-2300 (2009).
- Paxton, W., Bouxsein, N. F., Henderson, I., Gomez, A., Bachand, G. Dynamic Assembly of Polymer Nanotube Networks via Kinesin Powered Microtubule Filaments. Nanoscale. , (2015).
- Bermudez, H., Brannan, A. K., Hammer, D. a., Bates, F. S., Discher, D. E. Molecular weight dependence of polymersome membrane structure, elasticity, and stability. Macromolecules. 35 (21), 8203-8208 (2002).
- Amos, R. C., Nazemi, A., Bonduelle, C. V., Gillies, E. R. Tuning polymersome surfaces: functionalization with dendritic groups. Soft Matter. 8 (21), 5947-5958 (2012).
- Egli, S., et al. Biocompatible functionalization of polymersome surfaces: A new approach to surface immobilization and cell targeting using polymersomes. J. Am. Chem. Soc. 133 (12), 4476-4483 (2011).
- Kim, K. T., Cornelissen, J. J. L. M., Nolte, R. J. M., Van Hest, J. C. M. A polymersome nanoreactor with controllable permeability induced by stimuli-responsive block copolymers. Adv. Mater. 21 (27), 2787-2791 (2009).
- Paxton, W. F., Price, D., Richardson, N. J. Hydroxide ion flux and pH-gradient driven ester hydrolysis in polymer vesicle reactors. Soft Matter. 9, 11295-11302 (2013).
- Henderson, I. M., Paxton, W. F. Salt, shake, fuse – Giant hybrid polymer/lipid vesicles through mechanically activated fusion. Angew. Chem. Int. Ed. 53 (13), 3372-3376 (2014).
- Discher, B. M. Polymersomes: Tough Vesicles Made from Diblock Copolymers. Science. 284 (5417), 1143-1146 (1999).
- Howse, J. R., et al. Templated formation of giant polymer vesicles with controlled size distributions. Nat Mat. 8 (6), 507-511 (2009).
- Horger, K. S., Estes, D. J., Capone, R., Mayer, M. Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength. J. Am. Chem. Soc. , 1-24 (2009).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat meth. 9 (7), 676-682 (2012).

