Utvikling og vedlikehold av en Preklinisk Pasient Avledet Tumor Xenotransplantat Modell for Undersøkelse av Novel Anti-Cancer Therapies
Summary
Utnytte pasient avledet svulster i en subkutan preklinisk modell er en utmerket måte å studere effekten av nye behandlingsformer, prediktiv biomarkører, og resistente veier. Denne modellen, i stoffet utviklingsprosessen, er avgjørende for å bestemme skjebnen til mange nye anti-kreft terapi før klinisk undersøkelse.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
Tykktarmskreft (CRC) er en betydelig bidragsyter til kreftdødsfall i USA. I 2015 var det anslagsvis 132,700 nye tilfeller av CRC med 49,700 dødsfall 1. Selv om prognosen hos pasienter med lokalisert sykdom er utmerket, pasienter med avansert sykdom har dårlige resultater, noe som gjør dette til en stor prioritet i utviklingen av nye behandlingsformer. Til tross for standard of care kjemoterapeutiske regimer og nyere biologiske som er utplassert mot denne sykdommen, har det vært bare en trinnvis økning i total overlevelse. Følgelig er det en betydelig innsats i å forstå driver trasé som er involvert i å tilrettelegge tumorvekst i denne sykdommen. Kreft Genome Atlas Network har nylig identifisert en rekke hovedveier som er innblandet i CRC feilregulering og inkluderer: WNT, phosphoinositide 3-kinase (PI3K), RAS, transformerende vekstfaktor-β (TGF-β) og TP53 to. Sammen med undersøkelser som beskriver othennes veier som forsterker veksten i CRC har antent utviklingen av nyere behandlingsformer rettet mot betydelig bedre overlevelse hos denne pasientgruppen 3-5. Utnytte prekliniske modeller i onkologi narkotika utvikling har vært viktig i denne prosessen i å forutsi den kliniske aktiviteten til disse nye forbindelser.
har vært benyttet ulike prekliniske modeller i narkotika utviklingsprosessen. Tatt i betraktning at prekliniske transgene dyremodeller og foreviget cellelinjer har vært mislykket i å bestemme den kliniske aktiviteten av nye kreftbehandlinger, hovedsakelig på grunn av deres manglende evne til å reflektere kompleksiteten i menneskelige svulster, er det etablert pasient-avledet tumor xenograft (PDTX) modeller. Den største fordelen med denne modellen er at svulsten heterogenitet forblir intakt og tett reflekterer de molekylære egenskaper og klonalitet av opprinnelses pasienten svulst 6-9. PDTX modeller gir en utmerket in vivopreklinisk plattform for å studere nye midler, narkotika motstand trasé, kombinatoriske strategier, og kreft stamcellebiologi 10.
En generell oversikt over PDTX fremgangsmåten er illustrert i figur 1. Det begynner i klinikken, samtykker pasienter til å tillate noen av deres overskytende tumorvevet som skal brukes for denne forskningen. Deretter ved kirurgi, er en del av svulsten spilte av en patolog og satt i media for å bli transportert til forskning personell. Umiddelbart etter dette, er en del av tumoren skåret i små biter og transplantert inn i immundefekte mus subkutant. Når tumoren vokser, blir det passert inn i forskjellige generasjoner av mus for å opprettholde den tumor 10. Typisk, etter at F3 generasjon tumoren kan utvides inn i en behandlingsstudie hvor nye forbindelser og / eller kombinatoriske behandlinger vurderes. Utnytte Next Gen Seq (Exome Seq, RNA Seq og SNP array) potensielle prediktive biomarkører er oppdageed at ved utvelgelse av pasienter som kan stamme nytte av en bestemt behandling.
De overordnede målene for hjelp PDTX modeller er å: 1) evaluere effekten av nye behandlingsformer som monoterapi eller i kombinasjon og 2) identifisere prediktive biomarkører av følsomhet eller resistens før klinisk undersøkelse. I dette manuskriptet, gir vi den metodikken i initiering og vedlikehold av en CRC PDTX bank og gi fordeler og begrensninger av denne modellen i legemiddelutvikling oppdagelse.
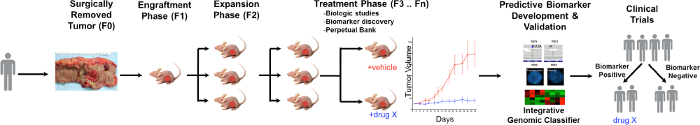
Figur 1. Oversikt over CRC PDTX Model Protocol. En pasient som stammer svulsten er mottatt fra kirurgi og umiddelbart injisert i atymiske hårløse mus subkutant. Når svulsten vokser den er utvidet til etterfølgende generasjoner, og til slutt utvidet for behandlingsstudier. behandling Responses vurderes og prediktive biomarkører er identifisert som kan hjelpe til pasientens valg. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Den PDTX drug discovery plattformen tilbyr en forbedret modell for svakhetene i andre prekliniske modeller som er upålitelig i å forutsi klinisk aktivitet av nye forbindelser. Viktigere, svulster i denne modellen er biologisk stabil, beholde metastatisk potensial, og viser lignende stoff respons fra generasjon til generasjon. I denne modellen blir pasient avledet tumorer injisert i atymiske nakne mus, passert, og senere brukt i terapeutisk vurdering. Det er flere viktige skritt for en vellykket PDTX bank som inkludere…
Declarações
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
Referências
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

