使用多氟化胆汁酸和<em>在体内</em>磁共振成像来衡量胆汁酸运输
Summary
工具来诊断胆汁酸的吸收不良,并测量在体内胆汁酸转运的限制。活体动物一个创新的方法,描述了利用质子结合(1小时)加氟(19 F)磁共振成像;这种新颖的方法具有平移潜力筛选在临床实践中的胆汁酸吸收不良。
Abstract
随着他们作为促进脂肪的吸收洗涤剂的传统角色,新兴的文献表明,胆汁酸是影响多个器官强有力的信号分子;它们调节肠能动性和激素的产生,以及改变血管张力,糖代谢,脂质代谢和能量利用率。在粪便胆汁酸的变化可能会改变肠道微生物,促进结肠的病理包括cholerrheic腹泻和结肠癌。粪便胆汁酸成分的主要监管机构小肠心尖钠依赖性胆汁酸转运体(ASBT)和成纤维细胞生长因子19(FGF19)。 ASBT减少表达和功能降低肠内胆酸向上走。此外, 体外数据表明,一些FDA批准的药物抑制ASBT功能。缺乏FGF19释放增加肝脏胆汁酸的合成和释放进入肠道,以压倒ASBT水平。无论是ASBT功能障碍或缺失FGF19增加˚FECAL胆汁酸,并可能导致慢性腹泻,促进结肠肿瘤。遗憾的是,工具测量胆汁酸吸收不良及药物对胆汁酸转运体内的行动是有限的。理解的胆汁酸的复杂的动作,技术要求允许在肠道和代谢组织胆汁酸同时监测。这使我们设想一种创新的方法来测量在活的动物胆汁酸运输用质子(1 H)和氟(19 F),磁共振成像(MRI)的组合。为氟(19 F)的新颖的示踪剂为基础的活的动物的MRI创建和测试,无论是在体外和体内 。这种方法的优点包括缺乏暴露于电离辐射和潜力转化为临床研究和实践。
Introduction
连同它们作为促进从肠道吸收脂肪洗涤剂古典作用,胆汁酸已成为影响除了与其肠肝循环1,2-相关的那些多器官效信号分子。除了控制其自身的新陈代谢,胆汁酸调节胃肠生理( 例如 ,肠能动性和肠降血糖素激素的产生,结肠生理学和癌症的易感性)的若干方面,并且对血管张力,葡萄糖和脂质代谢,能量利用全身效应。虽然其中一些效果在肠道被介导,其它的是由于在全身胆汁酸水平餐后变化,如在肥胖患者或胃旁路手术后指出。为了阐明的胆汁酸,需要新技术的复杂的代谢作用,其允许在不同的解剖隔间胆汁酸水平的同时监测,在胃肠道中和元栓塞性组织(肝,胰,骨骼肌和脂肪)。获得这样的时间和空间信息需要的创新技术- 活体成像使用这里描述的这样一种新的方法新的胆汁酸示踪剂。
在解剖车厢胆汁酸的成分和分布是由调节其肝脏合成和回肠的吸收,包括饮食,手术,抗生素的使用和肠道菌群的变化因素调控。肠胆汁酸的摄取其肠肝循环3( 图1)的一个关键调节器是回肠心尖钠依赖性胆汁酸转运(ASBT; SLC10A2)。虽然在整个肠发生被动吸收,ASBT介导的肠胆汁酸的95%的吸收,使通常存在的胆汁酸进入粪便有限溢出。 ASBT缺陷(Slc10a2 – / – )小鼠也增加粪便胆汁酸和减弱胆汁ACIð池4。
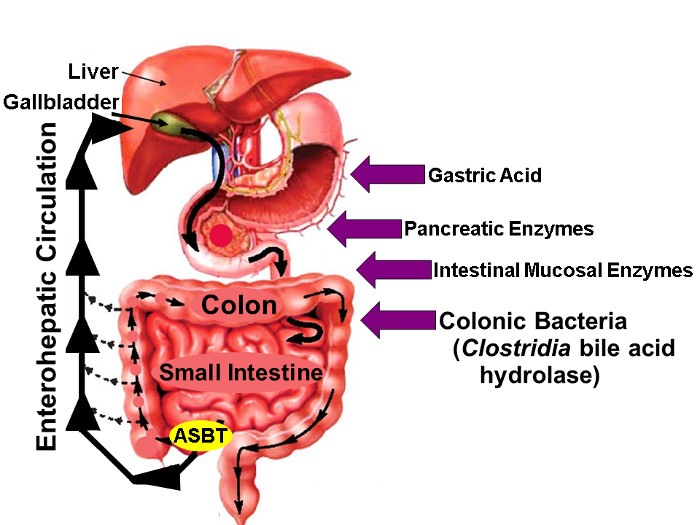
图1:胆汁酸的肠肝循环。
肝肠循环,从而胆汁酸在肝脏中合成,排泄到胆道,胆囊储存的插图,释放到近端小肠与膳食,并通过在ASBT回肠末端积极采纳。而胆汁酸少量在整个肠被动吸收的肠胆汁酸约95%是由导致在此通过的新胆汁酸合成的类似量补偿大便最小(约5%)损失ASBT主动转运肝脏,从而保持稳态胆汁酸池。在右边的箭头识别可能影响天然和氟标记的胆汁酸稳定性因素,包括胃酸,胰腺癌和肠粘膜酶,和,最importantl通过殖民远端小肠和结肠梭菌种释放Y,水解酶。 (修改许可16) 点击此处查看该图的放大版本。
胆汁酸吸收障碍可分为三种类型,其中每一个增加粪便羟基胆汁酸,从而使间歇性或慢性腹泻。键入从总回肠病变(如切除,克罗恩病)5 1的结果。键入从胆囊切除术,迷走神经,腹腔疾病,细菌过度生长,和胰腺功能不全3的结果。与此相反,“主要”(类型2)胆汁酸吸收障碍的人带来巨大的诊断的挑战,因为它们缺乏这种前提条件,不具备在回肠病理学证据。因此,初级胆汁酸吸收障碍通常是误诊为痢疾-Predominant肠易激综合征(IBS-D),也许对胃肠相关的门诊访问的最常见原因。据估计,IBS患者-D-三分之一具有初级胆汁酸吸收障碍;在美国,这可以表示几百万人5。最近的见解显示,主要由BAM肠道成纤维细胞生长因子19(FGF19)肝脏胆汁酸合成的反馈抑制受损的派生,而不是表达降低或ASBT的功能。
在主要的胆汁酸吸收不良,FGF19的低血浆水平未能关闭肝胆汁酸合成-在肠胆汁酸所得增加饱和胆汁酸转运,包括ASBT,和胆汁酸增加泄漏到粪便引起腹泻6 ( 图2)。在小鼠FGF15(鼠FGF19)有缺陷的扩大胆汁酸池,并增加粪便胆汁酸7。
<p class="“jove_content”">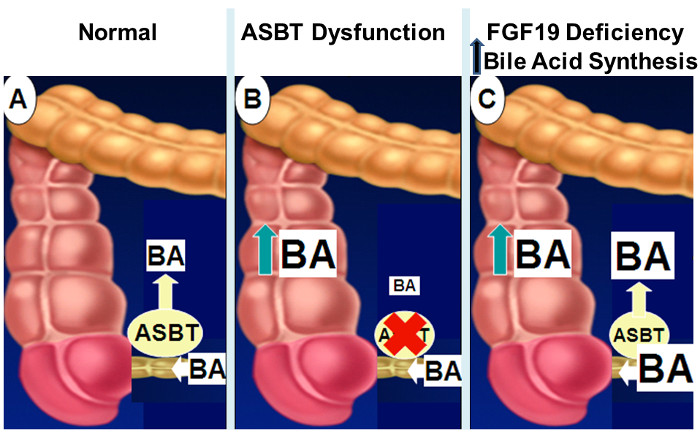
图2:肠道胆汁酸吸收不良的机制。
通常,如图面板 A,肠胆汁酸约95%是由主动转运在经由ASBT回肠末端吸收。当ASBT表达或活性被降低( 图B),在胆汁酸溢出进入结肠受损肠胆汁酸吸收的结果。受损FGF19信号(C组 ),缺乏在肠道胆汁酸压倒与胆汁酸进入结肠溢出ASBT运力浓度升高的肝胆汁酸合成结果反馈抑制。 请点击此处查看大图这个数字。
从长期来看,在粪胆ACI慢性抬高DS可促进大肠肿瘤。结肠肿瘤起因于体细胞基因突变,但环境因素,增加粪便胆汁酸可以加速并扩大此过程相关进步胃黏膜不典型增生。在啮齿类动物中,增加粪便胆汁酸无论是作为外源性或ASBT不足的后果来促进肠道发育异常和肿瘤形成8-10。
值得注意的是,挑衅性的调查结果表明,美国食品和药物管理局(FDA)批准的常用药物通过ASBT 体外 11强效抑制胆汁酸转运。如果这些药物减少体内小肠的胆汁酸转运,增加粪便胆汁酸水平,结肠病变的潜在影响是非常令人担忧。即使在结肠病理少量增加归因于使用这样的药物可以有一个主要的健康影响。它可以评估在体外的研究结果和流行病学OB的这些合理性的工具包servations会刺激更多的研究,包括上市后安全性研究。
尽管需要,实际检测来确定人的胆汁酸吸收不良所缺乏的。粪便胆汁酸直接测量被拒绝年前累赘,不切实际的,和不可靠的5。替代方法包括测量放射性硒标记胆酸衍生物(75 SeHCAT)和7α羟基-4-胆甾烯-3-酮(4),或胆汁酸结合剂的治疗试验的血浆水平保持75 SeHCAT测试有从诊断测试在欧洲有限,不FDA批准或可在美国使用。此外,即使是少量的辐射照射(0.26毫希/ 75 SeHCAT测试)引起了关注,并且细菌过度生长和先进的肝病可能混淆75 SeHCAT结果。 C4测试是潜在的有吸引力的,因为只有需要等离子体,但它具有低阳性预测VALUE和测试不够普及。测量FGF19血清水平也有类似的限制。频繁的临床医生诉诸的胆汁酸多价螯合剂治疗试验中,但这种方法不能提供胆汁酸吸收不良5的一个明确的诊断。
由于这些原因,一个新颖的MRI方法被设想使用创新的多氟化的胆汁酸(离子烫-MRI)来测量体内胆汁酸运输和分配。含氟(19 F),100%的天然丰度的稳定同位素的三个原子离子烫,类似地运送到天然胆汁酸12,并可以用于可视化胆汁酸运输与质子(1 H)和氟(的组合19 F)MRI,无电离辐射13,14敏感,安全的方法。
Protocol
Representative Results
Discussion
CA-LYS-TFA和CA-SAR-TFMA和使用表达ASBT和人胚肾细胞中表达钠/牛磺胆共输送多肽稳定转染的Madin-Darby犬肾细胞其运输的体外分析的合成(NTCP)在别的地方13,14详细说明。这里的重点是关于离子烫口服灌胃到活的动物,随后胆囊,肝和血液离子烫内容的分析的收获,和,特别是,在由活的动物的MRI胆囊成像离子烫。关键的步骤包括避免基于氟的麻醉剂可产生竞争的19 F信号,避免钳…
Declarações
The authors have nothing to disclose.
Acknowledgements
这项工作是由美国国立卫生研究院,糖尿病和消化研究所和肾脏疾病(资助号R21 DK093406和T32 DK067872到JP.R.)和VA优异奖(授权号1BX002129到JP.R.)的支持。
Materials
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 X 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg / ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
Referências
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).

