Bruke Multi-fluorerte gallesyrer og<em> I Vivo</em> Magnetic Resonance Imaging måle gallesyretransport
Summary
Verktøy for å diagnostisere gallesyre malabsorpsjon og måle gallesyre transport in vivo er begrenset. En innovativ tilnærming i levende dyr er beskrevet som bruker kombinerte proton (1 H) pluss fluor (19 F) magnetic resonance imaging; denne romanen metodikken har translasjonsforskning potensial til å screene for gallesyre malabsorpsjon i klinisk praksis.
Abstract
Sammen med sin tradisjonelle rolle som vaskemidler som fremmer fettopptaket, nye litteraturen indikerer at gallesyrer er potente signalmolekyler som påvirker flere organer; de modulerer tarmmotilitet og hormonproduksjon, og endre vaskulær tone, glukose metabolisme, lipidmetabolismen, og energiutnyttelse. Endringer i fekal gallesyrer kan endre gut mikrobiomer og fremme tykktarms patologi inkludert cholerrheic diaré og tykktarmskreft. Nøkkel regulatorer av fekal gallesyresammensetning er tynntarm Apical Sodium avhengig gallesyre Transporter (ASBT) og fibroblast vekstfaktor-19 (FGF19). Redusert ekspresjon og funksjon av ASBT senker intestinale gallesyre-opp-ta. Videre in vitro data tyder på at noen FDA-godkjente legemidler hemmer ASBT funksjon. Mangel FGF19 utgivelsen øker levergallesyresyntese og slipper inn i tarmen til nivåer som overskygger ASBT. Enten ASBT dysfunksjon eller FGF19 mangel øker fecal gallesyrer og kan gi kronisk diaré og fremme kolon neoplasi. Dessverre, verktøy for å måle gallesyre malabsorpsjon og handlingene til narkotika på gallesyre transport in vivo er begrenset. For å forstå de komplekse virkninger av gallesyrer, er teknikker kreves at tillate samtidig overvåkning av gallesyrer i tarmen og metabolske vev. Dette førte oss til å unnfange en innovativ metode for å måle gallesyretransport i levende dyr ved hjelp av en kombinasjon av proton (1 H) og fluor (19 F) magnetic resonance imaging (MRI). Nye tracere for fluor- (19F) -baserte levende dyr MRI ble opprettet og testet, både in vitro og in vivo. Sterke av denne fremgangsmåten omfatter den manglende eksponering for ioniserende stråling og translasjonelle potensial for klinisk forskning og praksis.
Introduction
Sammen med sin klassiske rolle som vaskemidler som letter fettopptaket fra tarmen, har gallesyrer dukket opp som potente signalmolekyler som påvirker flere organer i tillegg til de som er forbundet med deres enterohepatisk sirkulasjon 1,2. I tillegg til å kontrollere sin egen metabolisme, gallesyrer modulere flere aspekter av mage-fysiologi (f.eks tarmmotilitet og inkretinhormon produksjon, tykktarm fysiologi, og kreft mottakelighet) og har systemiske effekter på vaskulær tone, glukose og lipid metabolisme, og energiutnyttelse. Mens noen av disse effektene formidles i tarmen, andre er på grunn av postprandial endringer i systemiske gallesyrenivå, som nevnt i overvektige pasienter eller etter gastric bypass operasjon. For å belyse de komplekse metabolske virkninger av gallesyrer ny teknologi er nødvendig, som tillater samtidig overvåking av gallesyrenivåer i forskjellige anatomiske avdelinger, i mage-tarmkanalen og metastoffskifte vev (lever, bukspyttkjertel, skjelettmuskulaturen og adipose). Innhenting slik tidsmessig og romlig informasjon krever innovative teknologien – in vivo avbildning ved hjelp nye gallesyre sporstoffer som er beskrevet her er en ny tilnærming.
Gallesyre sammensetning og fordeling i anatomiske avdelinger er regulert av faktorer som modulerer deres leversyntese og ileal opptak, inkludert kosthold, kirurgi, bruk av antibiotika og endringer i tarmfloraen. En viktig regulator av intestinal gallesyreopptak for deres enterohepatisk sirkulasjon 3 (figur 1) er den ileal Apical Sodium avhengig gallesyre Transporter (ASBT, SLC10A2). Selv om passiv absorpsjon skjer gjennom tarmen, medierer ASBT opptak av 95% av intestinale gallesyrer slik at normalt er det begrenset utslipp av gallesyrer i avføringen. Asbt-mangel (Slc10a2 – / -) mus har økt fecal galle syrer og en redusert galle ACId basseng 4.
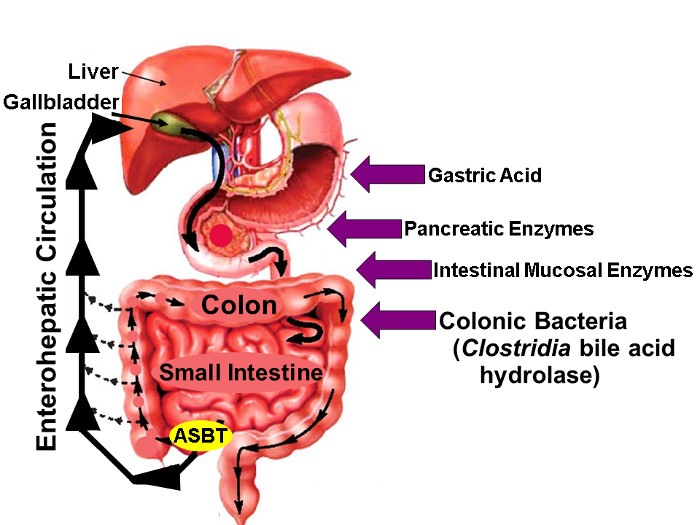
Figur 1: enterohepatisk sirkulasjon av gallesyrer.
Illustrasjon av enterohepatisk sirkulasjon der gallesyrer syntetiseres i leveren, utskilles i Galle forfedre lagret i galleblæren, utgitt i den proksimale tynntarmen med måltider, og aktivt tatt opp via ASBT i Distal ileum. Mens små mengder av gallesyrer er absorbert passivt gjennom tarmen, er omtrent 95% av intestinale gallesyrer transporteres aktivt ved ASBT som resulterer i minimal (ca. 5%) tap i avføring som kompenseres ved en tilsvarende mengde ny gallesyresyntese i leveren, for derved å opprettholde en stabil tilstand gallesyrebasseng. Pilene på høyre identifisere faktorer som kan påvirke innfødte og fluor-merket gallesyre stabilitet, herunder magesyre, bukspyttkjertelen og tarmslimhinne enzymer, og, mest importantly, hydrolytic enzymer utgitt av clostridietypene at kolonisere distal tynntarm og tykktarm. (Modifisert med tillatelse 16) Klikk her for å se en større versjon av dette tallet.
Gallesyre malabsorpsjon kan kategoriseres i tre typer, som hver øker fecal dihydroksy gallesyrer, for derved å forårsake intermitterende eller kronisk diaré. Type 1 resultater fra brutto ileal patologi (f.eks, reseksjon, Crohns sykdom) 5. Skriv 3 resultater fra kolecystektomi, vagotomy, cøliaki, bakteriell overvekst, og bukspyttkjertelen insuffisiens. I motsetning til personer med "primær" (Type 2) gallesyre malabsorpsjon utgjør en formidabel diagnostisk utfordring fordi de mangler slike forutgående forhold og ikke har bevis for patologi i ileum. Derfor er hovedgallesyre malabsorpsjon ofte feildiagnostisert som diaré-predominant irritabel tarm syndrom (IBS-D), kanskje den vanligste årsaken til gastroenterologi relaterte polikliniske besøk. Det har blitt anslått at en tredjedel av pasienter med IBS-D har hovedgallesyre malabsorpsjon; i USA, kan dette representere flere millioner personer 5. Nyere innsikt viser at primær BAM stammer fra svekket tilbakemeldinger hemming av hepatisk gallesyresyntese ved tarm fibroblast vekstfaktor-19 (FGF19), ikke av redusert uttrykk eller funksjon ASBT.
I primærgallesyre malabsorpsjon, lave plasmanivået av FGF19 ikke klarer å stenge av levergallesyresyntese – den resulterende økningen i tarmgallesyrer syrer gallesyre transportører, inkludert ASBT, og utvidet søl av gallesyrer i avføringen forårsaker diaré 6 (Figur 2). Mus mangelfull i Fgf15 (murine FGF19) har en utvidet gallesyre basseng og økt fecal gallesyrer 7.
<p class= "Jove_content">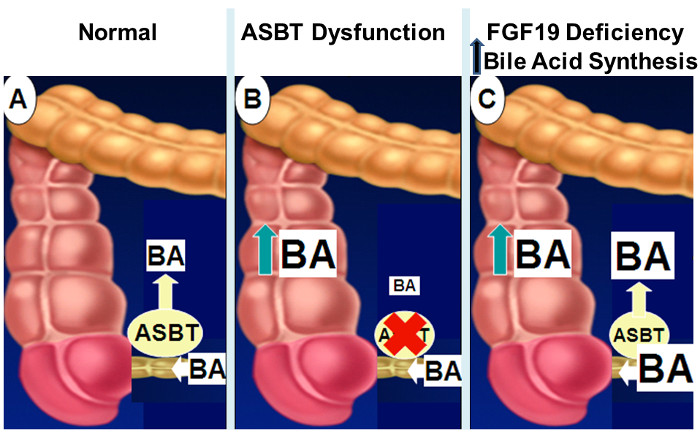
Figur 2: Mekanismer av Intestinal gallesyre malabsorpsjon.
Normalt, som vist i panel A, er omtrent 95% av intestinale gallesyrer absorbert av aktiv transport i den distale ileum via ASBT. Når ASBT ekspresjon eller aktivitet svekkes (panel B), svekkede intestinale gallesyre-opptak resulterer i utslipp av gallesyrer i kolon. Med nedsatt FGF19 signale (panel C), mangel på tilbakemeldinger hemming av hepatisk gallesyresyntese resulterer i økte konsentrasjoner av tarmgallesyrer som overskygger ASBT transportkapasitet søl av gallesyrer i tykktarmen. Klikk her for å se en større versjon av dette tallet.
Langsiktig, kronisk heving i fecal galle ACIds kan fremme kolon neoplasi. Colon neoplasi oppstår fra progressiv slimhinneforandringer forbundet med somatiske genmutasjoner, men miljømessige faktorer som øker fecal gallesyrer kan akselerere og forsterke denne prosessen. I gnagere, økte fekale gallesyrer, enten som en konsekvens av eksogen administrering eller Asbt mangel fremme tykktarm dysplasi og tumordannelse 8-10.
Spesielt provoserende funn tyder på at de mest brukte legemidler godkjent av Food and Drug Administration (FDA) potent hemmer gallesyretransport av ASBT in vitro 11. Hvis disse legemidlene reduserer tynntarmgallesyre transport in vivo og øke fekal gallesyrenivå, vil den potensielle effekten på tykktarmen patologi være om. Selv en liten økning i tykktarmen patologi skyldes bruk av et slikt medikament kan ha et stort helse innvirkning. En verktøykasse som kan vurdere troverdigheten i disse in vitro funn og epidemiologiske observations ville anspore ytterligere forskning, blant annet etter markedsføring sikkerhetsstudier.
Til tross for behovet, til praktiske analyser identifisere personer med gallesyre malabsorpsjon mangler. Direkte måling av fekal gallesyrer ble avvist år siden som tungvint, upraktisk, og upålitelig 5. Alternative fremgangsmåter omfatter måling av retensjon av et radioaktivt selen-merket cholsyre-derivat (75 SeHCAT) og plasmanivåene av 7α-hydroksy-4-kolesten-3-on (C4), eller et terapeutisk utprøving av gallesyrebindemiddel. 75 SeHCAT testing har begrenset tilgjengelighet i Europa og er ikke FDA-godkjent eller tilgjengelig for bruk i USA Dessuten, selv beskjeden stråling (0,26 mSv / 75 SeHCAT test) fra diagnostiske tester gir grunn til bekymring, og bakteriell overvekst og avansert leversykdom kan forvirre 75 SeHCAT resultater. C4-testing er potensielt attraktiv ettersom bare plasma er nødvendig, men det har lav positiv-prediktiv value og testing er ikke allment tilgjengelig. Måling serumnivåer av FGF19 har lignende begrensninger. Vanlige klinikere ty til en terapeutisk utprøving av gallesyrekompleksdannere, men denne tilnærmingen kan ikke gi en definitiv diagnose av gallesyre malabsorpsjon 5.
Av disse grunner ble en ny tilnærming MRI unnfanget for å måle gallesyre transport og fordeling in vivo ved hjelp av nyskapende multi-fluorerte gallesyrer (MFBA-MRI). MFBA som inneholder tre atomer av fluor (19 F), en stabil isotop av 100% naturlig forekomst, blir transportert på samme måte som naturlige gallesyrer 12, og kan brukes til å visualisere gallesyretransport med en kombinasjon av proton (1 H) og fluor ( 19 F) MR, en følsom, sikker metode uten ioniserende stråling 13,14.
Protocol
Representative Results
Discussion
Syntesen av CA-Lys-TFA og CA-Sar-TFMA og den in vitro-analyse av deres transport ved hjelp av stabilt transfekterte Madin-Darby hundenyreceller som uttrykker ASBT og humane embryoniske nyreceller som uttrykker natrium / taurocholat ko-transporterende polypeptid (NTCP) er beskrevet andre steder 13,14. Her er det fokus på peroral administrasjon av MFBA med sonde til levende dyr, etterfulgt av høsting av galleblæren, leveren, og blod for analyse av MFBA innhold, og, spesielt, bildebehandling MFBA i g…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av National Institutes of Health, National Institute of Diabetes og Digestive og nyre sykdommer (tilskudds tall R21 DK093406 og T32 DK067872 til JP.R.) og en VA Merit award (tilskudd nummer 1BX002129 til JP.R.).
Materials
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 X 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg / ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
Referências
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).

