Använda Multi-fluorerade gallsyror och<em> In Vivo</em> Magnetic Resonance Imaging att mäta gallsyratransporten
Summary
Verktyg för att diagnostisera gallsyremalabsorption och mäta gallsyratransporten in vivo är begränsade. En innovativ strategi i levande djur beskrivs som utnyttjar kombinerad proton (1H) plus fluor (19 F) magnetisk resonanstomografi; denna nya metod har translationell potential att screena för gallsyremalabsorption i klinisk praxis.
Abstract
Tillsammans med sin traditionella roll som rengöringsmedel som underlättar fettupptag, tillväxt litteratur visar att gallsyror är potenta signalmolekyler som påverkar flera organ; de modulera tarmmotilitet och hormonproduktion, och ändra kärltonus, glukosmetabolism, lipidmetabolism, och energiutnyttjande. Förändringar i fekala gallsyror kan förändra tarmen microbiome och främja kolon patologi inklusive cholerrheic diarré och koloncancer. Nyckelregulatorer av fekal gallsyra sammansättning är tunntarmens Apikal natriumberoende Bile Acid Transporter (ASBT) och fibroblasttillväxtfaktor-19 (FGF19). Minskad uttryck och funktion ASBT minskar intestinal gallsyror upptagning. Dessutom in vitro-data tyder på att vissa FDA-godkända läkemedel hämmar ASBT funktion. Bristfällig FGF19 frisättning ökar lever gallsyrasyntes och släppa in tarmarna till nivåer som överväldiga ASBT. Antingen ASBT dysfunktion eller FGF19 brist ökar feCAL gallsyror och kan orsaka kronisk diarré och främja kolon neoplasi. Tyvärr, till verktyg mäta gallsyremalabsorption och åtgärder av läkemedel på gallsyratransporten in vivo är begränsade. För att förstå de komplexa åtgärder av gallsyror är tekniker krävs att medge samtidig övervakning av gallsyror i tarmen och metaboliska vävnader. Detta fick oss att tänka sig en innovativ metod för att mäta gallsyratransport med levande djur med användning av en kombination av proton (1 H) och fluor (19 F) magnetisk resonanstomografi (MRI). Nya spårämnen för produktion av fluor (19 F) -baserade levande djur MRI skapades och testades, både in vitro och in vivo. Styrkor med denna strategi är bristen på exponering för joniserande strålning och translationell potential för klinisk forskning och praktik.
Introduction
Tillsammans med sin klassiska roll som rengöringsmedel som underlättar fettupptag från tarmen har gallsyror dykt upp som starka signalmolekyler som påverkar flera organ utöver dem som förknippas med deras enterohepatiska kretsloppet 1,2. Förutom att styra sin egen metabolism, gallsyror modulera flera aspekter av gastrointestinalfysiologi (t.ex. tarmmotilitet och inkretinhormon produktion, kolon fysiologi, och cancerbenägenhet) och har systemiska effekter på kärltonus, glukos och lipidmetabolism, och energiutnyttjande. Medan vissa av dessa effekter förmedlas i tarmen, andra beror på postprandial förändringar i system galla syranivåer, som noterades hos överviktiga patienter eller efter gastric bypass-kirurgi. Att belysa de komplexa metaboliska verkningarna av gallsyror ny teknik krävs att medger samtidig övervakning av galla syranivåerna i olika anatomiska fack, i mag-tarmkanalen och metaBolic vävnader (lever, pankreas, skelettmuskel och adipösa). Erhålla sådan tids och geografisk information kräver innovativ teknik – in vivo imaging med nya gallsyrabindande spårämnen som beskrivs här är en sådan ny metod.
Galla syresammansättning och fördelning i anatomiska fack regleras av faktorer som modulerar deras lever syntes och ileal upptag, inklusive kost, kirurgi, antibiotika och förändringar i tarmfloran. En viktig regulator av intestinal gallsyror upptag för deras enterohepatisk cirkulation 3 (figur 1) är den ileal Apikal natriumberoende Bile Acid Transporter (ASBT, SLC10A2). Även passiv absorption förekommer i hela tarmen, ASBT förmedlar upptag av 95% av tarm gallsyror, så att normalt finns begränsad spill av gallsyror i avföringen. Asbt fattiga (Slc10a2 – / -) möss har ökat fekal gallsyror och en minskad galla acid pool 4.
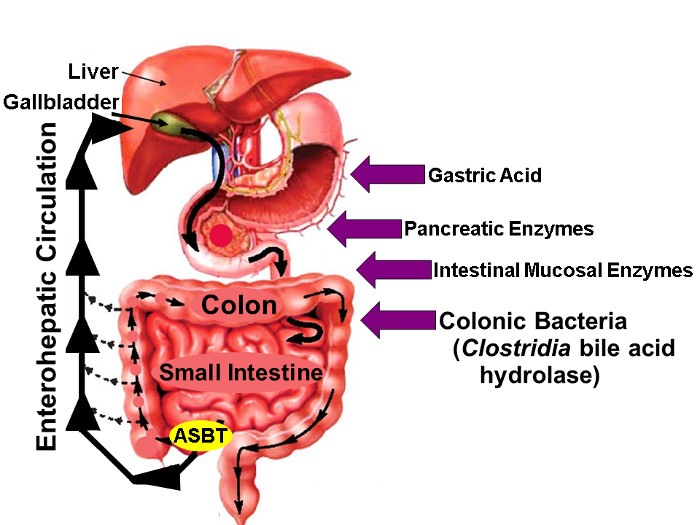
Figur 1: enterohepatiska kretsloppet av gallsyror.
Illustration av enterohepatisk cirkulation där gallsyror syntetiseras i levern, utsöndras i gallan träd, lagras i gallblåsan, släpps ut i proximala tunntarmen med måltider, och aktivt tagit upp via ASBT i krumtarmen. Medan små mängder av gallsyrorna absorberas passivt genom hela tarmen, ligger ungefär 95% av tarm gallsyror transporteras aktivt genom ASBT vilket resulterar i minimal (ca 5%) förlust i avföringen vilket kompenseras av en liknande mängd ny gallsyrasyntesen i levern, och därigenom bibehålla en steady-state gallsyrepoolen. Pilarna till höger identifiera faktorer som kan påverka infödda och fluor-märkt galla syrastabilitet, inklusive magsyra, bukspottkörtel och tarmslemhinnans enzymer, och de flesta importantly, hydrolytiska enzymer släpptes av Clostridium arter som koloniserar den distala tunntarmen och tjocktarmen. (Ändrad med tillstånd 16) Klicka här för att se en större version av denna siffra.
Gallsyremalabsorption kan kategoriseras i tre typer, vilka var och en ökar fekal dihydroxi gallsyror och därigenom orsakar intermittent eller kronisk diarré. Skriv 1 resultat från brutto ileal patologi (t.ex. resektion, Crohns sjukdom) 5. Skriv 3 resultat från kolecystektomi, Vagotomy, celiaki, bakteriell överväxt och pankreasinsufficiens. I motsats, personer med "primär" (typ 2) gallsyremalabsorption utgör en formidabel diagnostisk utmaning eftersom de saknar sådana antecedent förhållanden och inte har bevis för patologi i ileum. Därför primär gallsyremalabsorption allmänt misdiagnosed som diarré-predominant irritabel tarm (IBS-D), kanske den vanligaste orsaken till gastroenterologi relaterade öppenvårdsbesök. Det har uppskattats att en tredjedel av patienterna med IBS-D har primär gallsyremalabsorption; i USA, kan detta representera flera miljoner personer 5. Nya insikter visar att primär BAM härrör från nedsatt återkoppling hämning av lever gallsyrasyntesen genom tarm fibroblasttillväxtfaktor-19 (FGF19), inte från minskat uttryck eller funktion ASBT.
Vid primär gallsyremalabsorption, låga plasmanivåer av FGF19 misslyckas att stänga lever gallsyrasyntes – den resulterande ökningen av tarm gallsyror mättar gallsyror transportörer, inklusive ASBT och förstärkt spill av gallsyror i avföringen orsakar diarré 6 (Figur 2). Möss som saknar Fgf15 (murin FGF19) har en utökad gallsyrapoolen och ökad fekal gallsyror 7.
<p class= "Jove_content">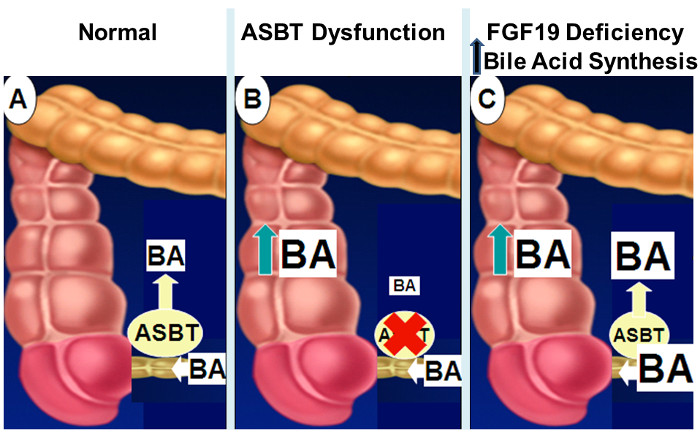
Figur 2: Mekanismer för Intestinal gallsyremalabsorption.
Normalt som visas i panel A, är cirka 95% av tarm gallsyror absorberas genom aktiv transport i distala ileum via ASBT. När ASBT uttryck eller aktivitet minskar (panel B), osäkra tarm gallsyra upptagsresulterar i spill av gallsyror i tjocktarmen. Med nedsatt FGF19 signalering (panel C), avsaknaden av återkoppling hämning av lever gallsyrasyntes resulterar i ökade koncentrationer av tarm gallsyror som överväldiga ASBT transportkapacitet med spill av gallsyror i tjocktarmen. Klicka här för att se en större version av denna siffra.
Långsiktig, kronisk förhöjning av fekal galla acids kan främja kolon neoplasi. Kolon neoplasi härrör från progressiv mucosal dysplasi i samband med somatiska genmutationer, men miljöfaktorer som ökar fekala gallsyror kan påskynda och förstärker denna process. Hos gnagare ökade fekala gallsyror antingen som en följd av exogen administration eller Asbt brist främjar kolon dysplasi och tumörbildning 8-10.
Noterbart är provocerande fynd tyder på att ofta använda läkemedel som godkänts av Food and Drug Administration (FDA) hämmar potent gallsyratransporten av ASBT in vitro 11. Om dessa läkemedel minska tunntarms gallsyratransporten in vivo och öka fekal gallsyra-nivåer, skulle den potentiella inverkan på kolon patologi vara oroande. Även en liten ökning av kolon patologi tillskrivas användningen av ett sådant läkemedel skulle kunna ha en stor inverkan på hälsan. En verktygslåda som kan bedöma rimligheten i dessa in vitro fynd och epidemiologisk observa skulle sporra ytterligare forskning, inklusive efter marknadssäkerhetsstudier.
Trots behovet praktiska analyser identifiera personer med gallsyremalabsorption saknas. Direkt mätning av fekal gallsyror avvisades år sedan som besvärliga, opraktiska och opålitlig 5. Alternativa metoder innefattar mätning av bibehållande av en radioaktiv selen-märkt cholsyra derivat (75 SeHCAT) och plasmanivåer av 7α-hydroxy-4-kolesten-3-en (C4), eller ett terapeutiskt prov av gallsyrabindare. 75 SeHCAT testning har begränsad tillgänglighet i Europa och är inte FDA-godkända eller tillgänglig för användning i USA även måttlig exponering för strålning (0,26 mSv / 75 SeHCAT test) från diagnostiska tester väcker oro, och bakteriell överväxt och avancerad leversjukdom kan förväxla 75 SeHCAT resultat. C4 testning är potentiellt attraktiv eftersom endast plasma krävs, men det har låg positivt prediktiva value och testning är inte allmänt tillgängliga. Mäta serumnivåer av FGF19 har liknande begränsningar. Vanliga kliniker tillgripa en terapeutisk prövning av gallsyrabindare, men detta tillvägagångssätt kan inte ge en definitiv diagnos av gallsyremalabsorption 5.
Av dessa skäl har en ny MR metod tänkt att mäta gallsyratransporten och distribution in vivo med hjälp av innovativa fler fluorerade gallsyror (MFBA-MRI). MFBA innehållande tre atomer av fluor (19 F), en stabil isotop av 100% naturligt överflöd, transporteras på samma sätt som nativa gallsyror 12, och kan användas för att visualisera gallsyratransport med en kombination av proton (1 H) och fluor ( 19 F) MRI, en känslig, säker metod utan joniserande strålning 13,14.
Protocol
Representative Results
Discussion
Syntesen av CA-lys-TFA och CA-sar-TFMA och analysen in vitro av deras transport med användning av stabilt transfekterade Madin-Darby Canine Kidney-celler som uttrycker ASBT och humana embryonala njurceller som uttrycker den natrium / taurokolat sam-transporterande polypeptid (NTCP) beskrivs någon annanstans 13,14. Här ligger fokus på oral administrering av MFBA genom sondmatning levande djur, följt av skörd av gallblåsan, lever och blod för analys av MFBA innehåll, och, framför allt, avbild…
Declarações
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av National Institutes of Health, National Institute of Diabetes and Digestive och Kidneysjukdomar (bidragsnummer R21 DK093406 och T32 DK067872 till JP.R.) och en VA Merit tilldelning (licensnummer 1BX002129 till JP.R.).
Materials
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 X 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg / ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
Referências
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).

