Измерение Распределение частиц по размерам в мутных растворах с помощью динамического рассеяния света микроскопии
Summary
Протокол для прямого измерения распределения частиц по размерам в концентрированных растворах с использованием динамического рассеяния света микроскопии представлена.
Abstract
A protocol for measuring polydispersity of concentrated polymer solutions using dynamic light scattering is described. Dynamic light scattering is a technique used to measure the size distribution of polymer solutions or colloidal particles. Although this technique is widely used for the assessment of polymer solutions, it is difficult to measure the particle size in concentrated solutions due to the multiple scattering effect or strong light absorption. Therefore, the concentrated solutions should be diluted before measurement. Implementation of the confocal optical component in a dynamic light scattering microscope1 helps to overcome this barrier. Using such a microscopic system, both transparent and turbid systems can be analyzed under the same experimental setup without a dilution. As a representative example, a size distribution measurement of a temperature-responsive polymer solution was performed. The sizes of the polymer chains in an aqueous solution were several tens of nanometers at a temperature below the lower critical solution temperature (LCST). In contrast, the sizes increased to more than 1.0 µm when above the LCST. This result is consistent with the observation that the solution turned turbid above the LCST.
Introduction
Particle size is one of the most fundamental properties of colloidal and polymer solutions. Numerous techniques are used to measure the particle size. Particle sizes of 1.0 µm or larger can be measured directly using an optical microscope. For smaller particles, alternative techniques, such as laser diffraction, electron microscopy, or atomic force microscopy, are used2,3. Dynamic light scattering is a commonly-used technique for the measurement of particle size distributions in solutions4. The results obtained using this technique are not derived from images of the particles but from the characteristic time of the fluctuations in scattered light intensity. These fluctuations originate from Brownian motion, which is characterized by a diffusion constant. The size distribution is obtained from the distribution of diffusion constants using the Einstein-Stokes equation. Due to its simplicity, dynamic light scattering is widely used for the routine assessment of solutions, such as paints and food colloids.
Pretreatment is required for most of the techniques used for the particle size measurement of solution samples. In the case of electron microscopy and atomic force microscopy, the sample must be analyzed under vacuum conditions. Therefore, it is difficult to observe the samples in their native forms. Furthermore, for laser diffraction and dynamic light scattering, only diluted samples that are free from multiple scattering and light absorption can be measured. To overcome this difficulty, several new techniques have been proposed for the measurement of dynamic light scattering from undiluted, concentrated solutions, such as cross-correlation spectroscopy5,6, low-coherence dynamic light scattering7,8, diffusing-wave spectroscopy9,10, and differential dynamic microscopy11,12.
We have developed a new apparatus called a dynamic light scattering microscope1. This apparatus enables us to measure turbid samples without dilution by means of a confocal optical system in which multiple scattering is eliminated using a pinhole. However, the measurement procedure and data analysis are slightly more complicated than those of commercially-available instruments. This video explains the measurement procedure and data analysis in detail using the analysis of the temperature-responsive polymer, poly(N-isopropylacrylamide), as an example.
Protocol
Representative Results
Discussion
Начальная амплитуда временной корреляционной функции в значительной степени зависит от фокальной точки, как показано на рисунке 2 (а). Это , казалось бы , противоречит тому , что раствор однороден (для тонкого слоя на границе раздела фаз , за исключением) 8. Это изменение в начальной амплитуды объясняется изменением количества отраженного света. Частичная теория гетеродина 16 предсказывает , что начальная амплитуда, А, рассеянный свет интенсивности, я с, и интенсивность отраженного света, я г, удовлетворяют следующему уравнению 1
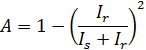
Это уравнение показывает , что чем больше я г становится, тем меньше А становится. Таким образом, А снижается путем установки фокальное положение , близком к интерфейсу. Кажущаяся константа диффузии D A чап быть получена путем подгонки временной корреляционной функции в случае монодисперсных решений:
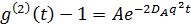
где 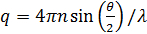 , Здесь п показатель преломления растворителя (воды, 1,33), θ является рассеянное угол (180 °), и λ является длина волны света (514,5 нм). Так как мы использовали геометрия рассеяния, значение Q фиксируется. Тем не менее, эта точка решается с использованием различных длин волн света. Пожалуйста, обратите внимание, что любой вид лазерного источника непрерывного излучения можно построить DLS микроскоп. Благодаря небольшому объему облучаемой, коэффициент 17 когерентности, по оценкам, более чем 0,99 и незначительна. Для полидисперсных растворов, функция распределения D А получается с помощью обратного преобразования Лапласа. Частичные гетеродинный йeory также предсказывает , что D A не совпадает с фактической константы диффузии D. Эти две константы диффузии удовлетворяют следующему уравнению:
, Здесь п показатель преломления растворителя (воды, 1,33), θ является рассеянное угол (180 °), и λ является длина волны света (514,5 нм). Так как мы использовали геометрия рассеяния, значение Q фиксируется. Тем не менее, эта точка решается с использованием различных длин волн света. Пожалуйста, обратите внимание, что любой вид лазерного источника непрерывного излучения можно построить DLS микроскоп. Благодаря небольшому объему облучаемой, коэффициент 17 когерентности, по оценкам, более чем 0,99 и незначительна. Для полидисперсных растворов, функция распределения D А получается с помощью обратного преобразования Лапласа. Частичные гетеродинный йeory также предсказывает , что D A не совпадает с фактической константы диффузии D. Эти две константы диффузии удовлетворяют следующему уравнению:
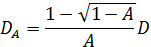
Константа диффузии D превращается в гидродинамический радиус R H , используя уравнение Эйнштейна-Стокса 4. При А = 1, эта зависимость становится D A = D. В этом случае, процесс преобразования данных является такой же, как для общего динамического рассеяния света. Красная линия показано на рисунке 2 (б) соответствует этому случаю. В противоположность этому , эта связь становится D A = 0,5 D в пределе → 0. Таким образом, размер, по оценкам, в два раза больше фактического размера , когда А мало (практически, менее чем 0,2), как показано в синяя линия на рис 2 (б) </sЧонг>. Если мы знаем , что значительно мала, горизонтальная ось может быть смещена, как показано на рисунке 2 (с). В принципе, мы можем преобразовать D A в D для любого значения A. На практике, однако, лучше , чтобы установить начальные амплитуда меньше , чем 0,2, так как простое приближение D A ~ 0,5 D справедливо.
Видные особенности динамического светового микроскопа методом рассеяния были продемонстрированы с использованием раствора PNIPA. Конформации PNIPA ниже и выше НКТР была тщательно изучена с помощью малоуглового рассеяния нейтронов 15,18. В противоположность этому , динамическое рассеяние света не был использован для анализа PNIPA выше НКТР из – за его помутнению 19. Эта задача решается с помощью динамического рассеяния света микроскопа, как показано на рисунках 3 (а) и (б). Размер этих агрегатов составляет несколько &# 181; м, которые не могут быть получены либо малоуглового рентгеновского рассеяния нейтронов / или обычными методами светорассеяния. С временным разрешением измерений с использованием этой системы дают информацию о процессе агрегации при изменении температуры.
Недостатком динамического рассеяния света микроскопа также показано на рисунке 3. Для получения результата ниже НКТР, корреляционная функция времени сильно зависит от очень небольшого количества пыли настоящее время (черные линии на рисунке 3). Например, корреляционная функция времени не затухает полностью, даже с временами корреляции в порядке 1,0 с. Это происходит потому, что объем облучаются этим аппаратом (приблизительно 1,0 мкм), значительно меньше, чем у облученного с обычным динамическим устройством рассеяния света (приблизительно 100 мкм). В тех случаях, когда интенсивность рассеянного света слабый, сигнал затемняется шума, вызванного, например, с помощью Sмола количества пыли в растворе. Таким образом, три пика , показанные на рисунке 3 (б) не может иметь количественное значение , хотя общий порядок размера имеет смысл. Следует отметить, что такой слабый рассеиватель может быть измерена с помощью обычного динамического светорассеяния аппарата.
Мы показали, что динамическое рассеяние света микроскоп позволяет нам измерять как прозрачные, так и мутные образцы с такой же установкой. Поскольку длина оптического пути в образцах короток, этот метод может быть применен к сильным поглощающих свет образцов, таких как углеродных нанотрубок 20 суспензий. Кроме того, в связи с его высоким пространственным разрешением, этот метод может быть применен к биологическим клеткам. Для его применения к биологии, этот метод также можно комбинировать с другими методами визуализации, такими как флуоресценция и обработки изображений комбинационного рассеяния. Таким образом, мы считаем, что динамическое рассеяние света микроскоп является мощным инструментом для широкого круга научных направлений.
Declarações
The authors have nothing to disclose.
Acknowledgements
This work has been financially supported by Grants-in-Aid for Scientific Research from the Ministry of Education, Culture, Sports, Science, and Technology (No. 25248027 to M.S.).
Materials
| N-isopropylacrylamide, 98% | Tokyo Chemical Industry Co., Ltd. | I0401 | |
| toluene, 99% | Wako Pure Chemical Industries, Ltd. | 201-01876 | |
| petroleum ether, distillation temperature 30 ~ 60 °C | Wako Pure Chemical Industries, Ltd. | 169-22565 | |
| N,N,N',N'-tetramethylethylenediamine, 99% | Sigma | T9281 | |
| ammonium persulfate, 98% | Sigma | 248614 | |
| polystyrene latex suspension, 1 wt% | Duke Scientific Corporation | 3500A | |
| argon | Koike Sanso Kogyo Co., Ltd. | purity > 99.999 vol.% | |
| cavity slide | Matsunami Glass Ind.,Ltd. | 83-0336 | |
| inverted microscope | Nikon Instech Co., Ltd. | ECLIPSE Ti-U | |
| Thermo Plate | Tokai Hit CO.,Ltd | TP-108R-C | |
| Ar-Kr ion laser | Spectra-Physics | Stabilite 2018 | |
| avalanche photodiode | ALV-GmbH | ALV-High Q.E. Avalanche Photo Diode | |
| correlator | ALV-GmbH | ALV-5000/EPP |
Referências
- Hiroi, T., Shibayama, M. Dynamic Light Scattering Microscope: Accessing Opaque Samples with High Spatial Resolution. Opt. Express. 21, 20260-20267 (2013).
- Barth, H. G., Flippen, R. B. Particle Size Analysis. Anal. Chem. 67, 257-272 (1995).
- Liu, Y., Wang, Z., Zhang, X. Characterization of supramolecular polymers. Chem. Soc. Rev. 41, 5922-5932 (2012).
- Berne, B. J., Pecora, R. . Dynamic Light Scattering with Applications to Chemistry, Biology and Physics. , (2000).
- Phillies, G. D. J. Experimental demonstration of ruultiple-scattering suppression in quasielastic-light-scattering spectroscopy by homodyne coincidence techniques. Phys. Rev. A. 24, 1939-1943 (1981).
- Phillies, G. D. J. Suppression of multiple scattering effects in quasielastic light scattering by homodyne crosscorrelation techniques. J. Chem. Phys. 74, 260-262 (1981).
- Ishii, K., Yoshida, R., Iwai, T. Single-scattering spectroscopy for extremely dense colloidal suspensions by use of a low-coherence interferometer. Opt. Lett. 30, 555-557 (2005).
- Xia, H., Ishi, K., Iwai, T. Hydrodynamic Radius Sizing of Nanoparticles in Dense Polydisperse Media by Low-Coherence Dynamic Light Scattering. Jpn. J. Appl. Phys. 44, 6261-6264 (2005).
- Maret, G., Wolf, P. E. Multiple light scattering from disordered media. The effect of brownian motion of scatterers. Z. Phys. B. 65, 409-413 (1987).
- Pine, D. J., Weitz, D. A., Chaikin, P. M., Herbolzheimer, E. Diffusing wave spectroscopy. Phys. Rev. Lett. 60, 1134-1137 (1988).
- Cerbino, R., Trappe, V. Differential Dynamic Microscopy: ProbingWave Vector Dependent Dynamics with a Microscope. Phys. Rev. Lett. 108, 188102 (2012).
- Lu, P. J., et al. Characterizing Concentrated, Multiply Scattering, and Actively Driven Fluorescent Systems with Confocal Differential Dynamic Microscopy. Phys. Rev. Lett. 108, 218103 (2012).
- Provencher, S. W. A constrained regularization method for investing data represented by linear algebraic or integral equations. Comp. Phys. Comm. 27, 213-227 (1982).
- Provencher, S. W., Stepanek, P. Global analysis of dynamic light scattering autocorrelation functions. Part. Part. Syst. Charact. 13, 291 (1996).
- Takata, S., Norisuye, T., Shibayama, M. Small-angle Neutron Scattering Study on Preparation Temperature Dependence of Thermosensitive Gels. Macromolecules. 35, 4779-4784 (2002).
- Pusey, P. N., van Megen, W. Dynamic Light Scattering by Non-Ergodic Media. Physica A. 157, 705-741 (1989).
- Chu, B. . Laser Light Scattering. 2nd Ed. , (1991).
- Shibayama, M., Tanaka, T., Han, C. C. Small-Angle Neutron-Scattering Study on Poly(N-Isopropyl Acrylamide) Gels near Their Volume-Phase Transition-Temperature. J. Chem. Phys. 97, 6829-6841 (1992).
- Tanaka, T., Sato, E., Hirokawa, Y., Hirotsu, S., Peetermans, J. Critical Kinetics of Volume Phase Transition of Gels. Phys. Rev. Lett. 55, 2455-2458 (1985).
- Hiroi, T., Ata, S., Shibayama, M. Transitions of Aggregation States for Concentrated Carbon Nanotube Dispersion. J. Phys. Chem. C. 120, 5776-5782 (2016).

