Múltiples pasos Fotolitografia variable Altura de múltiples capas con válvula dispositivos de microfluidos
Summary
Multilayer microfluidic devices often involve the fabrication of master molds with complex geometries for functionality. This article presents a complete protocol for multi-step photolithography with valves and variable height features tunable to any application. As a demonstration, we fabricate a microfluidic droplet generator capable of producing hydrogel beads.
Abstract
Microfluidic systems have enabled powerful new approaches to high-throughput biochemical and biological analysis. However, there remains a barrier to entry for non-specialists who would benefit greatly from the ability to develop their own microfluidic devices to address research questions. Particularly lacking has been the open dissemination of protocols related to photolithography, a key step in the development of a replica mold for the manufacture of polydimethylsiloxane (PDMS) devices. While the fabrication of single height silicon masters has been explored extensively in literature, fabrication steps for more complicated photolithography features necessary for many interesting device functionalities (such as feature rounding to make valve structures, multi-height single-mold patterning, or high aspect ratio definition) are often not explicitly outlined.
Here, we provide a complete protocol for making multilayer microfluidic devices with valves and complex multi-height geometries, tunable for any application. These fabrication procedures are presented in the context of a microfluidic hydrogel bead synthesizer and demonstrate the production of droplets containing polyethylene glycol (PEG diacrylate) and a photoinitiator that can be polymerized into solid beads. This protocol and accompanying discussion provide a foundation of design principles and fabrication methods that enables development of a wide variety of microfluidic devices. The details included here should allow non-specialists to design and fabricate novel devices, thereby bringing a host of recently developed technologies to their most exciting applications in biological laboratories.
Introduction
Durante los últimos 15 años, la microfluídica como campo ha experimentado un rápido crecimiento, con una explosión de nuevas tecnologías que permiten la manipulación de fluidos en la escala micrométrica 1. Sistemas microfluídicos son plataformas atractivas para la funcionalidad de laboratorio húmedo debido a que los pequeños volúmenes tienen el potencial de comprender el incremento de la velocidad y la sensibilidad mientras que al mismo tiempo aumentar de forma espectacular el rendimiento y reducir el costo mediante el aprovechamiento de las economías de escala 2, 3. Sistemas de microfluidos de capas múltiples han hecho impactos particularmente significativas en aplicaciones de análisis bioquímicos de alto rendimiento tales como el análisis sola célula 4, 5, 6, el análisis de una sola molécula (por ejemplo, digital PCR 7), la cristalografía de proteínas 8, ensayos de unión de factor de transcripciónf "> 9, 10, y el cribado celular 11.
Un objetivo central de la microfluídica ha sido el desarrollo de "laboratorio en un chip" dispositivos capaces de realizar manipulaciones de fluidos complejos dentro de un solo dispositivo para el análisis bioquímico total de 12. El desarrollo de técnicas de litografía blanda multicapa ha ayudado a conseguir este objetivo al permitir la creación de válvulas on-chip, mezcladoras y bombas para el control activo de los fluidos dentro de pequeños volúmenes 13, 14, 15. A pesar de sus ventajas y aplicaciones demostradas, muchas de estas tecnologías de microfluidos, siguen siendo ampliamente incontrolados que los usuarios no especializados. La adopción generalizada ha sido un desafío, en parte, debido al acceso limitado a las instalaciones de microfabricación, pero también debido a la falta de comunicación de las técnicas de fabricación. Esto es especialmente cierto for dispositivos de microfluidos de capas múltiples que ofrecen las estructuras de las válvulas o geometrías complejas: la escasez de información detallada y práctica acerca de los parámetros de diseño importantes y técnicas de fabricación a menudo hace que los nuevos investigadores de embarcarse en proyectos relacionados con el diseño y la creación de estos dispositivos.
Este artículo tiene como objetivo hacer frente a esta falta de conocimientos mediante la presentación de un protocolo completo para la fabricación de dispositivos de microfluidos de capas múltiples con válvulas y características de altura variable, a partir de los parámetros de diseño y moviéndose a través de todas las etapas de fabricación. Al centrarse en las etapas iniciales de la fabricación de fotolitografía, este protocolo complementa otros protocolos de microfluidos 16 que describen los pasos intermedios de fundición dispositivos de moldes y llevar a cabo experimentos específicos.
Los dispositivos microfluídicos con válvulas monolítico en el chip se componen de dos capas: una capa de "flujo", en el que el fluido de interés se manipula en microcanales, y una capa de "control", donde microcanales que contienen aire o agua pueden modular selectivamente el flujo de fluido en la capa de flujo 14. Estas dos capas se fabrican cada uno en un maestro de moldeo de silicio separado, que se utiliza a continuación para polidimetilsiloxano (PDMS) de moldeo de réplica en un proceso llamado "litografía blanda 17". Para formar un dispositivo de múltiples capas, cada una de las capas de PDMS son echados en sus respectivos maestros de moldeo y después se alinean entre sí, formando de este modo un dispositivo de PDMS compuesto con canales en cada capa. Las válvulas se forman en los lugares donde los canales de flujo y de control se cruzan entre sí y están separados por solamente una membrana fina; presurización del canal de control desvía esta membrana para ocluir el canal de flujo y desplazar localmente el fluido (Figura 1).
Activo válvulas en el chip pueden ser fabricados de varias maneras, dependiendo de la aplicación final deseada. válvulaspuede ser configurado, ya sea en una geometría de "empujar hacia abajo" o "empujar hacia arriba", dependiendo de si la capa de control está por encima o por debajo de la capa de flujo (Figura 1) 15. "Empuje hacia arriba" geometrías permiten presiones de cierre más bajos y mayor estabilidad dispositivo contra la deslaminación, mientras que "empuje hacia abajo" geometrías permiten los canales de flujo para estar en contacto directo con el sustrato adherido, que confiere la ventaja de funcionalización selectiva o patrón de la superficie del sustrato para una funcionalidad más tarde 18, 19.
Las válvulas también pueden ser de forma deliberada con fugas válvulas "tamiz" o completamente sellable, dependiendo del perfil de la sección transversal del canal de flujo. Válvulas Sieve son útiles para la captura de perlas, células u otros macroanalytes 1, y se fabrican mediante el uso de las resinas fotosensibles negativos típicos (es decir, SU-8 de la serie), que hacinco perfiles rectangulares. Cuando un canal de control se somete a presión sobre estas regiones de la válvula, la membrana de PDMS entre el control y la capa de flujo desvía isótropa en el perfil rectangular de la válvula sin el sellado de las esquinas, lo que permite el flujo de fluido pero atrapando las partículas de macro escala (Figura 1). Por el contrario, las válvulas de microfluidos totalmente herméticos se fabrican mediante la inclusión de un pequeño parche de resina fotosensible redondeada en lugares de válvula. Con esta geometría, la presurización del canal de control desvía la membrana contra la capa de flujo redondeada para sellar completamente el canal, deteniendo el flujo de fluido. Perfiles redondeados en la capa de flujo se generan a través de la fusión y el reflujo de fotoprotector positivo (por ejemplo, XT AZ50 o SPR 220) después de las etapas típicas de fotolitografía. Hemos demostrado anteriormente que las alturas de post-reflujo de las regiones de las válvulas dependen de las dimensiones de características elegidas 21. Este protocolo demuestra la fabricación de válvulas con ambas geometríasen un dispositivo de síntesis de perlas.
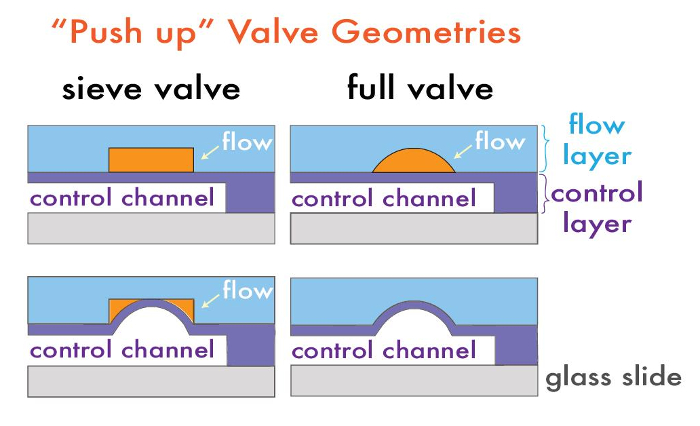
Figura 1: múltiples capas de microfluidos Válvula de geometrías. "empuja hacia arriba" arquitecturas de dispositivos típicos para la criba y válvulas totalmente herméticos antes y después de la presurización (arriba) (parte inferior). Haga clic aquí para ver una versión más grande de esta figura.
Los dispositivos también pueden incluir características pasivas complejas tales como mezcladores caóticos y 13 en el chip resistencias 20 que requieren características de múltiples alturas diferentes dentro de una sola capa de flujo. Para lograr una capa de flujo de altura variable, diferentes grupos han empleado muchos métodos que incluyen el grabado impresos del circuito 22, de múltiples capas PDMS alineación de alivio 23, o de múltiples pasos photolithography 24. Nuestro grupo ha encontrado multi-paso de fotolitografía en un único maestro de moldeo para ser un método eficaz y reproducible. Para ello, se emplea una simple técnica de fotolitografía de la construcción de canales de gruesos fotorresistente negativo (por ejemplo, SU-8 resinas fotosensibles de la serie) en las capas sin desarrollo en entre la aplicación de cada capa. Cada capa se hace girar en fotoprotector negativo de acuerdo a su espesor utilizando las instrucciones del fabricante 25 en el maestro de silicio. Las características de esta altura son luego modelada sobre la capa usando una máscara de transparencia específico (Figura 2) fijado a una placa de máscara de cristal y alineados a la capa previamente hilado antes de la exposición. En múltiples pasos fotolitografía, una alineación precisa entre las capas es fundamental en la formación de un canal de flujo completo de altura variable. Después de la alineación, cada capa se somete a una cocción posterior a la exposición espesor-dependiente. Sin el desarrollo, la siguiente capa es similarly modelado. De esta manera, las características de altura se pueden construir en una única oblea de flujo de la capa por capa a través del uso de múltiples máscaras. Omitiendo el desarrollo entre cada paso, las capas fotorresistentes anteriores se pueden utilizar para generar características de altura de material compuesto (es decir, dos capas 25 micras pueden hacer una función de 50 micras) 24. Además, las características del piso del canal, como ranuras de espiga mezclador caótico 13 se pueden hacer usando capas con características anteriormente expuestas. Un paso desarrollo final completa el proceso, la creación de una sola oblea de flujo con características de altura variable (Figura 3).
Aquí, se proporciona un protocolo completo para multi-paso de fotolitografía que incluye ejemplos de todos los procedimientos necesarios para la fabricación de válvulas en el chip y canales de flujo con múltiples alturas. Este protocolo de fabricación se presenta en el contexto de un sintetizador de microfluidos de talón de múltiples capas que requiere válvulas y variable-altura cuenta por su funcionalidad. Este dispositivo incluye uniones en T para la generación de gotitas de agua en una funda de aceite, resistencias en el chip para modular las tasas de flujo a través de controlar la resistencia a Poiseuille, un mezclador caótica para la homogeneización de los componentes de las gotitas, y ambas válvulas completamente sellado y de tamiz para permitir flujos de trabajo automatizados implican reactivo múltiple insumos. El uso de múltiples pasos de fotolitografía, estas características son cada fabricados en una capa diferente según la altura o resina fotosensible; las siguientes capas se construyen en este protocolo: (1) capa de la Ronda de flujo de la válvula (55 micras, AZ50 XT) (2) flujo de capa baja (55 micras, SU-8 2050) (3) Flujo de capa alta (85 m, SU- 8 2025, 30 m de altura aditivo), y (4) ranuras de espiga (125 micras, SU-8 2025, 40 m de altura aditivo) (Figura 3).
perlas de hidrogel se pueden utilizar para una variedad de aplicaciones, incluyendo la funcionalización selectiva de superficie para los ensayos de aguas abajo, la encapsulación de fármacos, radiotracing de imágenes y ensayos, y la incorporación de células; hemos utilizado anteriormente una versión más compleja de estos dispositivos para producir perlas de hidrogel de PEG espectralmente codificados que contienen lantánidos nanophosphors 20. Los diseños aquí descritos están incluidos en recursos adicionales para cualquier laboratorio para utilizar en sus esfuerzos de investigación si se desea. Anticipamos que este protocolo proporcionará un recurso abierto para los especialistas y no especialistas interesados en la fabricación de dispositivos de microfluidos de capas múltiples con válvulas o geometrías complejas para bajar la barrera de entrada en la microfluídica y aumentar las posibilidades de éxito de la fabricación.
Protocol
Representative Results
Discussion
Este trabajo demuestra un protocolo de fotolitografía completa de múltiples pasos para un dispositivo de microfluidos de capas múltiples con válvulas y la geometría de altura variable que puede ser ajustado para cualquier aplicación con simples modificaciones a los parámetros de fabricación en base a nuestra herramienta en línea 26 y 25 del fabricante instrucciones. Este protocolo está destinado a desmitificar la fotolitografía de múltiples capas para los inves…
Declarações
The authors have nothing to disclose.
Acknowledgements
The authors thank Scott Longwell for helpful comments and edits to the manuscript and Robert Puccinelli for device photography. The authors acknowledge generous support from a Beckman Institute Technology Development Grant. K.B. is supported by a NSF GFRP fellowship and the TLI component of the Stanford Clinical and Translational Science Award to Spectrum (NIH TL1 TR 001084); P.F. acknowledges a McCormick and Gabilan Faculty Fellowship.
Materials
| Materials | |||
| Mylar Transparency Masks, 5" | FineLine Plotting | ||
| 5" Quartz Plates | United Silica | Custom | |
| 4" Silicon Wafers, Test Grade | University Wafer | 452 | |
| SU8 2005, 2025, 2050 photoresist | Microchem | Y111045, Y111069, Y111072 | |
| Az50XT | Integrated Micromaterials | AZ50XT-Q | |
| SU8 Developer | Microchem | Y020100 | |
| AZ400K 1:3 Developer | Integrated Micromaterials | AZ400K1:3-CS | |
| Pyrex 150 mm glass dish | Sigma-Aldrich | CLS3140150-1EA | |
| Wafer Petri Dishes, 150 mm | VWR | 25384-326 | |
| Wafer Tweezers | Electron Microscopy Sciences (EMS) | 78410-2W | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane (PFOTS) | Sigma-Aldrich | 448931-10G | |
| 2" x 3" glass slides | Thomas Scientific | 6686K20 | |
| RTV 615 elastomeric base and curing agent PDMS set | Momentive | RTV615-1P | |
| Tygon Tubing, 0.02" O.D. | Fischer Scientific | 14-171-284 | |
| Capillary PEEK tubing, 510 um OD, 125 um ID | Zeus | Custom | 360 um PEEK is readily available by Idex (catalog number: 1571) |
| Cyro 4 mL tube | Greiner Bio-One | 127279 | |
| Epoxy, 30-minute | Permatex | 84107 | |
| Metal Pins, 0.025" OD, .013" ID | New England Small Tube | NE-1310-02 | |
| Poly(ethylene glycol) diacrylate, Mn 700 | Sigma-Aldrich | 455008-100ML | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate photoinitator | Tokyo Chemical Industry Co. | L0290 | We typically synthesize LAP in-house. |
| HEPES | Sigma-Aldrich | H4034-25G | |
| Light mineral oil | Sigma-Aldrich | 330779-1L | |
| Span-80 | Sigma-Aldrich | 85548 | |
| ABIL EM 90 | UPI Chem | 420095 | |
| Name | Company | Catalog Number | Comments |
| Equipment | Equivalent equiptment or homebuilt setups will work equally as well | ||
| Mask Aligner | Karl Suss | MA6 | |
| Profilometer | KLA-Tencor | Alpha-Step D500 | |
| Spin Coater | Laurell Technologies | WS-650-23 | Any spincoater can be used that accepts 100 mm wafers |
| Vacuum Dessicator, Bell-Jar Style | Bel-Art | 420100000 | |
| Oven | Cole-Palmer | WU-52120-02 | |
| UV Spot Curing System with 3 mm LLG option | Dymax | 41015 | UV LEDs, Xenon Arc Lamps, or other UV sources of the same intensity work equally as well |
| MFCS Microfluidic Fluid Control System | Fluidgent | MFCS-EZ | Syringe pumps, custom pneumatics or other control systems can also be used |
| Automated control scripting | MATLAB | ||
| Hotplate | Tory Pines Scientific | HP30 | Any hotplate with uniform heating (i.e. aluminum or ceramic plates) will suffice. |
Referências
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nat. Rev. Mol. Cell Bio. 16 (9), (2015).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev.Mod. Phys. 77 (3), (2005).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), (2006).
- Kalisky, T., Blainey, P., Quake, S. R. Genomic Analysis at the Single-Cell Level. Ann. Rev. of Genetics. 45 (1), (2011).
- Finkel, N. H., Lou, X., Wang, C., He, L. Peer Reviewed: Barcoding the Microworld. Anal. Chem. 76 (19), (2004).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr. Opin. in Chem. Bio. 16 (3-4), (2012).
- White, A. K., Heyries, K. A., Doolin, C., VanInsberghe, M., Hansen, C. L. High-Throughput Microfluidic Single-Cell Digital Polymerase Chain Reaction. Anal. Chem. 85 (15), (2013).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A Microfluidic Device for Kinetic Optimization of Protein Crystallization and In Situ Structure Determination. J. Am. Chem. Soc. 128 (10), (2006).
- Maerkl, S. J., Quake, S. R. A Systems Approach to Measuring the Binding Energy Landscapes of Transcription Factors. Science. 315 (5809), (2007).
- Fordyce, P. M., Gerber, D., et al. De novo identification and biophysical characterization of transcription-factor binding sites with microfluidic affinity analysis. Nat. Biotech. 28 (9), (2010).
- Fan, R., et al. Integrated barcode chips for rapid, multiplexed analysis of proteins in microliter quantities of blood. Nat. Biotech. 26 (12), (2008).
- Kovarik, M. L., Gach, P. C., Ornoff, D. M., Wang, Y. Micro total analysis systems for cell biology and biochemical assays. Anal. Chem. , (2011).
- Stroock, A. D., Dertinger, S. K. W., Ajdari, A., Mezić, I., Stone, H. A., Whitesides, G. M. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Unger, M. A., Chou, H. -. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science. 288 (5463), 113-116 (2000).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic Large-Scale Integration. Science. 298 (5593), (2002).
- Li, N., Sip, C., Folch, A. Microfluidic Chips Controlled with Elastomeric Microvalve Arrays. JoVE. (8), e296 (2007).
- Kim, P., et al. Soft lithography for microfluidics: a review. Biochip. J. 2 (1), 1-11 (2008).
- Studer, V., Hang, G., Pandolfi, A., Ortiz, M., Anderson, W. F., Quake, S. R. Scaling properties of a low-actuation pressure microfluidic valve. J. Appl. Phys. 95 (1), 393-398 (2004).
- Kartalov, E. P., Scherer, A., Quake, S. R., Taylor, C. R., Anderson, W. F. Experimentally validated quantitative linear model for the device physics of elastomeric microfluidic valves. J. Appl. Phys. 101 (6), 064505 (2007).
- Gerver, R. E., Gómez-Sjöberg, R., et al. Programmable microfluidic synthesis of spectrally encoded microspheres. Lab. Chip. 12 (22), 4716-4723 (2012).
- Fordyce, P. M., Diaz-Botia, C. A., DeRisi, J. L., Gómez-Sjöberg, R. Systematic characterization of feature dimensions and closing pressures for microfluidic valves produced via photoresist reflow. Lab. Chip. 12 (21), 4287-4295 (2012).
- Li, C. -. W., Cheung, C. N., Yang, J., Tzang, C. H., Yang, M. PDMS-based microfluidic device with multi-height structures fabricated by single-step photolithography using printed circuit board as masters. The Analyst. 128 (9), 1137-1142 (2003).
- Romanowsky, M. B., Abate, A. R., Rotem, A., Holtze, C., Weitz, D. A. High throughput production of single core double emulsions in a parallelized microfluidic device. Lab. Chip. 12 (4), 802-807 (2012).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. JMM. 16 (2), 276 (2006).
- . Rafael’s Microfluidics Site Available from: https://sites.google.com/site/rafaelsmicrofluidicspage/valve-controllers (2016)
- Wanat, S., Plass, R., Sison, E., Zhuang, H., Lu, P. -. H. Optimized Thick Film Processing for Bumping Layers. Proc. SPIE. , 1281-1288 (2003).

