Expressie van exogeen cytokine in patiënt afgeleide Xenografts via injectie met een cytokine-getransduceerde stromcellijn
Summary
Hier beschreven is een werkwijze voor het produceren van exogeen cytokine in patiënten afgeleide xenograftmuizen via wekelijkse intraperitoneale injectie van een cytokine-getransduceerde stromale cellijn. Deze methode verruimt het nut van PDX en biedt de mogelijkheid voor transiënte of langdurige exogene cytokine-afgifte in een groot aantal PDX-modellen.
Abstract
Patiëntgerelateerde xenograftmuizen (PDX) worden geproduceerd door transplantatie van menselijke cellen in immuun deficiënte muizen. Deze modellen zijn een belangrijk instrument voor het bestuderen van de mechanismen van normale en kwaadaardige hematopoiesis en zijn de gouden standaard voor het identificeren van effectieve chemotherapieën voor veel kwaadaardigheden. PDX-modellen zijn mogelijk omdat veel van de cytokines van de muis ook op menselijke cellen optreden. Dit geldt echter niet voor alle cytokinen, waaronder veel die kritiek zijn voor het bestuderen van normale en kwaadaardige hematopoiesis in menselijke cellen. Technieken die muizen ontwerpen om menselijke cytokinen te produceren (transgene en inklapmodellen) vereisen aanzienlijke kosten voordat het nut van het model is aangetoond. Andere technieken zijn arbeidsintensief (injectie van recombinant cytokine of lentivirus) en vereisen in sommige gevallen een hoog niveau van technische expertise (hydrodynamische injectie van DNA). Dit rapport beschrijft een eenvoudige methode voor het genereren van PDX-muizen die exogene humane cy hebbenTokine (TSLP, thymische stromale lymfopoietine) via de wekelijkse intraperitoneale injectie van stroma die zijn getransduceerd om deze cytokine te overexpressie. Gebruik van deze methode verschaft een in vivo bron van continue cytokine productie die fysiologische niveaus van circulerend humaan cytokine in de muis bereikt. Plasmaniveaus van menselijk cytokine kunnen worden gevarieerd op basis van het aantal geïnjecteerde stromalcellen, en de productie van cytokine kan op elk moment in het experiment worden geïnitieerd. Deze methode omvat ook cytokine-negatieve controlemuizen die op dezelfde wijze worden geproduceerd, maar door intraperitoneale injectie van stroma getransduceerd met een controle vector. We hebben eerder aangetoond dat leukemacellen die zijn geoogst uit TSLP-expressie PDX, in vergelijking met controle PDX een genuitdrukkingspatroon meer tonen dan het oorspronkelijke patiëntmonster. Samen vormen de cytokine-producerende en cytokine-negatieve PDX-muizen die door deze methode worden geproduceerd, een model systeem dat we succesvol hebben gebruikt om de studie te bestuderenRol van TSLP bij normale en kwaadaardige hematopoiesis.
Introduction
Patiëntgerelateerde xenografen (PDX) zijn een krachtig in vivo model voor het bestuderen van de productie van normale en kwaadaardige hematopoietische cellen in een 'native' zoogdieromgeving. Meestal worden PDX geproduceerd door injectie of transplantatie van menselijke cellen in immuun deficiënte muizen. De productie van PDX met behulp van normale humane hematopoietische stamcellen maakt in vivo studies mogelijk van normaal menselijk bloed en immuuncelontwikkeling. PDX geproduceerd uit leukemie of andere kankercellen maakt het mogelijk om oncogene mechanismen te bestuderen en effectieve therapieën te identificeren in het kader van het bereik van genetische landschappen en mutaties die aanwezig zijn in de menselijke populatie. 1 PDX is daarom de huidige gouden standaard voor translatie biomedisch onderzoek om effectieve therapieën te identificeren en een belangrijk instrument om mechanismen van kankerprogressie te begrijpen. PDX-modellen zijn een essentieel instrument om onderzoek naar gezondheidsverschillen in ziekten te voorkomen door specifieke Genetische letsels of een ziekte waarin de variaties van het genetische landschap van een patiënt aanzienlijk kunnen bijdragen tot oncogenese en behandelingsuitkomst.
Muis-menselijke PDX-modellen zijn mogelijk omdat veel muiscytokines hun menselijke analogen adequaat nabootsen bij het activeren van de cytokine-receptoren van menselijke cellen terwijl zij in de muis zijn. Interleukine-7 (IL-7) geeft bijvoorbeeld een kritisch signaal voor humane B-celontwikkeling. 2 In dit geval heeft muis IL-7 voldoende homologie met menselijke IL-7 dat het muse cytokine signaalwegen in humane B-celprecursoren stimuleert. 2 , 3 , 4 Dit is echter niet het geval voor thymische stromale lymfopoietine (TSLP), 5 , 6 die onder andere cytokinen (IL-3, granulocyt-macrofage kolonie stimulerende factor (GM-CSF), stamcelfactor (SCF) ,Ref "> 7 is belangrijk voor de productie van normale en kwaadaardige humane hematopoietische cellen. Wanneer muizen en menselijke cytokinen een lage homologie hebben, laten de muse cytokines hun respectieve receptoren niet op menselijke cellen activeren. Om dit obstakel te overwinnen is een aantal strategieën gebruikt Om expressie van humane cytokinen in PDX-muizen te manipuleren. Deze omvatten injectie van recombinante humane cytokinen, hydrodynamische injectie van DNA, lentivirale expressie, transgene expressie en knockin-genvervanging. 7 Dit rapport beschrijft een methode voor het manipuleren van PDX om menselijk cytokine te produceren via stromale Cytokine-afgifte ( Figuur 1 ).
In de hier getoonde werkwijze worden PDX-muizen ontworpen om het menselijke cytokine, TSLP uit te drukken of om te dienen als cytokine-negatieve controles. TSLP-expressie PDX worden bereikt door wekelijkse intraperitoneale injecties van stromale cellen die zijn getransduceerd om hoge niveaus van menselijke TSLP uit te drukken.Cytokine-negatieve PDX "control" muizen zijn op dezelfde manier ontworpen; Hoewel controle stroma worden getransduceerd met een controle vector. Deze methode behaalt normale fysiologische niveaus van menselijk TSLP in PDX-muizen die geïnjecteerd worden met de TSLP + stroma. Geen detecteerbare TSLP wordt waargenomen in PDX-muizen die de cytokine-negatieve stroma ontvangen. We hebben de menselijke stromal cellijn HS-27A geselecteerd voor onze studies omdat het robuust groeit in de cultuur en een zeer lage cytokineproductie toont die geen proliferatie van geïsoleerde stamcellen in coculturen ondersteunt. 8 Voor menselijke TSLP expressie werden stroma getransducteerd met een geavanceerde generatie zelfinactiverende lentivirale vector afgeleid van een eerder beschreven ruggengraat 9 en omvat het cPPT / cts-element en het post-transcriptie-regulatorisch element van de woodchuck hepatitis (WPRE) om transgene expressie te verhogen. Het menselijke TSLP-gen werd geconstrueerd in deze vector onder de controle van de verlengingsfactor-1(EF-1) alpha promotor om robuuste, constitutieve en lange termijn expressie te bereiken.
De techniek van dit human-cytokine versterkte PDX-model bestaat uit 4 hoofdstappen. Ten eerste worden getransformeerde stroma in vitro uitgebreid en beoordeeld door enzym-gekoppelde immunosorbentassay (ELISA) voor stabiele cytokineproductie op hoog niveau. Ten tweede wordt de activiteit van humaan cytokine geproduceerd door de getransduceerde stromacellen (en het ontbreken van cytokine-activiteit van controle stroma) geverifieerd met behulp van fosfostroomcytometrie. Cellijnen die bekend zijn om te reageren op cytokine van belang (in dit geval, TSLP) worden geïncubeerd met stromale cel supernatant en geanalyseerd voor cytokine geïnduceerde fosforylering. Ten derde worden muizen geïnjecteerd met getransduceerde humane stroma en dan wordt muisplasma per week beoordeeld door ELISA voor niveaus van menselijk cytokine. Vierde humane hematopoietische cellen worden getransplanteerd en de in vivo functionele effecten van het humane cytokine worden geëvalueerd op een bekend doel ( <em> Bijv. Celpopulatie).
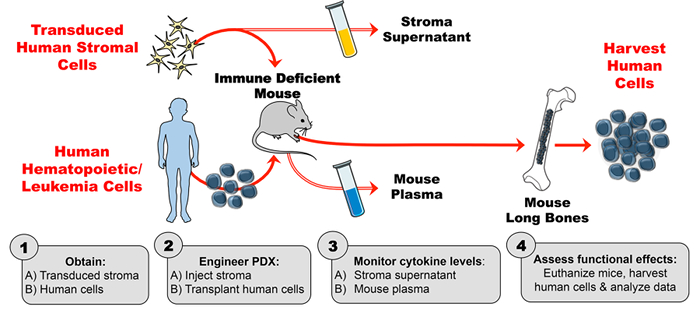
Figuur 1: PDX Model dat is ontworpen om exogene humane cytokine in muizen te produceren. ( 1A ) Ontwerp experiment en getransduceerde humane stromale cellen ( 1B ) verkrijgen. Verkrijg menselijke cellen (hematopoietische stamcellen, leukemacellen, enz .) Om PDX (patiënten afgeleide xenograft) muizen te genereren. ( 2A ) Injecteerde gemanipuleerde stroma en ( 2B ) transplantatie menselijke cellen in immuun deficiënte muizen volgens experimentele schema. ( 3A-B ) Monitor cytokine concentraties in het stroma supernatant en het muis plasma door ELISA. ( 4 ) Menselijke cellen van de oogst en analyseer de in vivo functionele effecten van het aanwezige humaan cytokine in de PDX. Klik hier alsjeblieftOm een grotere versie van deze figuur te zien.
Levering van menselijk cytokine via stromacellen biedt zowel voor- en nadelen als vergeleken met andere methoden voor het leveren / produceren van humane cytokinen in PDX-muizen. 7 In vergelijking met injectie van recombinant humaan cytokine is stroma-gemedieerde afgifte over het algemeen minder duur (de kosten van stromale celcultuur zijn minder dan de kosten van recombinant cytokine) en minder arbeidsintensief (één injectie per week versus meerdere injecties per week). De kwestie van korte halveringstijd van de cytokine wordt ook verminderd, aangezien stroma voortdurend de exogene cytokine produceert. Levering van cytokine via hydrodynamische injectie van DNA kan minder duur zijn dan afgifte via stroma. Het is evenwel ook voorbijgaande en kan meer technische vaardigheden vereisen dan de simpele wekelijkse intraperitoneale injectie die nodig is voor stroma-gemedieerde afgifte. Lentivirale genuitdrukking in de muis kan een minder traNsient methode van de levering van cytokine; In onze handen werden echter fysiologische TSLP niveaus niet bereikt. Bovendien is deze methode arbeidsintensief, waarbij de voortdurende productie van lentivirale vector vereist is. Transgene of knock-in muizen bieden stabiele langetermijnuitdrukking van cytokine en kunnen worden ontwikkeld voor weefselspecifieke expressie, die een voordeel kan zijn. Anderzijds vereist de transgene expressie van het humane cytokinegen op de immuun-deficiënte muisachtergrond die nodig is voor PDX-muizen een enorme investering van middelen voordat de waarde van het model is vastgesteld. Bovendien kunnen transgene modellen in het algemeen niet de mogelijkheid bieden om de timing van cytokine-initiatie of niveau van in vivo cytokineproductie te variëren. Deze kunnen worden bereikt met stroma-gemedieerde afgifte door gewoon het tijdstip te wijzigen voor het initiëren van stromale celinjectie of de dosis stromale cellen die geïnjecteerd zijn.
De stromale cel gemedieerde cytokine afgifte methOD gedetailleerde hier werd gebruikt om PDX te ontwikkelen voor het evalueren van de rol van TSLP bij normale humane B-celontwikkeling 4 , 6 en B-cel acute lymfoblastische leukemie met hoge risico's. 6 Deze methode verschaft een alternatieve cytokine-leveringsmethode voor gebruik bij het opwekken van vergelijkbare modellen met andere cytokinen dan TSLP. Dit model kan ook nuttig zijn voor het genereren van voorlopige gegevens die kunnen helpen bepalen of de waarde van een cytokine transgene of cytokine inklapbare PDX-model de aanzienlijke tijd en geld investering zou waard zijn.
Protocol
Representative Results
Discussion
Dit manuscript beschrijft een eenvoudige, snelle en relatief kosteneffectieve methode voor het ontwerpen van PDX om exogeen humaan cytokine uit te drukken. De hier beschreven strategie is gebaseerd op wekelijkse intraperitoneale injecties van een stromale cellijn die getransducteerd wordt om de menselijke cytokine, TSLP uit te drukken. Voordat de hier beschreven methoden werden uitgevoerd, werden stroma ontwikkeld om hoge niveaus van het cytokine van belang (TSLP) en soortgelijk gecontroleerde controle stroma uit te dru…
Declarações
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
Referências
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

