मूषक भ्रूणीय स्टेम कोशिकाओं में संरचना-समारोह अध्ययन Recombinase की मध्यस्थता कैसेट एक्सचेंज का उपयोग करना
Summary
प्रोटीन अक्सर एक से अधिक डोमेन है कि विभिन्न सेलुलर कार्यों लागू हो सकते हैं। जीन दस्तक बहिष्कार (KO) इस कार्यात्मक विविधता पर विचार नहीं करते। यहाँ, हम एक पुनर्संयोजन की मध्यस्थता कैसेट विनिमय (RMCE) को भ्रूण स्टेम कोशिकाओं में आधारित संरचना-समारोह दृष्टिकोण है कि विभिन्न कार्यात्मक डोमेन या एक प्रोटीन की वेरिएंट की आणविक विच्छेदन के लिए अनुमति देता है रिपोर्ट।
Abstract
माउस भ्रूण या भ्रूण स्टेम कोशिकाओं (mESCs) में जीन इंजीनियरिंग दिए गए प्रोटीन की कार्यप्रणाली के अध्ययन के लिए अनुमति देता है। प्रोटीन सेल के workhorses रहे हैं और अक्सर कई कार्यात्मक डोमेन, जो posttranslational संशोधनों से प्रभावित किया जा सकता है से मिलकर। सशर्त या संघटित नॉक आउट (KO) चूहों में पूरे प्रोटीन की कमी को ध्यान में यह कार्यात्मक विविधता और विनियमन नहीं लेता है। एक mESC लाइन और एक व्युत्पन्न माउस मॉडल, जिसमें FLPe पुनर्संयोजन की मध्यस्थता कैसेट विनिमय (RMCE) के लिए एक डॉकिंग साइट ROSA26 (R26) ठिकाना भीतर डाला गया था, पहले से सूचना मिली थी। यहाँ, हम एक संरचना-समारोह दृष्टिकोण है कि एक मल्टीडोमेन प्रोटीन के विभिन्न कार्यक्षमताओं की आणविक विच्छेदन के लिए अनुमति देता है पर रिपोर्ट। इस उद्देश्य के लिए RMCE संगत चूहों को चूहों के साथ पार किया जाना चाहिए और फिर RMCE-संगत को mESCs पृथक किया जाना चाहिए। इसके बाद, ख्यात बचाव निर्माणों के एक पैनल RMCE targeti के माध्यम से R26 ठिकाना में पेश किया जा सकता हैएनजी। उम्मीदवार बचाव cDNAs आसानी से पुनर्संयोजन क्लोनिंग का उपयोग कर को लक्षित वेक्टर के RMCE साइटों के बीच डाला जा सकता है। इसके बाद, KO mESCs एक FLPe recombinase अभिव्यक्ति प्लाज्मिड के साथ संयोजन में लक्षित वेक्टर साथ ट्रांसफ़ेक्ट कर रहे हैं। RMCE ROSA26 डॉकिंग साइटों में प्रमोटर कम neomycin प्रतिरोध जीन reactivates और सही लक्ष्य-निर्धारण घटना के चयन के लिए अनुमति देता है। इस तरह, 100% के करीब उच्च लक्ष्य-निर्धारण क्षमता प्राप्त कर रहे हैं, एक अर्द्ध उच्च throughput ढंग से कई ख्यात बचाव निर्माणों की प्रविष्टि के लिए अनुमति देता है। अंत में, R26 चालित बचाव निर्माणों की एक भीड़ फेनोटाइप कि माता पिता को mESCs में मनाया गया बचाव करने की क्षमता के लिए परीक्षण किया जा सकता है। हम P120 catenin (p120ctn) प्ररूपी रीडआउट रूप embryoid निकायों (EBS) में एण्डोडर्म भेदभाव का उपयोग कर KO mESCs में एक-का-प्रमाण सिद्धांत संरचना-समारोह अध्ययन प्रस्तुत करते हैं। यह दृष्टिकोण महत्वपूर्ण डोमेन की पहचान, ख्यात नीचे की ओर रास्ते, और रोग-प्रासंगिक बिंदु सक्षम बनाता हैम्यूटेशन कि किसी दिए गए प्रोटीन के लिए KO समलक्षणियों आबाद।
Introduction
यह अनुमान है कि स्तनधारी जीनोम लगभग 20,000 प्रोटीन कोडिंग जीन होते हैं। वैकल्पिक स्प्लिसिंग और posttranslational संशोधनों आगे प्रोटीन प्रदर्शनों की सूची में वृद्धि। प्रोटीन एक मॉड्यूलर संरचना 1 है और अक्सर कई अन्योन्य क्रिया डोमेन है, जो विभिन्न प्रोटीन परिसरों में उनकी भर्ती और कई कोशिकीय प्रक्रियाओं 2 में उनकी भागीदारी के लिए अनुमति देने के होते हैं। एक उदाहरण बहुआयामी प्रोटीन p120ctn कहा जाता है। p120ctn Ctnnd1 जीन द्वारा इनकोडिंग और एक बड़े केंद्रीय वर्मी दोहराने डोमेन एक एन टर्मिनल और एक सी टर्मिनल क्षेत्र से घिरे होते हैं है। p120ctn की वर्मी डोमेन शास्त्रीय cadherins, जो सेल कोशिका आसंजन में शामिल हैं की एक अत्यधिक संरक्षित juxtamembrane डोमेन को बांधता है, लेकिन यह भी ट्रांस्क्रिप्शनल repressor Kaiso को बांधता है। p120ctn के एन टर्मिनल डोमेन अलग kinases, फास्फेटेजों, छोटे RhoGTPases, और सूक्ष्मनलिका जुड़े पी के साथ सूचना का आदान प्रदानroteins 3। दिलचस्प बात यह है विकल्प स्प्लिसिंग का एक परिणाम के रूप में, p120ctn isoforms चार विकल्प शुरू कोडोन 4 से उत्पन्न किया जा सकता है। के रूप में यह सबसे -5 से अनुवाद किया है कोडोन शुरू 'और पूर्ण लंबाई एन टर्मिनल खंड शामिल p120ctn isoform 1 ए, सबसे लंबे समय तक है। p120ctn में isoforms 3 और 4, इस एन टर्मिनल खंड आंशिक रूप से और पूरी तरह से क्रमश: हटाया जाता है। प्रोटीन (या प्रोटीन isoforms) और उनके डोमेन अलग सेलुलर कार्यों में की सटीक भूमिका को समझना एक चुनौती बनी हुई है।
जीन mESCs में लक्षित इसी जीन की आनुवंशिक विलोपन के माध्यम से एक प्रोटीन की कार्यप्रणाली के अध्ययन के लिए सक्षम बनाता है और व्यापक रूप developmentally महत्वपूर्ण और रोग-प्रासंगिक जीन और रास्ते की पहचान करने के लिए योगदान दिया है। रिवर्स आनुवंशिकी में यह सफलता समरूप पुनर्संयोजन 5 की वजह से mESC अलगाव और जीन लक्ष्यीकरण के क्षेत्र में प्रगति का परिणाम था </s> ऊपर। समरूप पुनर्संयोजन एक प्रक्रिया है जिसमें डीएनए टुकड़े दोहरे धागे (डी एस) डीएनए टूट जाता है के बाद दो या समरूप न्यूक्लिक moieties के बीच आदान-प्रदान किया जाता है। क्योंकि dsDNA टूटता निराला हैं आम तौर पर, मानव संसाधन अक्षम है। हाल ही में, अनुरूपता निर्देशित जीन लक्ष्यीकरण की दक्षता साइट विशिष्ट न्युक्लिअसिज़ 6, 7 का उपयोग कर बढ़ाया जा सकता है, लेकिन दुर्भाग्य से, इन ऑफ-टारगेट प्रभाव 8 से ग्रस्त हैं। एक और अधिक विश्वसनीय तकनीक जीन लक्ष्यीकरण सक्षम करने के लिए RMCE है, जो साइट विशिष्ट ऐसे Cre / loxP या FLPe / Frt के रूप में पुनर्संयोजन सिस्टम पर आधारित है। LoxP और Frt अनुक्रम जीवाणुभोजी P1 में पाए जाते हैं और Saccharomyces cerevisiae, क्रमशः, और 34 बीपी की, एक असममित 8 बीपी अनुक्रम है कि साइट के उन्मुखीकरण का निर्धारण करता है सहित मिलकर बनता है। दूसरी ओर,, के उन्मुखीकरण उदाहरण के लिए, एक डीएनए खिंचाव के भीतर दो loxP साइटों का निर्धारण करेगा floxed डीएनए excised हो जाता है कि क्या है या मैंCre की मध्यस्थता पुनर्संयोजन 9 पर nversed। इसके अलावा, यह भी एक रचनात्मक अनुवादन पैदा कर सकते हैं, तो दो साइटों अलग गुणसूत्रों पर स्थित हैं। RMCE heterospecific पुनर्संयोजन साइटों को नहीं पार प्रतिक्रिया करते हैं और है कि एक जीनोमिक ठिकाना में एम्बेडेड रहे हैं का लाभ लेता है। एक दाता प्लाज्मिड कि एक ही heterospecific साइटों से घिरे एक डीएनए टुकड़ा होता है की उपस्थिति में, recombinase डबल एक साथ अनुवादन (चित्रा 1) की वजह से RMCE संगत जीनोमिक ठिकाना में इस डीएनए टुकड़ा डाल देंगे। इधर, केवल सही ढंग से RMCE-लक्षित क्लोन भेजे वेक्टर पर एक प्रमोटर कि पुनर्स्थापित करने के लिए दवा प्रतिरोध धन्यवाद प्रदान कर सकते हैं एक "फंस" प्रमोटर कम Neomycin प्रतिरोध जीन (नव आर) डॉकिंग कोशिकाओं के R26 जीनोम में मौजूद (चित्रा 1) 10, 11। यह एक बहुत ही उच्च लक्ष्य-निर्धारण दक्षता, अक्सर 100% 11 के करीब है, में जो परिणाम </ sup> 12। अंत में, RMCE-आधारित लक्ष्य अत्यधिक कुशल है और संरचना-कार्यों के अध्ययन के लिए इस्तेमाल किया जा सकता; तथापि, यह एक पूर्व इंजीनियर जीनोमिक ठिकाना की आवश्यकता है।
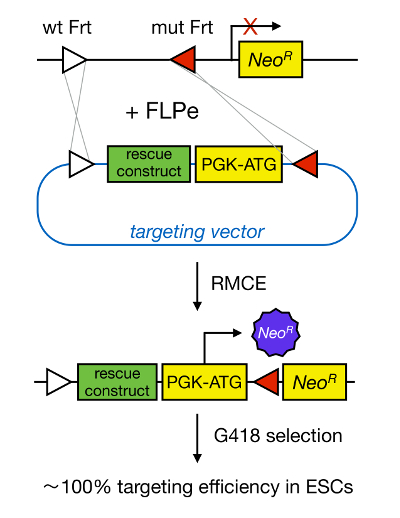
चित्र 1 RMCE की मध्यस्थता लक्ष्य निर्धारण के योजनाबद्ध प्रतिनिधित्व। अगर दोनों दो heterospecific Frt साइटों (सफेद और लाल त्रिकोण द्वारा दर्शाया) बंदरगाह RMCE एक परिभाषित जीनोमिक ठिकाना को भेजे को लक्षित वेक्टर से डीएनए क्षेत्रों के आदान प्रदान के लिए अनुमति देता है। इसके अलावा, इंजीनियर जीनोमिक ठिकाना एक promoterless और छोटा कर दिया neomycin प्रतिरोध (नव आर) जीन होता है। भेजे डीएनए टुकड़ा में एक प्रमोटर कोडोन प्रदान करने और शुरू से, केवल सही पुनर्संयोजन घटनाओं neomycin प्रतिरोध बहाल, उच्च लक्ष्य-निर्धारण क्षमता में जिसके परिणामस्वरूप। टी का एक बड़ा संस्करण देखने के लिए यहां क्लिक करेंउसके आंकड़ा।
mESCs में जीनोम इंजीनियरिंग RMCE संगत चूहों की पीढ़ी के लिए अनुमति देता है। 1981 में, दो समूहों ब्लास्टोसिस्ट की आंतरिक कोशिका द्रव्यमान (आईसीएम) से pluripotent कोशिकाओं पर कब्जा करने में और उन्हें संस्कृति 13, 14 में बनाए रखने में सफल रहा। mESCs भ्रूण और वयस्क कोशिकाओं के सभी प्रकार, जर्म सेल वंश सहित में आत्म नवीकरण और भेदभाव करने में सक्षम हैं। इसलिए, जीन mESCs में लक्षित संघटित या सशर्त (Cre / LoxP प्रणाली का उपयोग कर) को चूहों के विकास के माध्यम से रिवर्स आनुवंशिक अध्ययन सक्षम बनाता है। हालांकि, शास्त्रीय तरीका माउस ES कोशिकाओं को अलग करने के बहुत अक्षम है। कई प्रमुख सुधार बहुत पाने mESC लाइनों के लिए सफलता की दर में वृद्धि हुई है, एक परिभाषित सीरम बदलने (एसआर) मध्यम 15 के उपयोग सहित, mESC मध्यम के बीच अदल-एसआर और भ्रूण गोजातीय सीरम (एफबीएस) 16 युक्त, और फार्माको के उपयोगइस तरह के pluripotin या 2i 17 के रूप में तार्किक यौगिकों। Pluripotin, एक छोटे से सिंथेटिक अणु, ल्यूकेमिया निरोधात्मक कारक (LIF) और माउस भ्रूण fibroblasts (MEFs) 18 के अभाव में एक undifferentiated राज्य में mESCs के प्रसार के लिए अनुमति देता है। अंत में, यह दिखाया गया है कि mESCs एक बहुत ही उच्च दक्षता (100% के करीब) एक एसआर / एफबीएस मध्यम प्रत्यावर्तन प्रोटोकॉल, LIF के साथ और 19 pluripotin 20 संयुक्त है जब साथ अलग किया जा सकता। इन प्रोटोकॉल RMCE-संगत को mESCs कि बाद में संरचना-समारोह के अध्ययन के लिए इस्तेमाल किया जा सकता की कुशल अलगाव सक्षम करें।
इस पत्र के लिए एक विधि है कि एक एक प्रोटीन है कि विशिष्ट कोशिकीय प्रक्रियाओं के लिए जिम्मेदार हैं के भीतर प्रमुख डोमेन या अवशेषों की पहचान करने के लिए सक्षम बनाता है वर्णन करता है। इस उद्देश्य के लिए उन्नत प्रौद्योगिकियों कि कुशल mESC अलगाव सक्षम, को लक्षित वेक्टर विधानसभा, और mESC लक्ष्य-निर्धारण की एक पाइप लाइन बनाने थाघ। प्रोटीन isoforms, डोमेन उत्परिवर्ती, और नीचे की ओर प्रभावोत्पादक के साथ इस तरह, बड़े पैनल को mESCs में पेश किया जा सकता है और इन विट्रो KO phenotype बचाव करने की क्षमता के लिए मूल्यांकन किया जा सकता है।
Protocol
Representative Results
Discussion
हमारे mESC अलगाव विधि उपयोगकर्ता के अनुकूल है और इस तरह ब्लास्टोसिस्ट की microsurgery के रूप में उन्नत कौशल या उपकरण, की आवश्यकता नहीं है। इस प्रकार, इस तकनीक के वैज्ञानिक समुदाय का एक बड़ा हिस्सा के लिए सुलभ है। ?…
Declarações
The authors have nothing to disclose.
Acknowledgements
हम उनके उत्कृष्ट तकनीकी सहायता के लिए जिनके डी 'होंट, फ़्रेडरिक वान Rockeghem, नेटली Farla, कैली लेमेयर, और Riet डे RYCKE धन्यवाद। हम भी उनके विशेषज्ञ सहायता के लिए सूजन अनुसंधान केंद्र के Bioimaging कोर सुविधा से EEF Parthoens, Evelien वान Hamme, और अमांडा गोन्साल्वेस धन्यवाद। हम बहुमूल्य विचार विमर्श के लिए हमारे शोध समूह के सदस्य को स्वीकार करते हैं। इस काम बेल्जियम विज्ञान नीति द्वारा समर्थित किया गया (Belspo इंटर यूनिवर्सिटी आकर्षण डंडे – पुरस्कार आईएपी सातवीं-07 DevRepair; https://devrepair.be), रानी एलिजाबेथ मेडिकल फाउंडेशन, बेल्जियम (GSKE 2008-2010 द्वारा; http: // www .fmre-gske.be), और गेन्ट विश्वविद्यालय, बेल्जियम (http://www.ugent.be/en/ghentuniv) के ठोस रिसर्च क्रिया (गोवा 01G01908) द्वारा। एसजी फ्लैंडर्स रिसर्च फंड (FWO-V) के पोस्टडॉक्टरल साथी है।
Materials
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20°C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23G needles | Fine-ject | 8697 | |
| 1-ml syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 ml distilled water, autoclave and store at 4°C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment: | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 ml, 10 ml and 25 ml | |||
| 15-ml and 50-ml conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μl) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37°C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media: | |||
| MEF Medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| SR-based mESC medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR ) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/ml recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium): | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4°C; warm 30 min at 37°C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/ml ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
Referências
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).

