Hydrolyseprodukter af en Ni-Schiff-Base Complex Brug af betingelser egnet til Bevarelse af syrelabile Protecting Groups
Summary
Her præsenteres en effektiv hydrolyse og efterfølgende Fmoc beskyttelse af en aminosyre isoleret fra en Ni-Schiff-basen kompleks. Hydrolysebetingelser præsenteret her, er egnede til anvendelse, når tilbageholdelse af syrelabilt sidekæde-beskyttende grupper er påkrævet. Denne teknik kan være tilpasses en række unaturlige aminosyre-substrater.
Abstract
Unaturlige aminosyrer, aminosyrer, der indeholder sidekædefunktionaliteter ikke almindeligvis ses i naturen, er i stigende grad findes i syntetiske peptidsekvenser. Syntese af nogle unaturlige aminosyrer indbefatter ofte anvendelsen af en precursor bestående af en Schiff-base, stabiliseret af en nikkel kation. Unaturlige sidekæder kan installeres på en aminosyre skelet fundet i denne Schiff-basen kompleks. Den resulterende unaturlige aminosyre kan derefter isoleres fra denne komplekset under anvendelse hydrolyse af Schiff-base, typisk ved anvendelse af tilbagesvaling i stærkt sur opløsning. Disse meget sure betingelser kan fjerne syrelabile sidekædebeskyttende grupper er nødvendige for de unaturlige aminosyrer, der skal anvendes i mikrobølgeassisteret fastfase-peptidsyntese. I dette arbejde, præsenterer vi en effektiv hydrolyse og efterfølgende Fmoc beskyttelse af en aminosyre isoleret fra en Ni-Schiff-base-kompleks. Hydrolysebetingelser præsenteret i dette arbejde, er egnede til tilbageholdelse af syrelabile side-kæde-beskyttende grupper og kan være tilpasses en række unaturlige aminosyre-substrater.
Introduction
Unaturlige aminosyrer (ULA s) bærende sidekæder, der varierer fra dem af de tyve naturligt forekommende aminosyrer, som findes i naturen har fundet anvendelse i en bred vifte af anvendelser. Syntese af disse ULA s kan imidlertid være vanskeligt afhængig af strukturen af sidekæderne og stereokemien af aminosyren rygrad. CH-binding aktivering af glycin i forbindelse med en nikkel Schiff-basen kompleks er blevet anvendt til at producere en lang række aminosyrederivater herunder α, p-diamino syrer 1 og UAA s bærende fluoreret 2 eller heterocykliske sidekæder. 3
Efter tilsætning af unaturlige sidekæder, funktionaliseret UAA s fjernes typisk fra Schiff-basen kompleks ved tilbagesvaling i saltsyre 4 og isoleres efterfølgende ved anvendelse af ionbytningskromatografi. Mens generelt effektiv, denne protokol genererer enMino syrer, der kan være uegnede til anvendelse i fast-fase peptidsyntese (SPPS). Arten af SPPS kræver tilstedeværelse af syrelabile sidekæde-beskyttende grupper og den stærkt sure karakter af typiske Ni-Schiff-basen nedbrydningsbetingelser forhindrer isolation ULA og har disse beskyttelsesgrupper intakte. Til vores viden, er blevet rapporteret kun ét alternativ nedbrydning fremgangsmåde: anvendelse af ethylendiamintetraeddikesyre (EDTA) og hydrazin ved forhøjede temperaturer, 5 betingelser, som i sig selv ikke kan være egnet for nogle sidekædebeskyttende grupper, såsom phthalimider.
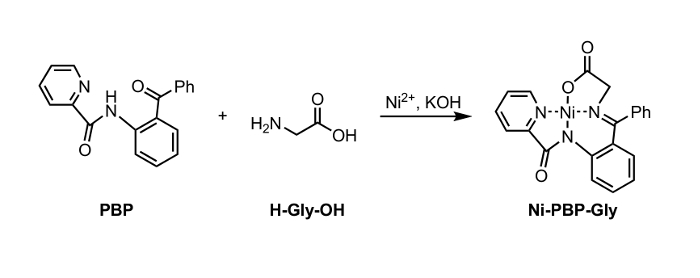
Figur 1: Syntese af Ni-PBP-Gly fra Ni2 +, PBP, og Glycine (Gly). Klik her for at se en større version af dette tal. </a>
Heri rapporterer vi en fremgangsmåde til hydrolyse af en Ni-Schiff-basen kompleks, Ni-PBP-Gly (figur 1). Dette kompleks, der er afledt af Ni2 +, glycin og pyridin-2-carboxylsyre (2-benzoyl-phenyl) -amid (PBP), 6 har vist sig at være et nyttigt udgangspunkt for syntese af en række ULA s og er let tilgængelige ved hjælp af en to-trins syntetisk vej. 7 Syntese af dette kompleks er litteratur-præcedens i højt udbytte. 6 Vores resultater beskrevet nedenfor demonstrerer anvendeligheden af hydrolysebetingelser anvender EDTA ved mildt sure til neutrale pH-betingelser egnede til anvendelse med UAA s bærende syrelabilt sidekædebeskyttende grupper. Efter hydrolyse kan den resulterende vandige opløsning isoleres og udsættes straks til standard Fmoc beskyttelse betingelser til opnåelse af en Fmoc-beskyttet aminosyre (Figur 2).
<p class="jove_content" fo: holde-together.within-side = "1">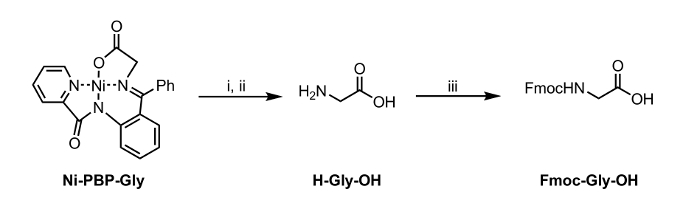
Figur 2: Hydrolyse og Fmoc-beskyttelse af en aminosyre Isoleret fra Ni-PBP-Gly. Reaction Betingelser: i. EDTA (12 ækv), pH 4,5; ii. Ethylacetat vask og indstilling til pH 7; iii. Fmoc-OSu (1 ækvivalent), NaHCO3 (2 ækvivalenter). Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Den ovenfor beskrevne protokol er nyttig i dens evne til at lette isoleringen af en aminosyre rygraden fra en Ni-Schiff-basen kompleks under milde pH-betingelser og efterfølgende Fmoc beskyttelse af dette isolerede aminosyre gennem to kritiske trin. Det første trin indebærer omrøring af en DMF / vand-opløsning indeholdende EDTA til lette frigivelsen af aminosyren fra komplekset. Resterende komplekse eller organiske biprodukter kan let fjernes med ekstraktion. Det andet trin i denne protokol involverer e…
Declarações
The authors have nothing to disclose.
Acknowledgements
Finansiering fra Slippery Rock Universitet. Vi vil gerne takke T. Bor III (Slippery Rock Universitet) og C. Haney (University of Pennsylvania) for deres indsigter.
Materials
| Ni-PBP-Gly | Synthesized from published protocol | ||
| DMF | Fisher | D119-4 | |
| EDTA | Fisher | S311-100 | |
| Dichloromethane | Acros | AC610050040 | |
| Sodium Bicarbonate | Fisher | S233-500 | |
| Fmoc-OSu | Chem-Impex | "00147" | |
| Dioxane | Fisher | D111-500 | |
| Hydrochloric Acid | Fisher | A144-500 | |
| Ethyl Acetate | Acros | AC610060040 | |
| Magnesium Sulfate | Fisher | M65-500 | |
| ZEOPrep 60ECO Silica Gel | ZEOChem | ||
| Hexanes | Fisher | 3200250.650.443 | |
| Chromatography Column | |||
| pH Test Strips | |||
| Rotary Evaporator | |||
| 250 mL Separatory Funnel | |||
| 250 mL Round Bottom Flask | |||
| Stir Bar | |||
| Stir Plate |
Referências
- Wang, J., Shi, T., Deng, G., Jiang, H., Liu, H. Highly Enantio- and Diastereoselective Mannich Reactions of Chiral Ni(II) Glycinates with amino sulfones. Efficient asymmetric synthesis of aromatic α,β-diamino acids. J. Org. Chem. 73 (21), 8563-8570 (2011).
- Wang, J., Lin, D., Zhou, S., Ding, X., Soloshonok, V. A., Liu, H. Asymmetric synthesis of sterically and electronically demanding linear ω,-trifluoromethyl containing amino acids via alkylation of chiral equivalents of nucleophilic glycine and alanine. J. Org. Chem. 76 (2), 684-687 (2011).
- Wang, J., Zhou, S., Lin, D., Ding, X., Jiang, H., Liu, H. Highly diastereo- and enantioselective synthesis of syn-β,-substituted tryptophans via asymmetric Michael addition of a chiral equivalent of nucleophilic glycine and sulfonylindoles. Chem. Commun. 47 (29), 8355-8357 (2011).
- Belokon, Y. N. Highly efficient catalytic synthesis of α,-amino acids under phase-transfer conditions with a novel catalyst/substrate pair. Angew. Chem. Int. Ed. 40 (10), 1948-1951 (2001).
- Zhou, S., Wang, J., Lin, D., Zhao, F., Liu, H. Enantioselective synthesis of 2-substituted-tetrahydroisoquinolin-1-yl glycine derivatives via oxidative cross-dehydrogenative coupling of tertiary amines and chiral nickel(II) glycinate. J. Org. Chem. 78 (22), 11204-11212 (2013).
- Belokon, Y. N. Synthesis of α,-amino acids via asymmetric phase transfer-catalyzed alkylation of achiral nickel(II) complexes of glycine-derived Schiff bases. J. Am. Chem. Soc. 125 (42), 12860-12871 (2003).
- Ueki, H., Ellis, T. K., Martin, C. H., Soloshonok, V. A. Efficient large-scale synthesis of picolinic acid-derived nickel(II) complexes of glycine. Eur. J. Org. Chem. 2003 (10), 1954-1957 (2003).
- Dener, J. M., Fantauzzi, P. P., Kshirsagar, T. A., Kelly, D. E., Wolfe, A. B. Large-scale syntheses of Fmoc-protected non-proteogenic amino acids: useful building blocks for combinatorial libraries. Org. Process Res. Dev. 5 (4), 445-449 (2001).
- Cruz, L. J., Beteta, N. G., Ewenson, A., Albericio, F. "One-pot", preparation of N-carbamate protected amino acids via the azide. Org Process Res. Dev. 8 (6), 920-924 (2004).
- Hart, J. R. . Ullmann’s Encyclopedia of Industrial Chemistry. , (2000).
- Adamson, J. G., Blaskovich, M. A., Groenevelt, H., Lajoie, G. A. Simple and convenient synthesis of tert-butyl ethers of Fmoc-serine, Fmoc-threonine, and Fmoc-tyrosine. J. Org. Chem. 56 (10), 3447-3449 (1991).
- Seyfried, M. S., Lauber, B. S., Luedtke, N. W. Multiple-turnover isotopic labeling of Fmoc- and Boc-protected amino acids with oxygen isotopes. Org. Lett. 12 (1), 104-106 (2010).
- Bonke, G., Vedel, L., Witt, M., Jaroszewski, J. W., Olsen, C. A., Franzyk, H. Dimeric building blocks for solid-phase synthesis of α,-peptide-β,-peptoid chimeras. Synthesis. 2008 (15), 2381-2390 (2008).

