A hidrólise de um Ni-base de Schiff complexa usando condies adequadas para a retenção dos grupos protectores ácido-lábil
Summary
Aqui, nós apresentamos uma hidrólise eficiente e subsequente protecção Fmoc de um aminoácido isolado a partir de um complexo de Ni-base de Schiff. As condições de hidrólise aqui apresentados são adequados para utilização quando é necessária a retenção de grupos protectores de cadeia lateral lábil a ácidos. Esta técnica pode ser adaptável a uma variedade de substratos de aminoácidos não naturais.
Abstract
Os aminoácidos não naturais, os aminoácidos contendo funcionalidades de cadeia lateral que não são normalmente vistos na natureza, são cada vez mais encontrada em sequências de péptidos sintéticos. Síntese de alguns aminoácidos não naturais muitas vezes inclui a utilização de um precursor constituído por uma base de Schiff estabilizada por um catião de níquel. Unnatural cadeias laterais pode ser instalado sobre um esqueleto de aminoácidos encontrados neste complexo de base de Schiff. O aminoácido não natural resultante pode então ser isolado a partir deste complexo usando hidrólise da base de Schiff, tipicamente pelo emprego de refluxo em solução fortemente ácida. Estas condições altamente ácidas podem remover-lábil ácido grupos de protecção necessária da cadeia lateral para os aminoácidos não naturais a serem utilizados na síntese de péptidos em fase sólida assistida por microondas. Neste trabalho, nós apresentamos uma hidrólise eficiente e subsequente protecção Fmoc de um aminoácido isolado a partir de uma base de complexo de Ni-Schiff. As condições de hidrólise apresentados neste trabalho são adequados para a retenção de s ácido-lábeis-Cadeia ide grupos de protecção e podem ser adaptável a uma variedade de substratos de aminoácidos não naturais.
Introduction
Os aminoácidos não naturais cadeias laterais de rolamento (de UAA) que variam desde aqueles dos vinte aminoácidos que ocorrem naturalmente encontrados na natureza têm encontrado utilidade numa vasta gama de aplicações. Síntese destes UAA de, no entanto, pode ser difícil, dependendo da estrutura das cadeias laterais e a estereoquímica do esqueleto de aminoácidos. CH activação ligação de glicina no contexto de um complexo de base de Schiff de níquel tem sido usada para produzir uma variedade de derivados de amino ácidos incluindo α, ácidos p-diamino 1 e rolamento da UAA fluorado 2 ou cadeias laterais heterocíclicas. 3
Após a adição de cadeias laterais não naturais, funcionalizado UAA de são tipicamente removidos a partir do complexo de base de Schiff por refluxo em ácido clorídrico 4 e são, subsequentemente, isolado usando cromatograf ia de permuta iónica. Embora geralmente eficiente, este gera um protocoloácidos mino que podem ser inadequados para utilização na sintese de péptidos em fase sólida (SPPS). A natureza da SPPS requer a presença de grupos ácido-lábil de protecção da cadeia lateral e a natureza fortemente ácida de condições típicas de decomposição de Ni-base de Schiff impede isolamento de SAU de com estes grupos protectores intactas. Para nosso conhecimento, apenas um método de decomposição alternativa tem sido relatada: utilização do ácido etilenodiaminotetracético (EDTA) e de hidrazina a temperaturas elevadas, 5 condições que se não pode ser adequado para algumas das cadeias laterais grupos protectores tais como ftalimidas.
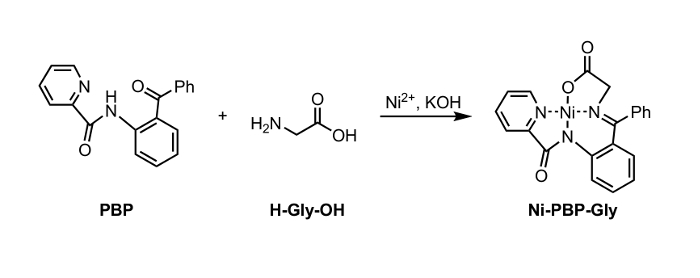
Figura 1: Síntese de Ni-PBP-Gly a partir de Ni 2+, PBP, e glicina (Gly). Por favor clique aqui para ver uma versão maior desta figura. </a>
Relata-se um método para a hidrólise de um complexo de Ni-base de Schiff, Ni-PBP-Gly (Figura 1). Este complexo, derivado de Ni 2+, glicina, e piridina-2-carboxílico (2-benzoil-fenil) -amida do ido (PBP), 6, tem sido demonstrado ser uma plataforma útil para a síntese de uma variedade de SAU de e é facilmente acessíveis usando uma via de síntese em duas fases. 7 Síntese de este complexo é, com elevado rendimento precedentes-literatura. 6 Os resultados descritos a seguir demonstram a aplicabilidade de condições de hidrólise utilizando EDTA a levemente ácido a condições de pH neutros adequados para uso com cadeia lateral lábil-ácido rolamento de UAA grupos protectores. A seguir à hidrólise, a solução aquosa resultante pode ser isolado e submetido imediatamente a condições-padrão de protecção Fmoc, para se obter um aminoácido protegido com Fmoc (Figura 2).
<p class="jove_content" fo: manter-together.within-page = "1">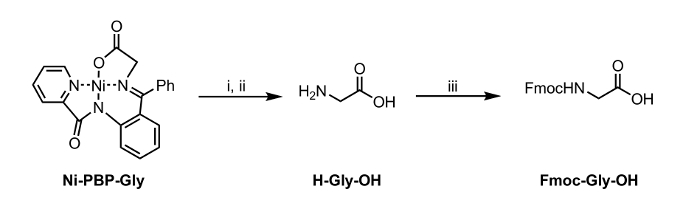
Figura 2: Hidrólise e Fmoc-protecção de um aminoácido isolada a partir de Ni-PBP-Gli. Condições de reação: i. EDTA (12 equiv), pH 4,5; ii. Acetato de etilo de lavagem e ajustamento do pH a 7; iii. Fmoc-OSu (1 equiv), NaHCO 3 (2 eq). Por favor clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O protocolo descrito acima é útil na sua capacidade para facilitar o isolamento de um esqueleto de aminoácidos a partir de um complexo de Ni-base de Schiff em condições de pH leves e subsequente protecção Fmoc deste aminoácido isolado por meio de dois passos críticos. O primeiro passo envolve a agitação de uma solução de DMF / água contendo EDTA para facilitar a libertação do aminoácido a partir do complexo. Residuais subprodutos orgânicos complexos ou pode ser facilmente removido com extracção. O se…
Declarações
The authors have nothing to disclose.
Acknowledgements
Financiamento concedido pela Universidade de Slippery Rock. Nós gostaríamos de agradecer T. Boron III (Slippery Rock University) e C. Haney (Universidade da Pensilvânia) para seus insights.
Materials
| Ni-PBP-Gly | Synthesized from published protocol | ||
| DMF | Fisher | D119-4 | |
| EDTA | Fisher | S311-100 | |
| Dichloromethane | Acros | AC610050040 | |
| Sodium Bicarbonate | Fisher | S233-500 | |
| Fmoc-OSu | Chem-Impex | "00147" | |
| Dioxane | Fisher | D111-500 | |
| Hydrochloric Acid | Fisher | A144-500 | |
| Ethyl Acetate | Acros | AC610060040 | |
| Magnesium Sulfate | Fisher | M65-500 | |
| ZEOPrep 60ECO Silica Gel | ZEOChem | ||
| Hexanes | Fisher | 3200250.650.443 | |
| Chromatography Column | |||
| pH Test Strips | |||
| Rotary Evaporator | |||
| 250 mL Separatory Funnel | |||
| 250 mL Round Bottom Flask | |||
| Stir Bar | |||
| Stir Plate |
Referências
- Wang, J., Shi, T., Deng, G., Jiang, H., Liu, H. Highly Enantio- and Diastereoselective Mannich Reactions of Chiral Ni(II) Glycinates with amino sulfones. Efficient asymmetric synthesis of aromatic α,β-diamino acids. J. Org. Chem. 73 (21), 8563-8570 (2011).
- Wang, J., Lin, D., Zhou, S., Ding, X., Soloshonok, V. A., Liu, H. Asymmetric synthesis of sterically and electronically demanding linear ω,-trifluoromethyl containing amino acids via alkylation of chiral equivalents of nucleophilic glycine and alanine. J. Org. Chem. 76 (2), 684-687 (2011).
- Wang, J., Zhou, S., Lin, D., Ding, X., Jiang, H., Liu, H. Highly diastereo- and enantioselective synthesis of syn-β,-substituted tryptophans via asymmetric Michael addition of a chiral equivalent of nucleophilic glycine and sulfonylindoles. Chem. Commun. 47 (29), 8355-8357 (2011).
- Belokon, Y. N. Highly efficient catalytic synthesis of α,-amino acids under phase-transfer conditions with a novel catalyst/substrate pair. Angew. Chem. Int. Ed. 40 (10), 1948-1951 (2001).
- Zhou, S., Wang, J., Lin, D., Zhao, F., Liu, H. Enantioselective synthesis of 2-substituted-tetrahydroisoquinolin-1-yl glycine derivatives via oxidative cross-dehydrogenative coupling of tertiary amines and chiral nickel(II) glycinate. J. Org. Chem. 78 (22), 11204-11212 (2013).
- Belokon, Y. N. Synthesis of α,-amino acids via asymmetric phase transfer-catalyzed alkylation of achiral nickel(II) complexes of glycine-derived Schiff bases. J. Am. Chem. Soc. 125 (42), 12860-12871 (2003).
- Ueki, H., Ellis, T. K., Martin, C. H., Soloshonok, V. A. Efficient large-scale synthesis of picolinic acid-derived nickel(II) complexes of glycine. Eur. J. Org. Chem. 2003 (10), 1954-1957 (2003).
- Dener, J. M., Fantauzzi, P. P., Kshirsagar, T. A., Kelly, D. E., Wolfe, A. B. Large-scale syntheses of Fmoc-protected non-proteogenic amino acids: useful building blocks for combinatorial libraries. Org. Process Res. Dev. 5 (4), 445-449 (2001).
- Cruz, L. J., Beteta, N. G., Ewenson, A., Albericio, F. "One-pot", preparation of N-carbamate protected amino acids via the azide. Org Process Res. Dev. 8 (6), 920-924 (2004).
- Hart, J. R. . Ullmann’s Encyclopedia of Industrial Chemistry. , (2000).
- Adamson, J. G., Blaskovich, M. A., Groenevelt, H., Lajoie, G. A. Simple and convenient synthesis of tert-butyl ethers of Fmoc-serine, Fmoc-threonine, and Fmoc-tyrosine. J. Org. Chem. 56 (10), 3447-3449 (1991).
- Seyfried, M. S., Lauber, B. S., Luedtke, N. W. Multiple-turnover isotopic labeling of Fmoc- and Boc-protected amino acids with oxygen isotopes. Org. Lett. 12 (1), 104-106 (2010).
- Bonke, G., Vedel, L., Witt, M., Jaroszewski, J. W., Olsen, C. A., Franzyk, H. Dimeric building blocks for solid-phase synthesis of α,-peptide-β,-peptoid chimeras. Synthesis. 2008 (15), 2381-2390 (2008).

