Гидролиз Ni-Шифф-Base комплекс Использование Условия Пригодные для удержания кислотно-лабильных защитных групп
Summary
Здесь мы представляем эффективный гидролиз и последующую защиту Fmoc аминокислоты, выделенной из никель-Шифф-щелочного комплекса. Гидролиз условие, представленное здесь, является подходящим для использования, когда требуется сохранение кислотно-лабильной боковой цепь защитных групп. Эта техника может быть адаптированы к различным неестественных аминокислотных субстратов.
Abstract
Неприродные аминокислоты, аминокислоты, содержащие боковую цепь функциональных возможностей обычно не видела в природе, все чаще можно встретить в синтетических пептидных последовательностях. Синтез некоторых неприродных аминокислот часто включает в себя использование предшественника, состоящий из Schiff-основания, стабилизированного катионом никеля. Неприродные боковые цепи могут быть установлены на основной цепи аминокислоты, найденного в этом Шифф-основного комплекса. В результате неестественно аминокислота, то может быть выделена из этого сложного с помощью гидролиза Schiff-основания, как правило, с использованием рефлюкса в сильно кислом растворе. Эти высоко кислотные условия могут удалить кислотно-лабильную боковую цепь защитных групп, необходимые для неестественных аминокислот, которые будут использоваться в СВЧ-помощи твердофазного синтеза пептидов. В этой работе мы представляем эффективный гидролиз и последующую защиту Fmoc аминокислоты, выделенную из базового комплекса Ni-Шифф. Гидролиз условие, представленное в этой работе, является подходящим для сохранения кислотно-лабильных сида цепью защитные группы и могут быть адаптированы к различным неестественных аминокислотных субстратов.
Introduction
Неприродные аминокислоты (UAA) в боковых подшипниках цепь, которые варьируются от тех, из двадцати встречающихся в природе аминокислот, найденных в природе, которые нашли применение в широком диапазоне применений. Синтез этих UAA, однако, может быть трудным в зависимости от структуры боковых цепей и стереохимий аминокислотного остова. СНА активация связи глицина в контексте Шифф-основной комплекс никеля используется для получения различных производных аминокислот , включающими а, р-диаминых кислот 1 и подшипника UAA в фторированном 2 или гетероциклических боковых цепях. 3
После добавления неестественных боковых цепей, функционализированные УАА – х , как правило , удаляются из Шиффа-щелочной комплекса нагревания с обратным холодильником в соляной кислоте 4 и затем выдел ют с помощью ионообменной хроматографии. Хотя в целом эффективным, этот протокол генерируетМина кислота, которые могут быть пригодны для использования в твердофазном синтезе пептидов (SPPS). Природа SPPS требует присутствий кислотно-лабильной боковой цепь защитных групп и сильно кислого характера типичных условий Ni-Шиффового основание разложения предотвращает выделение UAA с этими защитными группами интактных. Насколько нам известно, было сообщено только один метод разложения альтернативы: использование этилендиаминтетрауксусной кислоты (ЭДТА) и гидразином при повышенных температурах, 5 условий , которые сами по себе не могут быть пригодны для некоторых боковых цепей защитных групп , таких как фталимидов.
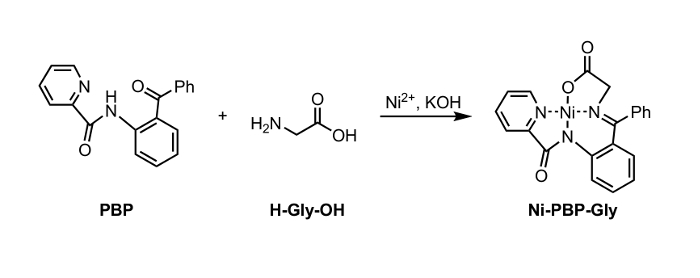
Рисунок 1: Синтез Ni-PBP-Gly из Ni 2+, PBP и глицин (Gly). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры. </а>
В данном случае мы приводим способ гидролиза Ni-Шифф-щелочного комплекса с Ni-ПБП-Гли (рисунок 1). Этот комплекс, полученный из Ni 2+, глицин и пиридин-2-карбоновой кислоты (2-бензоил-фенил) -амид (РВР), 6 было продемонстрировано , чтобы быть полезной платформой для синтеза различных UAA и является легко доступен с использованием двухступенчатого пути синтеза. 7 Синтез этого комплекса литература-прецедентов с высоким выходом. 6 Наши результаты описаны ниже демонстрируют применимость условий гидролиза с использованием ЭДТА в умеренно кислых до нейтральных условиях рН , подходящих для использования с UAA в несущей кислотно-лабильной боковой цепи защитных групп. После гидролиза, полученный водный раствор может быть выделен и немедленно подвергает стандартные условия Fmoc – защиты с получением Fmoc-защищенной аминокислоты (рисунок 2).
<p class="jove_content" fО: держать-together.within-страница = "1">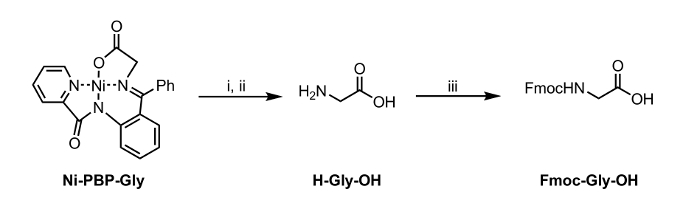
Рисунок 2: Гидролиз и Fmoc-защита аминокислоты , выделенная из Ni-PBP-Gly. Условия реакции: я. ЭДТА (12 экв), рН 4,5; II. Этилацетат стирки и регулирование до рН 7; III. Fmoc-OSu (1 экв), NaHCO 3 (2 экв). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Protocol
Representative Results
Discussion
Протокол, описанный выше, является полезным в его способности, чтобы облегчить выделение магистрали аминокислоты из никель-Шифф-щелочного комплекса в мягких условиях рН и последующей защиты Fmoc этой изолированной аминокислоты через две критические шаги. Первый этап включает перемеши?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Финансирование предусмотрено Скользкий Рок университета. Мы хотели бы поблагодарить Т. бора III (Скользкий Рок университет) и C Хани (Университет Пенсильвании) за их идеи.
Materials
| Ni-PBP-Gly | Synthesized from published protocol | ||
| DMF | Fisher | D119-4 | |
| EDTA | Fisher | S311-100 | |
| Dichloromethane | Acros | AC610050040 | |
| Sodium Bicarbonate | Fisher | S233-500 | |
| Fmoc-OSu | Chem-Impex | "00147" | |
| Dioxane | Fisher | D111-500 | |
| Hydrochloric Acid | Fisher | A144-500 | |
| Ethyl Acetate | Acros | AC610060040 | |
| Magnesium Sulfate | Fisher | M65-500 | |
| ZEOPrep 60ECO Silica Gel | ZEOChem | ||
| Hexanes | Fisher | 3200250.650.443 | |
| Chromatography Column | |||
| pH Test Strips | |||
| Rotary Evaporator | |||
| 250 mL Separatory Funnel | |||
| 250 mL Round Bottom Flask | |||
| Stir Bar | |||
| Stir Plate |
Referências
- Wang, J., Shi, T., Deng, G., Jiang, H., Liu, H. Highly Enantio- and Diastereoselective Mannich Reactions of Chiral Ni(II) Glycinates with amino sulfones. Efficient asymmetric synthesis of aromatic α,β-diamino acids. J. Org. Chem. 73 (21), 8563-8570 (2011).
- Wang, J., Lin, D., Zhou, S., Ding, X., Soloshonok, V. A., Liu, H. Asymmetric synthesis of sterically and electronically demanding linear ω,-trifluoromethyl containing amino acids via alkylation of chiral equivalents of nucleophilic glycine and alanine. J. Org. Chem. 76 (2), 684-687 (2011).
- Wang, J., Zhou, S., Lin, D., Ding, X., Jiang, H., Liu, H. Highly diastereo- and enantioselective synthesis of syn-β,-substituted tryptophans via asymmetric Michael addition of a chiral equivalent of nucleophilic glycine and sulfonylindoles. Chem. Commun. 47 (29), 8355-8357 (2011).
- Belokon, Y. N. Highly efficient catalytic synthesis of α,-amino acids under phase-transfer conditions with a novel catalyst/substrate pair. Angew. Chem. Int. Ed. 40 (10), 1948-1951 (2001).
- Zhou, S., Wang, J., Lin, D., Zhao, F., Liu, H. Enantioselective synthesis of 2-substituted-tetrahydroisoquinolin-1-yl glycine derivatives via oxidative cross-dehydrogenative coupling of tertiary amines and chiral nickel(II) glycinate. J. Org. Chem. 78 (22), 11204-11212 (2013).
- Belokon, Y. N. Synthesis of α,-amino acids via asymmetric phase transfer-catalyzed alkylation of achiral nickel(II) complexes of glycine-derived Schiff bases. J. Am. Chem. Soc. 125 (42), 12860-12871 (2003).
- Ueki, H., Ellis, T. K., Martin, C. H., Soloshonok, V. A. Efficient large-scale synthesis of picolinic acid-derived nickel(II) complexes of glycine. Eur. J. Org. Chem. 2003 (10), 1954-1957 (2003).
- Dener, J. M., Fantauzzi, P. P., Kshirsagar, T. A., Kelly, D. E., Wolfe, A. B. Large-scale syntheses of Fmoc-protected non-proteogenic amino acids: useful building blocks for combinatorial libraries. Org. Process Res. Dev. 5 (4), 445-449 (2001).
- Cruz, L. J., Beteta, N. G., Ewenson, A., Albericio, F. "One-pot", preparation of N-carbamate protected amino acids via the azide. Org Process Res. Dev. 8 (6), 920-924 (2004).
- Hart, J. R. . Ullmann’s Encyclopedia of Industrial Chemistry. , (2000).
- Adamson, J. G., Blaskovich, M. A., Groenevelt, H., Lajoie, G. A. Simple and convenient synthesis of tert-butyl ethers of Fmoc-serine, Fmoc-threonine, and Fmoc-tyrosine. J. Org. Chem. 56 (10), 3447-3449 (1991).
- Seyfried, M. S., Lauber, B. S., Luedtke, N. W. Multiple-turnover isotopic labeling of Fmoc- and Boc-protected amino acids with oxygen isotopes. Org. Lett. 12 (1), 104-106 (2010).
- Bonke, G., Vedel, L., Witt, M., Jaroszewski, J. W., Olsen, C. A., Franzyk, H. Dimeric building blocks for solid-phase synthesis of α,-peptide-β,-peptoid chimeras. Synthesis. 2008 (15), 2381-2390 (2008).

