Hydrolys av en Ni-Schiff-Base Complex Använda betingelser som är lämpliga för Bibehållande av syralabil skydds Grupper
Summary
Här presenterar vi en effektiv hydrolys och efterföljande Fmoc-skyddning av en aminosyra som isolerats från en Ni-Schiff-bas-komplex. Hydrolysbetingelser som presenteras här är lämpliga för användning när det krävs retention av syralabil sidokedjeskyddande grupper. Denna teknik kan vara anpassningsbar till en mångfald av onaturliga aminosyrasubstrat.
Abstract
Onaturliga aminosyror, aminosyror innehållande sidokedjefunktionaliteter inte oftast ses i naturen, i allt högre grad finns i syntetiska peptidsekvenser. Syntes av vissa onaturliga aminosyror innefattar ofta användning av en prekursor bestående av en Schiffsk bas stabiliseras av en nickel katjon. Onaturliga sidokedjor kan installeras på en aminosyraskelettet finns i detta Schiff-bas-komplex. Den resulterande onaturliga aminosyran kan sedan isoleras från detta komplex med användning av hydrolys av den Schiffska-bas, typiskt genom användning av återloppskokning i starkt sur lösning. Dessa mycket sura förhållanden kan avlägsna syralabila sidokedjeskyddande grupper som är nödvändiga för de onaturliga aminosyrorna som skall användas i mikrovågsassisterad fast-fas-peptidsyntes. I detta arbete, presenterar vi en effektiv hydrolys och efterföljande Fmoc-skyddning av en aminosyra som isolerats från en Ni-Schiff-bas-komplex. Hydrolysbetingelser som presenteras i detta arbete är lämpliga för bibehållande av syra-labila side-kedja skyddande grupper och kan vara anpassningsbar till en mångfald av onaturliga aminosyrasubstrat.
Introduction
Onaturliga aminosyror (UAA s) lagersidokedjor som varierar från de av de tjugo naturligt förekommande aminosyrorna som finns i naturen har funnit användning inom ett brett spektrum av applikationer. Syntes av dessa UAA s dock kan vara svårt beroende på strukturen av de sidokedjor och stereokemin av aminosyraryggraden. CH bond aktivering av glycin i samband med en nickel Schiff-bas-komplex har använts för att tillverka en mängd olika aminosyraderivat inklusive α, p-diamino syror 1 och UAA s lager fluorerad 2 eller heterocykliska sidokedjor. 3
Efter tillsats av onaturliga sidokedjor, funktionaliserad UAA s avlägsnas typiskt från Schiff-bas-komplex genom återflöde i saltsyra 4 och därefter isoleras med användning av jonbyteskromatografi. Medan generellt effektiv, detta protokoll genererar enmino syror som kan vara olämpliga för användning i fast-fas peptidsyntes (SPPS). Naturen av SPPS kräver närvaron av syralabil sidokedjeskyddande grupper och det kraftigt sura naturen hos typiska Ni-Schiff-bas sönderdelningsbetingelser förhindrar isolering av UAA-talet med dessa skyddsgrupper intakta. Såvitt vi vet har endast ett alternativ nedbrytningsmetod rapporterats: användning av etylendiamintetraättiksyra (EDTA) och hydrazin vid förhöjd temperatur, 5 villkor som själva inte kan vara lämpliga för vissa sidokedjeskyddande grupper såsom ftalimider.
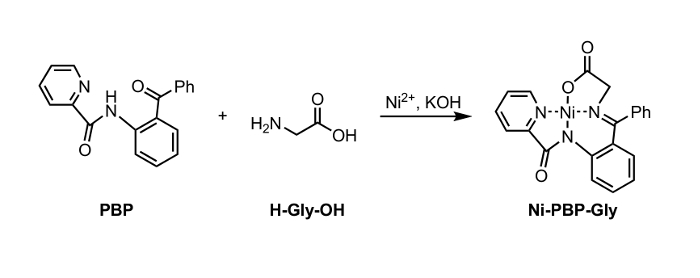
Figur 1: Syntes av Ni-PBP-Gly från Ni2 +, PBP, och Glycine (Gly). Klicka här för att se en större version av denna siffra. </a>
Häri, rapporterar vi ett förfarande för hydrolys av en Ni-Schiff-bas-komplex, Ni-PBP-Gly (fig 1). Detta komplex, som härrör från Ni2 +, glycin och pyridin-2-karboxylsyra- (2-bensoyl-fenyl) -amid (PBP), 6 har visat sig vara en användbar plattform för syntes av en mängd olika UAA s och är lätt tillgängliga med användning av en tvåstegs syntetisk väg. 7 Syntes av detta komplex är litteratur-precedented i högt utbyte. 6 Våra resultat som beskrivs nedan demonstrerar användbarheten av hydrolysbetingelser som utnyttjar EDTA vid milt sura till neutrala pH-betingelser som är lämpliga för användning med UAA s lager syralabil sidokedjeskyddande grupper. Efter hydrolys, kan den resulterande vattenlösningen isoleras och underkastas omedelbart till standardbetingelser Fmoc skydds till bildning av en Fmoc-skyddad aminosyra (Figur 2).
<p class="jove_content" fo: keep-together.within-page = "1">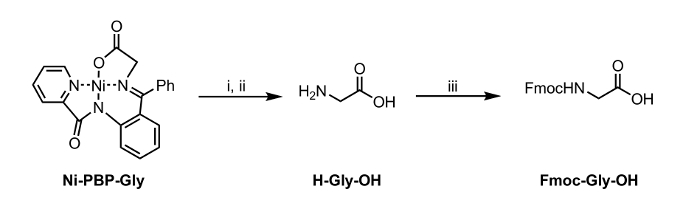
Figur 2: Hydrolys och Fmoc-skydd av en aminosyra Isolerad från Ni-PBP-Gly. Reaktionsbetingelser i. EDTA (12 ekv), pH 4,5; ii. Etylacetat tvätt och justering till pH 7; III. Fmoc-OSu (1 ekv), NaHCOa 3 (2 ekv). Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Det protokoll som beskrivits ovan är användbar i dess förmåga att underlätta isoleringen av en aminosyrahuvudkedja från en Ni-Schiff-bas-komplex under milda pH-betingelser och efterföljande Fmoc-skyddning av denna isolerade aminosyra genom två kritiska steg. Det första steget involverar att omröring en lösning DMF / vatten innehållande EDTA för att underlätta frigöring av aminosyran från komplexet. Rest komplexa eller organiska biprodukter kan lätt tas bort med extraktion. Det andra steget av detta prot…
Declarações
The authors have nothing to disclose.
Acknowledgements
Finansiering av Slippery Rock University. Vi vill tacka T. Boron III (Slippery Rock University) och C. Haney (University of Pennsylvania) för sina insikter.
Materials
| Ni-PBP-Gly | Synthesized from published protocol | ||
| DMF | Fisher | D119-4 | |
| EDTA | Fisher | S311-100 | |
| Dichloromethane | Acros | AC610050040 | |
| Sodium Bicarbonate | Fisher | S233-500 | |
| Fmoc-OSu | Chem-Impex | "00147" | |
| Dioxane | Fisher | D111-500 | |
| Hydrochloric Acid | Fisher | A144-500 | |
| Ethyl Acetate | Acros | AC610060040 | |
| Magnesium Sulfate | Fisher | M65-500 | |
| ZEOPrep 60ECO Silica Gel | ZEOChem | ||
| Hexanes | Fisher | 3200250.650.443 | |
| Chromatography Column | |||
| pH Test Strips | |||
| Rotary Evaporator | |||
| 250 mL Separatory Funnel | |||
| 250 mL Round Bottom Flask | |||
| Stir Bar | |||
| Stir Plate |
Referências
- Wang, J., Shi, T., Deng, G., Jiang, H., Liu, H. Highly Enantio- and Diastereoselective Mannich Reactions of Chiral Ni(II) Glycinates with amino sulfones. Efficient asymmetric synthesis of aromatic α,β-diamino acids. J. Org. Chem. 73 (21), 8563-8570 (2011).
- Wang, J., Lin, D., Zhou, S., Ding, X., Soloshonok, V. A., Liu, H. Asymmetric synthesis of sterically and electronically demanding linear ω,-trifluoromethyl containing amino acids via alkylation of chiral equivalents of nucleophilic glycine and alanine. J. Org. Chem. 76 (2), 684-687 (2011).
- Wang, J., Zhou, S., Lin, D., Ding, X., Jiang, H., Liu, H. Highly diastereo- and enantioselective synthesis of syn-β,-substituted tryptophans via asymmetric Michael addition of a chiral equivalent of nucleophilic glycine and sulfonylindoles. Chem. Commun. 47 (29), 8355-8357 (2011).
- Belokon, Y. N. Highly efficient catalytic synthesis of α,-amino acids under phase-transfer conditions with a novel catalyst/substrate pair. Angew. Chem. Int. Ed. 40 (10), 1948-1951 (2001).
- Zhou, S., Wang, J., Lin, D., Zhao, F., Liu, H. Enantioselective synthesis of 2-substituted-tetrahydroisoquinolin-1-yl glycine derivatives via oxidative cross-dehydrogenative coupling of tertiary amines and chiral nickel(II) glycinate. J. Org. Chem. 78 (22), 11204-11212 (2013).
- Belokon, Y. N. Synthesis of α,-amino acids via asymmetric phase transfer-catalyzed alkylation of achiral nickel(II) complexes of glycine-derived Schiff bases. J. Am. Chem. Soc. 125 (42), 12860-12871 (2003).
- Ueki, H., Ellis, T. K., Martin, C. H., Soloshonok, V. A. Efficient large-scale synthesis of picolinic acid-derived nickel(II) complexes of glycine. Eur. J. Org. Chem. 2003 (10), 1954-1957 (2003).
- Dener, J. M., Fantauzzi, P. P., Kshirsagar, T. A., Kelly, D. E., Wolfe, A. B. Large-scale syntheses of Fmoc-protected non-proteogenic amino acids: useful building blocks for combinatorial libraries. Org. Process Res. Dev. 5 (4), 445-449 (2001).
- Cruz, L. J., Beteta, N. G., Ewenson, A., Albericio, F. "One-pot", preparation of N-carbamate protected amino acids via the azide. Org Process Res. Dev. 8 (6), 920-924 (2004).
- Hart, J. R. . Ullmann’s Encyclopedia of Industrial Chemistry. , (2000).
- Adamson, J. G., Blaskovich, M. A., Groenevelt, H., Lajoie, G. A. Simple and convenient synthesis of tert-butyl ethers of Fmoc-serine, Fmoc-threonine, and Fmoc-tyrosine. J. Org. Chem. 56 (10), 3447-3449 (1991).
- Seyfried, M. S., Lauber, B. S., Luedtke, N. W. Multiple-turnover isotopic labeling of Fmoc- and Boc-protected amino acids with oxygen isotopes. Org. Lett. 12 (1), 104-106 (2010).
- Bonke, G., Vedel, L., Witt, M., Jaroszewski, J. W., Olsen, C. A., Franzyk, H. Dimeric building blocks for solid-phase synthesis of α,-peptide-β,-peptoid chimeras. Synthesis. 2008 (15), 2381-2390 (2008).

