तीन आयामी ऊतक दोहराऊंगा विकासात्मक तंत्र के लिए गठबंधन Astrocyte नेटवर्क इंजीनियर और तंत्रिका तंत्र पुनर्जनन की सुविधा
Summary
हम स्वयं के विकास का प्रदर्शन इकट्ठा, longitudinally के तीन आयामी बंडलों गठबंधन astrocytic सोमता और प्रक्रियाओं के भीतर एक उपंयास झालर । इन इंजीनियर “रहने पाड़”, माइक्रोन पैमाने व्यास का प्रदर्शन अभी तक लंबाई में सेंटीमीटर का विस्तार, परीक्षण के रूप में काम कर सकते है बिस्तरों neurodevelopmental तंत्र का अध्ययन करने या neuroregeneration की सुविधा के द्वारा ंयूरॉंस माइग्रेशन और/ pathfinding.
Abstract
Neurotrauma और neurodegenerative रोग अक्सर केंद्रीय तंत्रिका तंत्र (सीएनएस) की सीमित क्षमता के कारण स्थाई स्नायविक घाटे में परिणाम के लिए खो ंयूरॉंस की जगह और axonal रास्ते पुनर्जीवित । हालांकि, तंत्रिका तंत्र के विकास के दौरान, न्यूरॉन्स माइग्रेशन और axonal विस्तार अक्सर अन्य कोशिकाओं द्वारा गठित रास्ते के साथ होते हैं, “रहने पाड़” के रूप में संदर्भित. इन तंत्र का अनुकरण करने की मांग और एक रणनीति है कि सीएनएस के निरोधात्मक पर्यावरण दरकिनार डिजाइन, इस पांडुलिपि एक प्रोटोकॉल के लिए ऊतक इंजीनियर astrocyte आधारित बनाना “रहने पाड़” प्रस्तुत करता है । इन constructs बनाने के लिए, हम एक उपंयास के लिए स्व astrocytes प्रेरित झालर योजना कार्यरत है द्विध्रुवी longitudinally के घने तीन आयामी बंडलों-संरेखित सोमता और प्रक्रियाओं में इकट्ठे । सबसे पहले, खोखले hydrogel सूक्ष्म कॉलम इकट्ठे हुए थे, और भीतरी लुमेन कोलेजन extracellular-मैट्रिक्स के साथ लेपित था । असंबद्ध सेरेब्रल cortical astrocytes तो बेलनाकार माइक्रो-कॉलम के लुमेन में दिया गया था और, < 350 µm के एक महत्वपूर्ण भीतरी व्यास पर, अनायास स्वयं गठबंधन और घने बंडलों से मिलकर लंबे समय फाइबर की तरह केबल का उत्पादन करने के लिए अनुबंध astrocyte प्रक्रियाओं और कोलेजन तंतुओं मापने 97% सेल व्यवहार्यता और वस्तुतः विशेष रूप से मध्यवर्ती रेशा प्रोटीन glial-fibrillary अंलीय प्रोटीन (GFAP), vimentin, और nestin का एक संयोजन व्यक्त astrocytes के शामिल थे । इन गठबंधन astrocyte नेटवर्क के लिए एक स्वतंत्र सब्सट्रेट प्रदान करने के लिए पाया गया न्यूरॉन्स लगाव और गठबंधन neurite विस्तार. इसके अलावा, इन constructs अखंडता और संरेखण बनाए रखने जब hydrogel झालर से निकाले, उंहें सीएनएस आरोपण के लिए उपयुक्त बना । ये क्षेऽ का निर्माण संरचनात्मक रूप से vivo मेंप्राकृतिक रूप से होने वाली glial-आधारित “रहने पाड़ों” के प्रमुख cytoarchitectural तत्वों का अनुकरण । जैसे, इन इंजीनियर रहने पाड़ों परीक्षण के रूप में सेवा कर सकते है-बिस्तरों इन विट्रो में neurodevelopmental तंत्र का अध्ययन करने या neuroregeneration की सुविधा के द्वारा ंयूरॉन प्रवासन और/या axonal में सीएनएस अध: पतन के बाद vivo .
Introduction
केंद्रीय तंत्रिका तंत्र (सीएनएस) एक सीमित क्षमता को नुकसान और/या न्यूरॉन्स और axonal मार्ग है कि ऐसे दर्दनाक मस्तिष्क की चोट (TBI), स्ट्रोक, रीढ़ की हड्डी की चोट (विज्ञान), और neurodegenerative रोग के रूप में शर्तों के साथ की शिथिलता प्रभावहीन है1 ,2,3,4,5. सीएनएस में Neurogenesis मस्तिष्क में क्षेत्रों की एक सीमित संख्या के लिए प्रतिबंधित है, खो ंयूरॉंस की बहाली में बाधा6,7। इसके अतिरिक्त, सीएनएस में खो axonal रास्ते का पुनर्जनन निर्देशित मार्गदर्शन की कमी के कारण अपर्याप्त है, वृद्धि अवरोधकों की उपस्थिति, और प्रतिक्रियाशील astrogliosis तंत्रिका ऊतक के लिए निंनलिखित क्षति2,8, 9,10. Astrocytes आमतौर पर आयन homeostasis, न्यूरोट्रांसमीटर मंजूरी, synapse गठन, और neurovascular युग्मन के साथ न्यूरॉन्स की सहायता करने में विविध कार्य किया है11. फिर भी, तंत्रिका ऊतक को हल्के नुकसान के बाद, astrocytes आणविक, संरचनात्मक, और कार्यात्मक परिवर्तन से गुजरना हो सकता है के रूप में वे एक hypertrophic राज्य के लिए संक्रमण11। गंभीर neurotrauma के जवाब में, इन परिवर्तनों के परिणामस्वरूप एक penumbra के साथ एक निशान के गठन में प्रतिक्रियाशील astrocytes और एक घाव कोर जिसमें टूटना रक्त-मस्तिष्क बाधा से लीक ल्यूकोसाइट्स शामिल है (BBB), microglia, oligodendrocytes, व fibroblasts११,१२,१३. ये प्रतिक्रियाशील astrocytes, मध्यम रेशा प्रोटीन और chondroitin सल्फेट proteoglycans (CSPGs), जो तंत्रिका पुनर्जनन12में बाधा की बढ़ती अभिव्यक्ति की एक आकृति विज्ञान, अव्यवस्थित प्रक्रियाओं और प्रदर्शनी की वृद्धि हुई । हालांकि glial निशान शुरू में मदद करता है BBB अखंडता को बहाल करने और आसपास के स्वस्थ ऊतकों के लिए भड़काऊ प्रतिक्रिया के संचरण से बचने, यह axon पुनर्जनन12के खिलाफ एक भौतिक और जैव रासायनिक बाधा के रूप में कार्य करता है,14 ,15,16. उदाहरण के लिए, axons है कि मुठभेड़ glial निशान प्रदर्शन बल्ब अपक्षयी विकास शंकु और स्टंट विकास12। इसके अलावा, astrocytic की प्रक्रिया की चोट के बाद axons17पुनः उत्पन्न करने के विस्तार में बाधा उत्पन्न करता है । इन निरोधात्मक विशेषताओं का परिणाम अक्सर स्थाई शारीरिक और स्नायविक दोष है कि रोगियों को गंभीर neurotrauma, TBI और विज्ञान सहित के बाद पीड़ित में प्रकट होता है ।
बाह्य सीएनएस में कार्यात्मक उत्थान का सामना करना पड़ रहा चुनौतियों के बावजूद, axons को पुनर्जीवित करने के लिए एक आंतरिक क्षमता के अधिकारी के लिए दिखाया गया है । उदाहरण के लिए, glial निशान के साथ संपर्क में अपक्षयी विकास शंकु के गतिशील प्रकृति पता चलता है कि इन अंत अपनी क्षमता को बनाए रखने के लिए12का विस्तार । नतीजतन, यह माना जाता है कि axonal पुनः वृद्धि के लिए एक मुख्य बाधा पोस्ट सीएनएस के निरोधात्मक वातावरण है और यह है कि glial scarring को कम करने के माध्यम से एक अधिक स्वतंत्र वातावरण प्रदान करने और/या निशान भर में अपक्षयी पुलों प्रदान होगा लाभप्रद. दरअसल, पिछले अध्ययनों का प्रदर्शन किया है कि सीएनएस न्यूरॉन्स पुलों के रूप में परिधीय तंत्रिका भ्रष्टाचार का उपयोग कर एक घाव के माध्यम से axons का विस्तार करने में सक्षम थे, जो axon पुनर्जनन12के लिए एक और अधिक अनुकूल वातावरण वर्तमान,18, 19. कई अंय रणनीतियों इस vestigial अपक्षयी क्षमता का दोहन करने के लिए पीछा किया गया है । उदाहरण के लिए, सेल विकास के विभिंन चोट मॉडलों में संकेत रास्ते के हेरफेर axonal पुनर्जनन और glial निशान कमी10,20,21में हुई है । इसके अतिरिक्त, अध्ययनों से पता चला है कि chondroitinase एबीसी, जो CSPGs में चीनी श्रृंखला के बहुमत से सट के साथ उपचार, CSPGs के निरोधात्मक प्रभाव को कम करने के लिए सक्रिय द्वारा स्रावित astrocytes22। उत्साहजनक परिणाम के बावजूद, इन तरीकों विकास शंकु, जो संभवतः ंयायपालिका पुनर्जनन12में परिणाम कर सकते है के मार्गदर्शन निर्देशित प्रदान नहीं करते हैं, और भी ंयूरॉंस के नुकसान के लिए खाते में नहीं है । सेल आधारित दृष्टिकोण glial निशान के प्रभाव को दुर्गम और खो कोशिकाओं, विशेष रूप से ंयूरॉंस भरपाई करने के प्रयास में उपयोग किया गया है । कुछ समूहों astrocytes न्यूरॉन्स में विभेदित प्रतिक्रियाशील है, जबकि दूसरों को चोट क्षेत्र को फिर से बसाने और axon पुनर्जनन को बढ़ावा देने के लिए सीएनएस घावों में तंत्रिका जनक कोशिकाओं प्रत्यारोपण किया है23,24, 25. हालांकि, स्टेम सेल प्रत्यारोपण अकेले कम जीवित रहने की दर, गरीब एकीकरण, और क्षतिग्रस्त ऊतक में मामूली प्रतिधारण द्वारा सीमित है5. इसके अलावा, इन सेल आधारित रणनीतियों के लिए लंबी दूरी axonal इलाकों, विशेष रूप से एक नियंत्रित तरीके से बहाल करने में विफल । इसलिए, अन्य दृष्टिकोण के साथ संयोजन में, विभिन्न तंत्रिका और जनक कोशिकाओं और विकास कारकों के लिए वितरण वाहनों के रूप में पता लगाया जा रहा है26। डिजाइन नियंत्रण के एक उच्च डिग्री-आधारित दृष्टिकोण सुविधा का निर्माण करने के लिए कि विशिष्ट शारीरिक, haptotaxic, और chemotaxic तीन आयामी (3 डी) लक्ष्य मेजबान ऊतक के microenvironment में मौजूद cues नकल का उत्पादन करने के लिए27, 28,29,30,31,३२,३३,३४. इन पर्यावरणीय संकेतों के प्रजनन, प्रत्यारोपण कोशिकाओं के लिए सर्वोपरि है मूल आकृति विज्ञान, प्रसार, प्रवास, और संकेतन, अन्य neurobiological विशेषताओं के बीच29पेश करने के लिए । इन लाभप्रद गुणों के बावजूद, पारंपरिक कोशिका से परे उंनति के लिए बीज बोने की एक साथ लंबी दूरी की axonal पुनर्जनन निर्देश को बढ़ावा देने और खो ंयूरॉंस की जगह की आवश्यकता है ।
एक आशाजनक वैकल्पिक दृष्टिकोण पर आधारित है तंत्रिका ऊतक इंजीनियर “रहने पाड़”, जो अन्य कोशिका से अलग कर रहे हैं आधारित एक अनुरूप cytoarchitecture के साथ तंत्रिका कोशिकाओं के रहने की उपस्थिति के कारण दृष्टिकोण है कि देशी neuroanatomy का अनुकरण और/ विकासात्मक तंत्र लक्षित प्रतिस्थापन, पुनर्निर्माण, और तंत्रिका सर्किट4के उत्थान की सुविधा के लिए,३५। पाड़ों के डिजाइन के लिए विचार phenotypes और तंत्रिका कोशिकाओं के स्रोतों, साथ ही साथ यांत्रिक/भौतिक संपत्तियों और जैव रासायनिक संकेतों के किसी भी साथ के संयोजन से तय की संरचना में शामिल है३५। इन विट्रो मेंनिर्माण के बाद, इन रहने वाले पाड़ vivo में सेल-आसंजन अणुओं और chemotactic और neurotrophic संकेतों को सक्रिय रूप से विनियमित तंत्रिका सेल प्रवासन और राज्य के आधार पर axon वृद्धि को नियंत्रित करने के लिए प्रत्यारोपित किया जा सकता है और ३५reअपक्षय प्रक्रियाओं की प्रगति । Glial कोशिकाओं के रहने वाले पाड़ के इंजीनियर cytoarchitecture के लिए एक आधार के रूप में इन कोशिकाओं vivo मेंविभिंन विकासात्मक तंत्र मध्यस्थता के बाद सेवा कर सकते हैं । मस्तिष्क के विकास के दौरान, नए ंयूरॉंस बेसल निर्देशित प्रवासन३६,३७के लिए रहने वाले पाड़ के रूप में विकासशील cortical प्लेट की ओर वेंट्रिकुलर क्षेत्र से रेडियल glia द्वारा विस्तारित प्रक्रियाओं पर निर्भर हैं । इसके अलावा, विकास शंकु का विस्तार करने के लिए खुद को आकर्षक और क्रीमी glial guidepost कोशिकाओं द्वारा उठाए गए संकेतों संवेदन द्वारा उंमुख दिखाया जाता है, और तथाकथित “अग्रणी” axons को पूर्व पैटर्न के साथ विस्तार से सही लक्ष्य तक पहुंचने का सुझाव दिया जाता है glial पाड़ो३५,३८,३९. इस प्रकार, glial कोशिकाओं अग्रणी axons के मार्गदर्शन के लिए आवश्यक हैं, जो बाद में axon के रूप में सेवा आधारित “रहने पाड़” के प्रक्षेपण निर्देशित करने के लिए “अनुयाई” axons । इसके अलावा, glia-मध्यस्थता विकास तंत्र postnatally बनाए रखने के लिए दिखाया गया है, के रूप में neuroblasts rostral प्रवासी धारा (RMS) का पालन करने के लिए subventricular क्षेत्र से नेविगेट करने के लिए (SVZ), वयस्क मस्तिष्क में neurogenesis के कुछ शेष क्षेत्रों में से एक, घ्राण बल्ब (ओबी)४० RMS में इन neuroblasts glial ट्यूब (चित्र 1a-1), जो longitudinally-संरेखित astrocytic प्रक्रियाओं, सीधे सेल-सेल आसंजन और स्थानीयकृत घुलनशील कारकों३७के माध्यम से शामिल है के भीतर माइग्रेट करें, ४१. अंत में, जबकि स्तनधारियों में सीएनएस नुकसान बाधित astrocytic प्रक्रिया एक glial निशान है कि शारीरिक रूप से axonal पुनर्जनन17, कई गैर स्तनधारी प्रणालियों एक हानिकारक glial निशान के गठन की कमी के गठन की व्यवस्था का कारण बनता है । बल्कि, गैर स्तनधारी प्रजातियों के glial कोशिकाओं को और अधिक संगठित, गठबंधन पैटर्न है कि घायल क्षेत्र के माध्यम से गाइड के रूप में उपयोग किया जाता है बनाए रखने के17,४२,४३। उदाहरण के लिए, गैर में स्तनधारी विज्ञान मॉडल, axons घाव पार glial पुलों के साथ निकट सहयोग में विकसित करने के लिए दिखाया जाता है, axonal पुनर्जनन और कार्यात्मक वसूली को सुविधाजनक बनाने के रूप में आयोजित glial पाड़ों के लिए एक महत्वपूर्ण भूमिका का सुझाव ( चित्र 1a -2) ४२ , ४४ , ४५. neuroanatomical सुविधाओं के Recapitulation और विकासात्मक/ऊपर वर्णित इंजीनियर glial के एक नए वर्ग उपज हो सकता है आधारित रहने वाले पाड़ों कि समवर्ती ड्राइव कर सकते है आवर्तक ंयूरॉन प्रवासन और axonal pathfinding अंयथा गैर स्वतंत्र वातावरण के माध्यम से, जिससे संभावित सीएनएस चोट और रोग के साथ जुड़े और axon पथ अध…
हमारे अनुसंधान समूह पहले से पुनर्निर्माण और सीएनएस में axonal इलाकों के उत्थान और परिधीय तंत्रिका तंत्र (पीएन) के माध्यम से सूक्ष्म ऊतक इंजीनियर तंत्रिका नेटवर्क (माइक्रो-टेननस) और ऊतक के लिए रहने वाले पाड़ के कई प्रकार के डिजाइन किए है इंजीनियर तंत्रिका भ्रष्टाचारियों (TENGs), क्रमशः27,४६,४७,४८। दोनों रणनीतियों स्वाभाविक रूप से नकल पर आधारित हैं । माइक्रो-टेननस शारीरिक-प्रेरित संरचनाओं को संरचनात्मक रूप से डिज़ाइन किया गया है और कार्यात्मक रूप से मस्तिष्क के विशिष्ट न्यूरॉन आबादी को जोड़ने वाले axonal इलाकों को प्रतिस्थापित करते हैं । TENGs axon के विकासात्मक तंत्र का दोहन-axonal पुनर्जनन की सुविधा, उदाहरण “के साथ अनुयाई” axon विकास के साथ “पायनियर” axons, लक्षित मेजबान axonal पुनर्जनन प्राप्त करने के लिए३५,४६,४८। हम हाल ही में रहने पाड़ तकनीक की बहुमुखी प्रतिभा पर कैपिटल माइक्रो के रूप में एक समान झालर योजना का उपयोग-टेननस और glia से प्रेरणा की मांग आधारित विकास भर में मौजूद तंत्र । यहां, हम विकसित गठबंधन astrocytic एक hydrogel माइक्रो कॉलम४९के कोलेजन लुमेन फैले बंडलों से मिलकर निर्माण । इन astrocytic रहने वाले पाड़ पहले एक केशिका ट्यूब को भरने से विकसित कर रहे हैं-तरल agarose के साथ एक्यूपंक्चर सुई विधानसभा एक बाहरी व्यास (आयुध डिपो) और भीतरी व्यास (आईडी) के व्यास के लिए इसी के साथ एक खोखले बेलनाकार hydrogel बनाने के लिए ट्यूब और सुई, क्रमशः । agarose जमाना और hydrogel केशिका ट्यूब से सूक्ष्म कॉलम के निष्कर्षण के बाद, खोखले इंटीरियर प्रकार मैं कोलेजन के साथ लेपित है astrocyte आसंजन और गठबंधन बंडल गठन के लिए एक पर्यावरण स्वतंत्र की आपूर्ति (चित्र 1b -1) । बाद में, लुमेन मस्तिष्क cortical astrocytes प्रसव चूहा पिल्ले (चित्र 1b-2) से पृथक के साथ वरीयता प्राप्त है । दो आयामी (2d) संरेखण तकनीक है कि बिजली के खेतों, micropatterned खांचे के आवेदन पर निर्भर करते हैं, और extracellular मैट्रिक्स (ECM) प्रोटीन पैटर्न के विपरीत, रहने पाड़ तकनीक में astrocyte संरेखण आत्म विधानसभा पर निर्भर करता है ऐसे सब्सट्रेट वक्रता (कॉलम आईडी), कोशिका घनत्व, और कोलेजन एकाग्रता के रूप में नियंत्रणीय चर के अनुसार५०,५१,५२। astrocytes अनुबंध और कोलेजन remodel, और एक द्विध्रुवी प्राप्त, longitudinally-संरेखित आकृति विज्ञान के अनुरूप प्राकृतिक पाड़ों vivo में मनाया (चित्र 1b-3) । दरअसल, हम सक्रिय रूप से इन केबल का उपयोग कर रहे है के रूप में अच्छी तरह से क्षतिग्रस्त सीएनएस के प्रतिकूल वातावरण के माध्यम से axonal पुनर्जनन को सुविधाजनक बनाने के साथ ही स्थानांतरण अपरिपक्व न्यूरॉन्स के लक्षित मार्गदर्शन के लिए भौतिक सब्सट्रेट के रूप में संरचनाओं की तरह, विशेष रूप से स्तनधारी glial निशान (फिगर 1C). इस अनुच्छेद के astrocytic सूक्ष्म कॉलम, चरण इसके विपरीत और इम्यूनोफ्लोरेसेंस की छवियों की उंमीद cytoarchitecture के लिए विस्तृत निर्माण विधि पेश करेंगे, और वर्तमान सीमाओं और भविष्य के निर्देशों पर एक व्यापक चर्चा तकनीक.
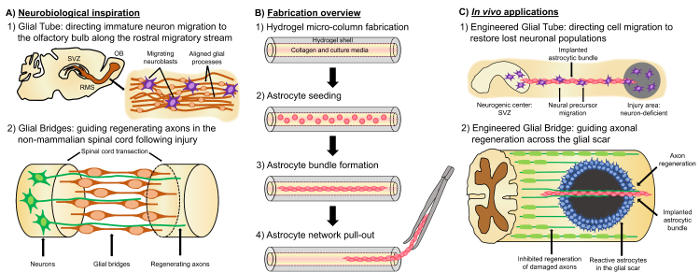
चित्रा 1: प्रेरणा, निर्माण प्रोटोकॉल, और गठबंधन Astrocytic नेटवर्क के लिए प्रस्तावित अनुप्रयोगों. (क) Neurobiological प्रेरणा: (१) तंत्रिकाजन्य subventricular जोन (SVZ) से Neuroblasts उद्भव longitudinally बल्ब (ओबी) की ओर निर्देशित प्रवास के लिए glial प्रवासी धारा (आरएमएस) में rostral संरेखित घ्राण ट्यूब का उपयोग; (2) उभयचर और मछली जैसे गैर स्तनधारियों एक glial पुल है कि एक घाव के सिरों को जोड़ता है के गठन के कारण भाग में तंत्रिका ऊतक क्षति के बाद पुनर्जनन बनाए रखने कर सकते है (जैसे transected रीढ़ की हड्डी) और के मार्गदर्शन के लिए एक पाड़ के रूप में कार्य करता है चूकने axons. (ख) निर्माण सिंहावलोकन: (1) एक माइक्रोन के निर्माण-आकार, खोखले hydrogel ECM के साथ लेपित लुमेन के साथ माइक्रो कॉलम, (2) प्राथमिक cortical astrocytes के सीडिंग प्रसव चूहा पिल्ले से पृथक, (3) longitudinally के आत्म-सभा उंमुख संस्कृति में बंडलों, और (4) भविष्य आरोपण अध्ययन के लिए झालर से बंडल के निष्कर्षण । (C) vivo अनुप्रयोगों में : (1) ये रहने वाले पाड़ तंत्रिकाजन्य केंद्रों से निर्देशित ंयूरॉन प्रवास के लिए इंजीनियर glial ट्यूबों के रूप में सेवा कर सकते है ंयूरॉन की कमी क्षेत्रों को फिर से आबाद; (२) अग्रणी axon मार्गदर्शन के विकासात्मक तंत्र की Recapitulation और गैर-स्तनधारियों में glial पुलों के पुनर्उत्पादक तंत्र के राज्यसत्ता इन astrocytic पाड़ों को गैर-axon के पार स्वतंत्र पुनर्जनन को प्रत्यक्ष करने की क्षमता के साथ- स्तनधारी glial निशान के पर्यावरण । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
Protocol
Representative Results
Discussion
पीएन के अधिक सहायक वातावरण की तुलना में, सीएनएस neurotrauma और neurodegeneration के हानिकारक परिणामों से निपटने में विशेष रूप से सीमित है । स्तनधारी सीएनएस के लिए एक गंभीर अपमान के बाद, एक glial निशान का गठन किया है, fibrotic और भड़?…
Declarações
The authors have nothing to disclose.
Acknowledgements
वित्तीय सहायता स्वास्थ्य के राष्ट्रीय संस्थानों [U01-NS094340 (Cullen) और F31-NS090746 (कटियार)], माइकल जे फॉक्स फाउंडेशन [चिकित्सकीय पाइपलाइन कार्यक्रम #9998 (Cullen)] द्वारा प्रदान किया गया था, पेन चिकित्सा तंत्रिका विज्ञान केंद्र पायलट पुरस्कार (Cullen), राष्ट्रीय विज्ञान फाउंडेशन [ग्रेजुएट रिसर्च फैलोशिप डीजीई-१३२१८५१ (Struzyna)], दिग्गजों मामलों के विभाग [आरआर एंड डी मेरिट समीक्षा #B1097-I (Cullen)], और अमेरिकी सेना चिकित्सा अनुसंधान और Materiel कमान [#W81XWH-13-207004 (Cullen) और W81XWH-15-1-0466 (Cullen)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
Referências
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

