Drie-dimensionale weefsel ontworpen uitgelijnd Astrocyt netwerken vergemakkelijken zenuwstelsel regeneratie te recapituleren Developmental mechanismen
Summary
Wij demonstreren de ontwikkeling van zelf geassembleerde, driedimensionale bundels van lengterichting uitgelijnde astrocytic waarin en processen binnen het omhulsel van een roman biomaterial. Deze “levende steigers”, het tentoonstellen van micron-schaal diameter nog uitbreiding centimeter lengte, kan dienen als proefnetwerken neurologische mechanismen bestuderen of vergemakkelijken van neuroregeneration door leiding neuronale migratie en/of axonale ontworpen vastloper.
Abstract
Neurotrauma en neurodegeneratieve ziekte vaak leiden tot een blijvende neurologische tekorten als gevolg van de beperkte capaciteit van het centrale zenuwstelsel (CNS) ter vervanging van verloren neuronen en regenereren van axonale trajecten. Echter tijdens de ontwikkeling van het zenuwstelsel optreden neuronale migratie en axonale uitbreiding vaak langs trajecten gevormd door andere cellen, hierna aangeduid als “levende steigers”. Op zoek naar te emuleren deze mechanismen en voor het ontwerpen van een strategie die de remmende omgeving van het centraal zenuwstelsel omzeilt, dit manuscript presenteert een protocol om weefsel ontworpen Astrocyt gebaseerde “levende steigers”. We gebruikt wilt maken van deze constructies, een roman biomaterial omhulsel regeling voor het opwekken van astrocyten zelf monteren in dichte driedimensionale bundels van bipolaire lengterichting uitgelijnde waarin en processen. Eerste, holle hydrogel micro-kolommen werden geassembleerd, en de binnenste lumen was bedekt met collageen extracellulaire-matrix. Gedissocieerde cerebrale corticale astrocyten vervolgens werden geleverd in het lumen van de cilindrische micro-kolom en een kritische binnendiameter van < 350 µm, spontaan zelf uitgelijnd en uitbesteed aan het produceren van lange vezel-achtige kabels bestaande uit dichte bundels Astrocyt processen en collageen fibrillen meten 97% levensvatbaarheid van cellen en waren vrijwel uitsluitend samengesteld van astrocyten uiting geven aan een combinatie van de tussenliggende gloeidraad eiwitten gliale-fibrillary zuur eiwit (GFAP), vimentin, en nestin. Deze uitgelijnd Astrocyt netwerken werden gevonden om een tolerante substraat voor neuronale bevestiging en uitgelijnd neurite extensie. Bovendien houden deze constructies integriteit en uitlijning wanneer geëxtraheerd uit het omhulsel van de hydrogel, waardoor ze geschikt voor implantatie van de CNS. Deze voorgevormde constructies emuleren structureel belangrijkste cytoarchitectural elementen van natuurlijk voorkomende gliale gebaseerde “living steigers” in vivo. Als zodanig kunnen deze gemanipuleerde levende steigers dienen als proefnetwerken studeren neurologische mechanismen in vitro of vergemakkelijken van neuroregeneration door het regisseren van neuronale migratie en/of axonale vastloper na CNS degeneratie in vivo .
Introduction
Het centrale zenuwstelsel (CNS) heeft een beperkte capaciteit voor het tegengaan van het verlies en/of disfunctie van neuronen en axonale trajecten die gepaard gaan met aandoeningen zoals traumatisch hersenletsel (TBI), beroerte, ruggenmerg letsel (SCI) en neurodegeneratieve ziekte1 ,2,,3,,4,5. Neurogenese in het VNV is beperkt tot een beperkt aantal gebieden in de hersenen, belemmering voor het herstel van verloren neuronen6,7. Bovendien, is regeneratie van verloren axonale trajecten in het VNV onvoldoende als gevolg van het ontbreken van gerichte begeleiding, de aanwezigheid van uitgroei remmers en reactieve astrogliosis na beschadiging zenuwweefsel2,8, 9,10. Astrocyten hebben gewoonlijk diverse functies in het bijstaan van neuronen met ion homeostase, neurotransmitter klaring, synaps formatie en neurovasculaire koppeling11. Niettemin, na zelfs milde beschadiging van zenuwweefsel, astrocyten kunnen moleculaire, structurele en functionele wijzigingen ondergaan als ze de overgang naar een hypertrofische staat11. In reactie op de ernstige neurotrauma, deze veranderingen leiden tot de vorming van een litteken met een bijschaduw met migreren reactieve astrocyten en een laesie kern waarin leukocyten gelekt uit de gescheurde bloed – hersenbarrière (BBB), microglia, oligodendrocyten en fibroblasten11,12,13. Deze reactieve astrocyten bereiken een morfologie van draadvormige, ongeorganiseerd processen en vertonen verhoogde expressie van tussenliggende gloeidraad eiwitten en chondroitin sulfaat-proteoglycans (CSPGs), die een belemmering vormen voor neurale regeneratie12. Hoewel het gliale litteken aanvankelijk helpt BBB integriteit herstellen en voorkomen van transmissie van de ontstekingsreactie naar het omliggende gezonde weefsel, dient het als een fysische en biochemische barrière tegen axon regeneratie12,14 ,15,16. Bijvoorbeeld, axonen die het gliale litteken optreden weergeven bolvormige Dystrofe groei kegels en onvolgroeide groei12. Bovendien belemmert de desorganisatie van astrocytic processen na blessure de uitbreiding van het regenereren van axonen17. Het resultaat van deze remmende eigenschappen komt ook tot uiting in de vaak-permanente lichamelijke en neurologische waardeverminderingen op die patiënten na ernstige neurotrauma lijden, met inbegrip van TBI en SCI.
Ongeacht de extrinsieke uitdagingen functionele regeneratie in het VNV, zijn axonen aangetoond te beschikken over een intrinsieke vermogen om te regenereren. Bijvoorbeeld, suggereert de dynamische aard van de kegels Dystrofe groei in contact met het gliale litteken dat deze uitgangen behouden hun capaciteit uit te breiden van12. Dus, het is van mening dat een belangrijke belemmering voor axonale uitgroei de remmende omgeving van de CNS na letsel en dat een meer tolerante omgeving is via vermindering van gliale littekens en/of verstrekken van regeneratieve bruggen over het litteken zou voordelige. Inderdaad, de vorige studies hebben aangetoond dat CNS neuronen aankonden axonen door middel van een laesie met behulp van perifere zenuwen transplantaten als bruggen, die een gunstiger omgeving voor axon regeneratie12,18, uit te breiden 19. Verschillende andere strategieën zijn uitgeoefend om te exploiteren deze rudimentair regeneratief vermogen. Bijvoorbeeld, heeft manipulatie van cel groei signaalroutes in verschillende modellen van de schade geleid tot axonale regeneratie en gliale scar vermindering10,20,21. Bovendien, hebben studies aangetoond dat behandeling met chondroitinase ABC, die de meerderheid van de suiker-ketens cleaves in CSPGs, de remmende werking van CSPGs uitgescheiden door reactieve astrocyten22 vermindert. Ondanks de bemoedigende resultaten, deze benaderingen bieden geen regie begeleiding van groei kegels, die kan leiden tot afwijkende regeneratie12, en ook geen rekening met het verlies aan neuronen. Cel-gebaseerde benaderingen hebben gebruikt in pogingen om te overwinnen van de gevolgen van de gliale litteken en om aan te vullen verloren cellen, met name neuronen. Sommige groepen hebben dedifferentiated reactieve astrocyten in neuronen, terwijl anderen hebben neurale voorlopercellen getransplanteerd in CNS laesies repopulate de schade-gebied en het bevorderen van axon regeneratie23,24, 25. stamceltransplantatie alleen wordt echter beperkt door lage overlevingskansen, slechte integratie en het bescheiden vasthouden in de beschadigde weefsel5. Bovendien, deze cel-gebaseerde strategieën niet herstellen van interlokale axonale traktaten, vooral op een gecontroleerde manier. Daarom, biomaterialen in combinatie met andere benaderingen worden onderzocht als leverende voertuigen voor diverse neurale en voorlopercellen en groei factoren26. Biomaterial-gebaseerde benaderingen zijn voorzien van een hoge mate van Ontwerpcontrole voor de productie van constructies die na te de specifieke fysieke, haptotaxic bootsen, en chemotaxic signalen aanwezig is in de driedimensionale (3D)-communicatie van de doel host weefsel27, 28,29,30,31,32,33,34. Reproductie van deze Milieusignalen is primordiaal voor getransplanteerde cellen te presenteren native-achtige morfologie, proliferatie, migratie en signalering, onder andere neurobiologische kenmerken29. Ondanks deze gunstige eigenschappen is vooruitgang dan traditionele cel geplaatste biomaterial steigers moeten tegelijkertijd bevorderen van gestuurde interlokale axonale regeneratie en vervanging van verloren neuronen.
“Levende steigers”, die te onderscheiden van andere cel-gebaseerde benaderingen als gevolg van de aanwezigheid van levende neurale cellen met een voorgevormde cytoarchitecture die native neuroanatomie emuleert een veelbelovende alternatieve aanpak is gebaseerd op zenuwweefsel ontworpen en/of Developmental mechanismen om gerichte vervanging, wederopbouw en herstel van de neurale circuits4,35. Overwegingen bij het ontwerp van levende steigers zijn de fenotypes en de bronnen van neurale cellen, evenals de mechanische/fysische eigenschappen en de biochemische signalen gedicteerd door de samenstelling van de begeleidende biomaterialen35. Na fabricage in vitro, deze levende steigers kunnen worden geïmplanteerd in vivo aan de huidige cel-celadhesie-moleculen en Chemotactische en neurotrophic signalen neurale cel migratie en axon uitgroei afhankelijk van de status actief worden gereguleerd en progressie van regeneratieve processen35. Gliale cellen kunnen dienen als basis voor de gemanipuleerde cytoarchitecture van levende steigers, aangezien deze cellen verschillende ontwikkelings mechanismen in vivo bemiddelen. Tijdens de ontwikkeling van de hersenen rekenen nieuwe neuronen op basale processen met radiale glia verlengd van de ventriculaire zone naar de ontwikkelingslanden corticale plaat als levende steigers voor gestuurde migratie36,37. Anderzijds uitbreiding van groei kegels zijn getoond om te oriënteren zich door het aftasten van de aantrekkelijke en afstotend signalen ontlokte door markering gliale cellen, en zogenaamde “baanbrekende” axonen worden voorgesteld om de juiste doelstellingen bereiken door uitbreiding langs vooraf gedessineerde gliale steigers35,38,39. Gliale cellen zijn dus nodig voor de begeleiding van baanbrekende axonen, die later als axon gebaseerde dienen “levende steigers” om de projectie van “volger” axonen. Bovendien groei glia-gemedieerde mechanismen te volharden postnatale stadium manifesteren, zoals neuroblasten de rostraal migratoire stroom (RMS volgen) om te navigeren van de subventriculaire zone (SVZ), een van de weinige resterende gebieden van neurogenese in de volwassen hersenen, is aangetoond dat de bulbus olfactorius (OB)40. Deze neuroblasten in de RMS migreren binnen de gliale buis (figuur 1A-1), die bestaat uit de lengterichting uitgelijnde astrocytic processen, via directe cel verklevingen en een gelokaliseerde oplosbare factoren37, 41. ten slotte terwijl CNS schade in zoogdieren oorzaken verstoord astrocytic proces regeling vormen een gliale litteken dat fysiek axonale regeneratie17 belemmert, veel bij niet-zoogdieren systemen ontbreken de vorming van een schadelijk gliale litteken. Daarentegen handhaven gliacellen bij niet-zoogdieren soorten meer georganiseerd, patronen die worden gebruikt als gidsen door de benadeelde regio17,42,43uitgelijnd. Bijvoorbeeld, worden bij niet-zoogdieren SCI modellen, axonen getoond om te groeien in nauwe samenwerking met gliale bruggen oversteken van de laesie, suggereren een belangrijke rol voor georganiseerde gliale steigers als substraten axonale regeneratie en functionele herstel (te vergemakkelijken Figuur 1A -2) 42 , 44 , 45. recapitulatie van de neuroanatomische functies en de ontwikkelings/regeneratieve mechanismen zoals hierboven beschreven kan het opleveren van een nieuwe klasse van gemanipuleerde gliale gebaseerde levende steigers die gelijktijdig onvolwassen neuronale migratie kan rijden en axonale vastloper door anders niet-tolerante omgevingen, waardoor potentieel afzwakking van de gevolgen van neuronale en axon tract degeneratie geassocieerd met CNS letsel en ziekte.
Onze onderzoeksgroep heeft eerder ontworpen meerdere soorten levende steigers voor wederopbouw en herstel van axonale traktaten in het centraal zenuwstelsel en het perifere zenuwstelsel (PNS) via micro-weefsel ontworpen neurale netwerken (micro-TENNs) en weefsel gemanipuleerde zenuw transplantaties (TENGs), respectievelijk27,46,47,48. Beide strategieën zijn inherent gebaseerd op het biomimicry. Micro-TENNs zijn anatomisch-geïnspireerde structuren ontworpen ter vervanging van structureel en functioneel axonale traktaten verbinden verschillende neuronale populaties van de hersenen. TENGs exploiteren de ontwikkelingstoxiciteit mechanisme van axon-vergemakkelijkt axonale regeneratie, wordt geïllustreerd door “volger” axon groei langs “pionier” axonen, om gerichte host axonale regeneratie35,46,48. We onlangs gekapitaliseerd op de veelzijdigheid van de levende steiger techniek met behulp van een soortgelijke regeling omhulsel als micro-TENNs en op zoek naar inspiratie uit de glia gebaseerde mechanismen aanwezig in de gehele ontwikkeling. Hier, ontwikkelde we constructies bestaande uit uitgelijnde astrocytic bundels verspreid over de collagene lumen van een hydrogel micro-kolom49. Deze astrocytic levende steigers zijn ontwikkeld door het eerste vullen een vergadering van de capillaire buis-acupunctuur-naald met vloeibare agarose als u wilt maken van een holle cilindrische hydrogel met een buitendiameter (OD) en de binnendiameter (ID) overeenkomt met de diameter van de buis en needle, respectievelijk. Na agarose gelering en extractie van de hydrogel micro-kolom van de capillaire buis, de holle interieur is bekleed met type I collageen leveren een omgeving tolerant voor Astrocyt hechting en uitgelijnd bundel vorming (figuur 1B -1). Daarna is de lumen bezaaid met cerebrale corticale astrocyten geïsoleerd van postnatale rat pups (figuur 1B-2). In tegenstelling tot tweedimensionale (2D) uitlijning technieken die afhankelijk zijn van de toepassing van elektrische velden, micropatterned groeven en extracellulaire matrix (ECM) eiwitten patronen, Astrocyt uitlijning in het levende schavot techniek is gebaseerd op zelf-assemblage volgens controleerbare variabelen zoals substraat kromming (kolom-ID), celdichtheid en collageen concentratie50,51,52. De astrocyten contract remodelleren van de collageen en verwerven een bipolaire, overlangs uitgelijnde morfologie analoog aan de natuurlijke steigers waargenomen in vivo (figuur 1B-3). Inderdaad, we actief het gebruik van deze kabel-achtige structuren nastreven als fysieke substraten voor gerichte begeleiding van onrijpe neuronen migreren, alsmede het vergemakkelijken van axonale regeneratie via het ongunstige milieu van het beschadigde centraal zenuwstelsel, met name de zoogdieren gliale litteken (Figuur 1 c). Dit artikel zal presenteren de gedetailleerde fabricage methode voor de astrocytic micro-kolommen, fase contrast en immunofluorescentie beelden van de verwachte cytoarchitecture en een uitgebreide discussie over de huidige beperkingen en toekomstige richtingen van de techniek.
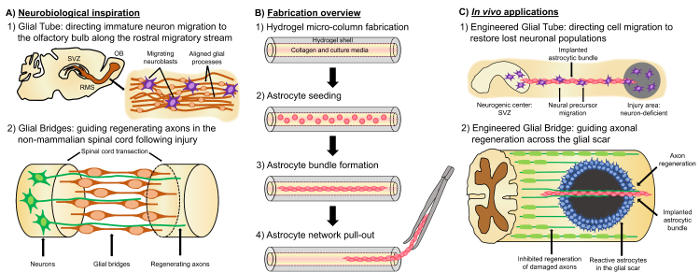
Figuur 1: inspiratie, Fabrication Protocol en voorgestelde toepassingen voor de uitgelijnde Astrocytic netwerken. (A) neurobiologische inspiratie: (1) neuroblasten die afkomstig zijn uit de neurogene subventriculaire zone (SVZ) gebruiken de lengterichting uitgelijnde gliale buis in de rostraal migratoire stroom (RMS) voor de geleide overgang naar de bulbus olfactorius (OB); (2) niet-zoogdieren zoals amfibieën en vis aankunnen regeneratie na zenuwweefsel beschadigen gedeeltelijk als gevolg van de vorming van een gliale brug verbindt de uiteinden van een laesie (bijvoorbeeld verbeelde ruggenmerg) en fungeert als een steiger voor de begeleiding van regenereren axonen. (B) fabricage overzicht: (1) de bouw van een micron-sized, holle hydrogel micro-kolom met de lumen bekleed met ECM, (2) zaaien van primaire corticale astrocyten geïsoleerd van postnatale rat pups, (3) zelf-assemblage van de lengterichting georiënteerde bundels in cultuur, en (4) extractie van de bundel van het omhulsel van de biomaterial voor toekomstige implantatie studies. (C) In vivo toepassingen: (1) deze levende steigers kunnen dienen als gemanipuleerde gliale buizen voor gestuurde neuron migratie van neurogene centra aan repopulate neuron-deficiënte regio’s; (2) de recapitulatie van de ontwikkelingstoxiciteit mechanisme van baanbrekende axon begeleiding en de regeneratieve mechanisme van gliale bruggen bij niet-zoogdieren kan deze astrocytic steigers met het vermogen om directe axon regeneratie over de niet-tolerante begiftigen omgeving van de zoogdieren gliale litteken. Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
In vergelijking met de meer ondersteunende omgeving voor de PNS, beperkt de CNS is met name bij de behandeling van de nadelige gevolgen van neurotrauma en neurodegeneratie. Na een ernstige belediging van de zoogdieren CNS, een gliale litteken gevormd, bestaande uit een kern van fibrotische en inflammatoire cellen omgeven door een dichte Zitschalen van ongeorganiseerd reactieve astrocyten die afscheiden van axon uitgroei-remmende proteoglycans14. Dit litteken fungeert als een fysische en biochemisc…
Declarações
The authors have nothing to disclose.
Acknowledgements
Financiële steun werd voorzien door de National Institutes of Health [U01-NS094340 (Cullen) & F31-NS090746 (Katiyar)], Michael J. Fox Foundation [therapeutische pijpleiding programma #9998 (Cullen)], Penn geneeskunde neurowetenschappen Center Pilot Award (Cullen) National Science Foundation [afgestudeerde Research Fellowships DGE-1321851 (Struzyna)], Department of Veterans Affairs [RR & D verdienste Review #B1097-ik (Cullen)], en de US Army medische Research en materieel opdracht [#W81XWH-13-207004 (Cullen) & W81XWH-15-1-0466 (Cullen)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
Referências
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

