三次元組織配置に発達メカニズムを要約し、神経系の再生を容易にするアストロ サイト ネットワーク
Summary
縦一直線に並べられたアストロ サイトの突起と新規の生体材料箱詰め内のプロセスの自己組織化、三次元の束の開発を紹介します。これらは「生活足場」、神経発達メカニズムを研究したり、演出の神経細胞移動や軸索再生に関するを促進するテストベッドとしてセンチメートル長さを拡張する可能性がありますまだミクロン径を展示設計草分け。
Abstract
頭部外傷、神経変性疾患は、失われた神経細胞を置き換えるし、軸索経路を再生成する中枢神経系 (CNS) の限られた容量のための神経学的な欠損を永続的によくあります。ただし、神経システムの開発、神経細胞移動と軸索の延長中にしばしば「生活の足場」と呼ばれる他の細胞によって形成された経路に沿って発生します。これらのメカニズムをエミュレートするために、中枢神経系の抑制性の環境を回避する戦略の設計を求めて、本稿では提案設計組織を作製するためのプロトコル アストロ ベース「生活足場」。これらの構成要素を作成するには、自己バイポーラ縦揃え突起とプロセスの高密度三次元バンドルにまとめるアストロ サイトを誘導する新規生体材料箱詰め方式を採用しました。最初、中空ゲル マイクロ列が組み立てていた、および内部ルーメンだったコラーゲン細胞外マトリックスでコーティングします。解離の大脳皮質アストロ サイト、マイクロ円柱との重要な内径の内腔に配信された < 350 μ m、自発的に自己整列し、密な束から成る長い繊維のようなケーブルを製造委託するにはアストロ サイトのプロセスおよび測定コラーゲン線維の 97% 生存率を携帯され事実上独占的、中間径フィラメント蛋白質グリア線維性酸性蛋白質 (GFAP), ビメンチンの組み合わせを表現して、ネスチンはアストロ サイトで構成されています。これらはアストロ サイト ネットワーク神経添付の寛容な基板を提供するために発見され、神経突起の伸展を整列配置されます。さらに、これらの構成要素は、整合性とハイドロゲルの箱詰めは、中枢神経系の注入に適してから抽出されるときの配置を維持します。これらの前もって形成された構造は構造的に自然発生するキー細胞要素をエミュレート グリア ベース「足場を生きている」 in vivo。など、これらの設計された生活の足場は、神経発達機構研究生体外でまたは神経移行および/または中枢神経系変性体内に続く軸索経路の指示により容易に再生に関するテスト ベッドとして可能性があります。.
Introduction
中枢神経系 (CNS)、限られた容量の損失および/またはニューロンと外傷性脳損傷 (TBI) などの条件を伴う軸索経路の機能不全を打ち消すために脳卒中、脊髄損傷 (SCI) と神経変性疾患1 ,2,3,4,5。中枢神経系における神経新生は、失われたニューロン6、7の復元を妨げる、脳内領域の限られた数に制限されます。さらに、失われた中枢神経系軸索経路の再生は十分な監督指導の欠如、伸長阻害剤および神経組織2,8への損傷、次反応性アストロ サイトの増生の存在により 9,10。アストロ サイトは通常、イオン恒常性、神経伝達物質のクリアランス、シナプス形成、神経血管11を結合ニューロンの支援に多様な機能を持っています。それにもかかわらず、次の神経組織にも軽度の損傷、アストロ サイト変わることがあります分子・構造・機能肥大状態11に移行していくようです。重症頭部外傷に対しては、これらの変更は移行反応性アストロ サイトと破裂血液脳関門 (BBB)、ミクログリアから流出した白血球を含む病変コアを含む半影と傷跡の形成の結果します。オリゴデンドロ サイト、および線維芽細胞11,12,13。これらの反応性アストロ サイトは糸状、解体プロセスの形態を達成して中間径フィラメント蛋白質および神経再生12を妨げるコンドロイチン硫酸プロテオグリカン (CSPGs) の発現の増加を展示します。にもかかわらず、グリア瘢痕最初 BBB の整合性を復元し、周囲の健康な組織に炎症性応答の送信を避けることができます、それは軸索再生12,14 に対して物理・生化学的バリアとして機能します。 ,,1516。例えば、グリア瘢痕が発生する軸索は球根の栄養障害による成長円錐を表示し、発育成長12。さらに、星状膠細胞の傷害の後の解体は、再生軸索17の拡張を妨げます。これらの抑制特性の結果、TBI、科学を含む重度の頭部外傷後の患者は苦しむ多くの場合永久的な物理的および神経学的な障害で明らかに
外因性課題中枢神経系機能の再生、関係なく軸索が再生する本質的な能力を所有する示されています。例えば、グリア瘢痕と接触して栄養障害による成長円錐の動的な性質は、これらの終末が12を拡張するための能力を保持することを示唆します。したがって、受傷後の中枢神経系のグリア瘢痕・傷跡再生橋になる提供を減らすことでより寛容な環境を提供する抑制性の環境を軸索再成長への主な障害にはいわれています。有利であります。確かに、以前の研究は中枢神経系ニューロンが軸索軸索再生12,18のより好ましい環境を現在のブリッジとして末梢神経移植を使用して病変を拡張することができることを実証しています。 19。他のいくつかの戦略は、この痕跡の再生能力を悪用する追求されています。たとえば、さまざまな傷害モデルにおける細胞成長シグナル伝達経路の操作は、軸索再生とグリア瘢痕削減10,20,21になりました。さらに、研究はコンドロイチナーゼ ABC は、CSPGs の糖鎖の大半を裂く、治療が反応性アストロ サイト22から分泌される CSPGs の抑制効果を減少することを示しています。結果の奨励にもかかわらず、これらのアプローチは監督の迷入再生12、ことがあります、またニューロンの損失を考慮しない成長円錐ガイダンスを提供しています。セル ベースのアプローチは、グリア瘢痕の与える影響を克服するため、失われた細胞、特に神経細胞を補充するための試みで利用されています。いくつかのグループが脱分化型反応性アストロ サイトのニューロンに損傷領域を再作成し、軸索再生23,24,を促進する中枢神経系病変に神経前駆細胞を移植したが他の中25します。 ただし、幹細胞移植だけでは生存率が低、統合が不完全と損傷した組織5ささやかな保有期間によって制限されます。さらに、これらのセルに基づく戦略は、制御された方法で特に長距離軸索路を復元に失敗します。したがって、他のアプローチとの組み合わせで生体材料は、様々 な神経の配送車として検討されています、前駆細胞と成長因子26。生体材料ベースのアプローチの高度な特定の物理的な haptotaxic を模した構造を生成する設計制御機能し、ターゲット ホスト組織27の三次元 (3 D) の微小環境に存在する chemotaxic キュー 28,29,30,31,32,33,34。これらの環境の信号の再現は、ネイティブのような形態、増殖、移行、および他の神経生物学特性29の間で、シグナリングを提示する移植細胞の最も重要です。これらの有利な性質にもかかわらずシード従来の携帯バイオマテリアル足場を超えて進歩は同時に監督の長距離軸索再生を促進し、失われた神経細胞を置き換える必要です。
ネイティブ神経解剖学をエミュレートする前もって形成された細胞構築と神経細胞の存在のため他のセル ベースのアプローチとは異なる「生活の足場」、有望な代替手法は、神経ティッシュ エンジニア リングおよび/または対象となる交換、再建そして神経回路4,35の再生を容易にする機構。生活の足場の設計に関する考慮事項は、表現型、機械・物理プロパティと同様に、神経細胞の源および生化学的なシグナルは任意の付随のバイオマテリアル35の組成によって決まります。生体外作製後、これらの生活の足場注入体内細胞接着分子と走化性、神経信号を神経細胞移動と軸索伸長の状態に応じて積極的に調整して再生の進行は、35を処理します。グリア細胞は、これらの細胞は、生体内のさまざまな発達のメカニズム仲介以来生活の足場の設計研究のための基礎として使用できます。脳の発達中に新しい神経細胞は、基底プロセスの指示移行36,37の生活の足場として発展途上の骨皮質骨板に向けた心室ゾーンから放射状グリア細胞による拡張に依存します。さらに、グリア済みパターンに沿って拡張することによって正しいターゲットに到達する示唆、錐体は、グリア道標細胞によって誘発される魅力的で撥の信号を感知して自体の向きを示すといわゆる「先駆的な「軸索成長の拡張骨格の35,38,39。したがって、グリア細胞は軸索、後に軸索ベースを提供する先駆的な指導のために必要な「生活足場」「追従」の軸索投射を指示します。また、グリア細胞を介した成長機構が神経芽細胞下帯 (SVZ) 成体脳における神経新生のいくつかの残りの部分のいずれかから移動する (RMS) 吻側渡り鳥ストリームに従ってください、後天的、保持するために示されている、嗅球 (OB)40。直接細胞接着斑での縦揃えのアストロ プロセスは構成され、可溶性因子37,をローカライズ グリア管 (図 1 a-1) 内に RMS でこれらの神経を移行します。41します。 最後に、哺乳類の原因で傷ついた中断するアストロ サイト プロセス配置軸索再生17を物理的に阻害するグリア瘢痕形成と、多くの非哺乳類システムを欠いている有害なグリア瘢痕の形成。むしろ、非哺乳類種のグリア細胞維持組織、負傷した領域17,42,43をガイドとして使用されるパターンを配置しました。例えば、非哺乳類科学モデル、軸索の軸索の再生と機能回復 (促進する基板としてグリア足場の組織の重要な役割を示唆している病変のグリア橋と密接な関係に成長する表示されます。図 1A-2)42,44,45反復の神経解剖学的機能と上述の発達/再生機構が未熟な神経細胞移動をドライブすることができます同時に設計されたグリア ベースの生活の足場の新しいクラスをもたらす可能性があります、軸索。そうでなければ寛容な環境では、神経の影響を軽減させる可能性がありますを草分けと中枢神経系の損傷や疾患に関連付けられている軸索路変性。
我々 の研究グループは複数の種類の生活復興のため足場を設計して以前とマイクロ組織を介して末梢神経系 (PNS)、中枢神経系の軸索路の再生設計ニューラル ネットワーク (マイクロ TENNs) と組織神経移植 (TENGs)、それぞれ27,46,47,48を設計されています。両方の戦略は、バイオミミ クリーに本質的に基づいています。マイクロ TENNs は、解剖学的に触発された構造の構造的、機能的脳の異なる神経細胞の集団を接続する軸索路を置き換えるために設計です。TENGs 軸索促進の軸索の再生をターゲット ホスト軸索再生35,46,48を達成するために、「パイオニア」の軸索に沿って”追従”の軸索成長に代表される発達のメカニズムを利用します。我々 は最近、生活足場の汎用性を資本金法マイクロ TENNs として箱詰め、同様のスキームを使用して、グリア細胞ベースのメカニズムからのインスピレーションを求めて開発全体を通して提示します。ここでは、ハイドロゲル マイクロ列49の膠原線維の内腔にまたがる整列アストロ サイトの束から成る構造を開発しました。これらのアストロ サイト生活の足場が開発の直径に対応する外径 (OD) と内径 (ID) 中空円筒状のゲルを作成する液体の agarose が付いてキャピラリー チューブ鍼針アセンブリを記入、管、針、それぞれ。Agarose のゲル化とキャピラリー チューブからゲル マイクロ列の抽出、中空のインテリアはタイプ私アストロ接着のために寛容な環境を供給するコラーゲンをコーティングし、束形成 (図 1 bを揃え-1)。その後、内腔は生後仔 (1 b を図-2) から分離された大脳皮質アストロ サイトとシードします。二次元 (2 D) 配置手法 (ECM) タンパク質パターンニング、電界、マイクロパターニングゲル溝と細胞外マトリックスのアプリケーションに依存している生活の足場でアストロ配置に反する手法では, 自己組織化基板曲率 (ID 列)、細胞密度、コラーゲン濃度50,51,52などの制御可能な変数に基づいています。アストロ サイトは契約し、コラーゲンをフルモデル チェンジし、バイポーラ、縦配置の形態観察生体内で(図 1 b-3) 自然な足場に似ていますを取得します。確かに、進めてこれらのケーブルのような構造の使用特に破損した CNS の不利な環境による軸索再生を促進することと同様、未熟な神経細胞の移行の対象となる指導のため物理的な基質として哺乳類グリア瘢痕 (図 1)。この記事はアストロ サイトのマイクロ列の詳細な製作方法を提示する、位相コントラスト蛍光イメージの予想される細胞構築と現在の制限に関する包括的な議論と今後の方向性、技術。
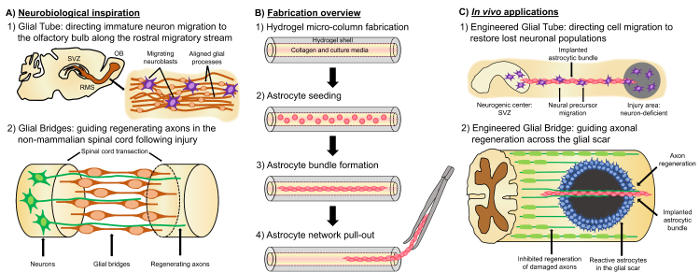
図 1: インスピレーション、作製プロトコル、および整列のアストロ サイト ネットワークの提案されたアプリケーション。(A) 神経生物学のインスピレーション: (1) 神経芽細胞由来神経因性脳室下帯 (SVZ) を利用 (OB); 嗅球に向かって指示の移行で吻側の渡り鳥ストリーム (RMS) に縦一直線に並べられたグリア チューブ(2) 両生類や魚など非哺乳類神経組織の一部病変 (例えば切断脊髄) の両端を接続しの指導のための足場としてグリア橋の形成に起因する損傷後の再生を耐えることができます。軸索の再生。(B) 製造の概要: ミクロン サイズの中空ゲル マイクロ段 ECM、被覆ルーメンの構築 (1) (2) ラットの子犬で、縦型の (3) 自己組織から分離された主な皮質アストロ サイトの播種文化、将来移植研究のための生体材料箱詰めからバンドルの (4) の抽出のバンドル。(C)体内のアプリケーション: (1) これらの生活の足場はニューロン欠損領域を再作成する神経因性センターから指示されたニューロン移行のため設計されたグリア チューブとして可能性があります(2) の軸索ガイダンスを先駆的な発達のメカニズムと再生機構非哺乳類におけるグリア橋の反復可能性があります非寛容で軸索の再生を指示する容量を持つこれらのアストロの足場を授ける哺乳類のグリア瘢痕の環境。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
PNS のより協力的な環境と比較して、中枢神経系特に頭部外傷、神経変性の有害な結果の処理に制限されます。哺乳類の中枢神経系への深刻な侮辱、グリア瘢痕が形成されると、軸索の伸長を阻害するプロテオグリカン14を分泌する無秩序の反応性アストロ サイトの密な網目に囲まれた線維化と炎症性細胞の核心から成る。この傷跡は、軸索終末12の再生に?…
Declarações
The authors have nothing to disclose.
Acknowledgements
財政支援と定められた国立衛生研究 [U01 NS094340 (カレン) ・ F31 NS090746 (Katiyar)]、マイケル ・ j ・ フォックス財団 [治療パイプライン プログラム #9998 (カレン)]、Penn 医学神経科学センター パイロット賞 (カレン)国立科学財団 [大学院研究奨学金 DGE-1321851 (Struzyna)]、復員部 [RR & D メリット レビュー #B1097-私 (カレン)]、陸軍衛生研究と資材コマンド [#W81XWH-13-207004 (カレン) &W81XWH-15-1-0466 (カレン)]。
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
Referências
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

