Astrocyte ağlar gelişimsel mekanizmaları özetlemek ve sinir sistemi yeniden oluşturma işlemi kolaylaştırmak için tasarlanmış üç boyutlu doku uyumlu
Summary
Biz kendi kendine montajı, üç boyutlu demetleri boyuna hizalanmış astrositik somata ve süreçlerin bir roman biomaterial encasement içindeki gelişimi vitrin. Bunlar “yaşam iskele santimetre uzunluğunda, genişletme hizmet edebilir henüz test-yatak nörogelişimsel mekanizmaları incelemek veya yönetmenlik nöronal göç ve/veya aksonal neuroregeneration kolaylaştırmak için mikron çaplı çapı sergileyen”, mühendislik kılavuz.
Abstract
Neurotrauma ve nörodejeneratif hastalık genellikle neden kayıp nöronlar değiştirmek ve aksonal yolları yeniden oluşturmak için merkezi sinir sistemi (MSS) sınırlı kapasitesi nedeniyle nörolojik açıkları kalıcı. Ancak, sinir sistemi gelişimi, nöronal göç ve aksonal uzantısı sırasında sık sık “yaşam iskele” anılacaktır diğer hücreleri tarafından kurulan yollar boyunca oluşur. Bu mekanizmalar taklit etmek ve MSS inhibitör ortamının circumvents bir strateji tasarlamak için arayan, bu el yazması mühendislik doku imal etmek bir protokol sunar astrocyte tabanlı “yaşam iskele”. Bu yapıları oluşturmak için kendi kendine bipolar somata boyuna hizalanmış ve süreçlerin yoğun üç boyutlu demetleri monte astrocytes ikna etmek için bir roman biomaterial mantolama düzeni çalıştırmaya başladık. İlk, içi boş hidrojel mikro-sütunları toplandı ve iç Lümen kollajen hücre dışı-matriks ile kaplanmış. Disosiye serebral kortikal astrocytes sonra silindirik mikro-sütun ve kritik iç çapı, Lümen içine teslim < kendiliğinden kendini hizalanmış ve yoğun demetleri oluşan uzun elyaf benzeri kabloları üretmek için sözleşmeli 350 µm astrocyte süreçleri ve kollajen liflerinde ölçme % 97’si hücre canlılığı ve neredeyse sadece edildi bir arada ara filaman proteinler fibrillary gliyal asidik protein (GFAP’nin), vimentin, ifade ve testin astrocytes oluşur. Bunlar ağlar için nöronal ek izin veren bir substrat sağlamak bulundu ve neurite uzantısı uyumlu astrocyte uyumlu. Ayrıca, bu yapıları korumak bütünlüğü ve CNS implantasyon için uygundur hidrojel mantolama üzerinden ayıklandığında hizalama. Bu ön şekillendirilmesi yapıları, yapısal olarak doğal olarak meydana gelen anahtar cytoarchitectural öğeleri taklit “iskele yaşayan” içinde vivogliyal tabanlı. Bu nedenle, bu mühendislik yaşam iskele nörogelişimsel mekanizmaları vitro çalışma veya neuroregeneration nöronal göç ve/veya CNS dejenerasyon içinde vivo takiben aksonal kılavuz yönlendirerek kolaylaştırmak için test-yatak olarak hizmet verebilir .
Introduction
Merkezi sinir sistemi (MSS) kaybı ve/veya nöronlar ve travmatik beyin hasarı (TBY), gibi koşullar eşlik aksonal yolları disfonksiyon karşı koymak için sınırlı bir kapasiteye sahip inme, omurilik yaralanma (SCI) ve nörodejeneratif hastalık1 ,2,3,4,5. MSS neurogenesis beyin, kayıp nöronlar6,7restorasyonu engelleyici alanda sınırlı sayıda sınırlıdır. Ayrıca, MSS kayıp aksonal yollar rejenerasyon yönlendirilmiş rehberlik eksikliği, akıbet inhibitörleri ve reaktif astrogliosis sinir dokusu2,8‘ ehasar takip varlığı nedeniyle yetersiz olduğunu, 9,10. Astrocytes genellikle nöronlar iyon Homeostazı, nörotransmitter gümrükleme, sinaps oluşumu ve11kaplin nörovasküler yardımcı çeşitli işlevlere sahiptir. Yine de, onlar Hipertrofik devlet11‘ e geçiş olarak sinir dokusu hatta hafif hasar, moleküler, yapısal ve fonksiyonel değişiklikleri astrocytes meydana gelebilir. Şiddetli neurotrauma yanıt olarak, bu bir yara oluşumuna geçirme reaktif astrocytes ve parçalanmış kan – beyin bariyerini (BBB), microglia sızan lökosit içerir bir lezyon çekirdek içeren bir penumbra ile değiştirilmesinden, oligodendrocytes ve fibroblastlar11,12,13. Bu reaktif astrocytes ipliksi, dağınık süreçlerin bir Morfoloji ulaşmak ve ara filaman proteinler ve nöral rejenerasyon12engel kondroitin sülfat Proteoglikanlar (CSPGs), artan ifadesi sergilemek. Gliyal yara başlangıçta BBB bütünlüğünün ve sağlıklı dokuyu çevreleyen inflamatuar yanıtın iletimini önlemek yardımcı olur olsa bile, bu axon rejenerasyon12,14 karşı fiziksel ve biyokimyasal bariyer olarak hizmet vermektedir ,15,16. Örneğin, gliyal yara karşılaşma aksonlar soğanlı distrofik büyüme koniler görüntülemek ve büyüme12bodur. Ayrıca, astrositik süreçleri dağınıklığı yaralanma sonra aksonlar17Yenileyici uzantısı engellemektedir. Bu inhibitör özellikleri sonucu hastaların Tby ve bilimler de dahil olmak üzere ağır neurotrauma sonra acı kez kalıcı fiziksel ve nörolojik bozukluklar içinde kendini gösteriyor
MSS fonksiyonel rejenerasyon karşı karşıya dışsal sorunları ne olursa olsun, akson yeniden oluşturmak için içsel bir yeteneğine sahip gösterilmiştir. Örneğin, gliyal yara ile temas distrofik büyüme koniler dinamik doğası bu sonlar12genişletmek için kapasitelerini korur düşündürmektedir. Sonuç olarak, bu aksonlar yeniden büyüme için bir ana engel sonrası yaralanma CNS ve gliyal skarlasma ve/veya yara izi arasında rejeneratif köprüler olurdu sağlayan azaltılması yoluyla fazla izin veren bir ortam sağlayan inhibitör bir ortamdır inanılıyor avantajlı. Gerçekten de, önceki çalışmalarda CNS nöronlar aksonlar periferik sinir grefti axon rejenerasyon12,18için daha uygun bir ortam mevcut köprüler olarak kullanarak bir lezyon üzerinden uzanan yetenekli olduğunu göstermiştir, 19. Çeşitli stratejiler tüylerinin bu rejeneratif kapasite yararlanma takip edilmiştir. Örneğin, hücre büyüme sinyal yolları çeşitli yaralanma modellerinde manipülasyon aksonal rejenerasyon ve gliyal yara izi azaltma10,20,21sonuçlandı. Ayrıca, çalışmalar chondroitinase şeker zincirleri çoğunluğu CSPGs içinde cleaves, ABC ile tedavi CSPGs reaktif astrocytes22tarafından salgılanan inhibitör etkisini azaltır göstermiştir. Rağmen cesaret verici sonuçlar, bu yaklaşımların potansiyel anormal rejenerasyon12‘ neden olabilir ve aynı zamanda nöronların kaybı için hesap yapmak büyüme koniler rehberliğinde yönetmen sağlamaz. Hücre tabanlı yaklaşımlar girişimleri gliyal yara etkilerini aşmak için ve kayıp hücreleri, özellikle sinir hücreleri doldurmak için kullanılmıştır. Diğerleri yaralanma alanı yeniden doldurmanız ve akson rejenerasyon23,24, teşvik CNS lezyonları nöral progenitör hücre nakli sırasında bazı gruplar reaktif astrocytes nöronlar dediferansiye 25. ancak, kök hücre transplantasyonu tek başına düşük sağkalım oranları, zavallı entegrasyon ve hasarlı doku5mütevazı saklama ile sınırlıdır. Ayrıca, hücre tabanlı strateji de uzun mesafe aksonal yolları, özellikle denetimli bir biçimde geri yüklemek başarısız. Bu nedenle, biyomalzemeler diğer yaklaşımlar ile birlikte teslim araçlar için çeşitli sinir incelenmiştir ve progenitor hücreler ve büyüme faktörleri26. Biomaterial tabanlı yaklaşımlar tasarım denetimi belirli fiziksel, haptotaxic taklit yapıları üretmek için yüksek derecede özelliği ve hedef ana bilgisayar doku27üç boyutlu (3D) microenvironment içinde chemotaxic ipuçları sunmak, 28,29,30,31,32,33,34. Bu çevre sinyalleri çoğaltılması yerli benzeri Morfoloji, nükleer silahların yayılmasına karşı geçiş ve, sinyal29arasında diğer nörobiyolojik özellikleri sunmak nakledilen hücreler için her şeyden önemlidir. Bu avantajlı özellikleri rağmen geleneksel hücre tohumlari biomaterial iskele ötesinde gelişme aynı anda yönettiği uzun mesafe aksonal rejenerasyon teşvik ve kayıp nöronlar değiştirmek için gereklidir.
Alternatif bir yaklaşım sinir dokusu üzerinde dayanır umut verici bir “yaşam sinir hücreleri ile yerel Nöroanatomi öykünür bir ön şekillendirilmesi cytoarchitecture varlığı nedeniyle diğer hücre tabanlı yaklaşımlar farklıdır yaşam iskele”, mühendislik ve/veya hedeflenen değiştirme, yeniden yapılanma ve yeniden nöro çevrim4,35oluşturulmasını kolaylaştırmak için gelişimsel mekanizmaları. Yaşam iskele tasarımı için önemli noktalar fenotipleri ve sinir hücreleri gibi mekanik/fiziksel özellikleri kaynakları ve biyokimyasal sinyalleri herhangi bir eşlik eden Biyomalzeme35kompozisyon tarafından dikte. İmalat vitrosonra bu yaşam iskele implante vivo içinde mevcut hücre adezyon molekülleri ve kemotaktik olabilir ve Nörotrofik sinyalleri aktif sinir hücre göç ve akson akıbet durumuna bağlı olarak düzenleyen ve rejeneratif ilerlemesini35işler. Bu hücreler çeşitli gelişimsel mekanizmaları vivo içindearacılık beri gliyal hücreler yaşam iskele mühendislik cytoarchitecture için bir temel olarak hizmet verebilir. Beyin gelişimi sırasında Bazal süreçleri yaşayan iskele yönlendirilmiş geçiş36,37için olarak gelişmekte olan kortikal plaka doğru ventrikül bölgeden Radyal glia tarafından genişletilmiş yeni nöronlar güveniyor. Ayrıca, kendilerini çekici ve itici sinyalleri gliyal Işaret hücreleri tarafından elde edildi algılama tarafından yönlendirmek için gösterilen ve sözde “aksonlar öncü” koniler büyüme uzanan önerilir boyunca önceden desenli gliyal genişleterek doğru hedeflere ulaşmak için 35,38,39iskele. Böylece, gliyal hücreler daha sonra olarak axon tabanlı hizmet aksonlar öncülük etmek için sağlanan bilgilerde açıklanan gerekli olan “yaşam iskele” projeksiyon “takipçisi” akson ve yönlendirmek için. Ayrıca, büyüme glia aracılıklı mekanizmalar olarak rostral göçmen akışı (RMS) bölgesinden subventricular (SVZ), bir yetişkin beyninin neurogenesis birkaç diğer alanlarında gezinmek için neuroblasts takip postnatally, kalıcı olması için gösterilmiştir olfaktör ampul (OB)40. Bu neuroblasts RMS boyuna hizalanmış astrositik oluşum, doğrudan hücre-hücre yapışıklıklar yolu ile oluşan ve çözünür faktörler37, lokalize gliyal tüp içinde (şekil 1A-1), göç 41. memeliler nedenleri CNS hasar fiziksel olarak aksonal rejenerasyon17engellemektedir gliyal bir yara izi oluşturan astrositik işlem düzenleme kesintiye iken, son olarak, birçok memeli sistemi zararlı gliyal yara oluşumu eksikliği. Daha doğrusu, Sigara memeli türlerinin gliyal hücreler daha organize, yaralı bölge17,42,43kılavuzları olarak kullanılan desenler hizalı korumak. Örneğin, memeli SCI modellerinde, gliyal köprüler yüzeylerde aksonal rejenerasyon ve fonksiyonel iyileşme (kolaylaştırıcı olarak organize gliyal iskele için önemli bir rol düşündüren lezyon, geçiş ile yakın ilişki içinde büyümeye aksonlar gösterilir Şekil 1A -2) 42 , 44 , 45. tekrarlama nöroanatomik özellikleri ve yukarıda açıklanan gelişimsel/rejeneratif mekanizmaları aynı anda olgunlaşmamış nöronal göç sürebilirim mühendislik gliyal tabanlı yaşam iskele yeni bir sınıf verim ve aksonal Bunun aksi halde keyfi ortamlar, böylece potansiyel olarak nöronal etkilerini Azaltıcı aracılığıyla ve akson yolu dejenerasyonu CNS yaralanma ve hastalık ile ilgili.
Bizim araştırma grubu daha önce yaşayan iskele yeniden inşası için birden çok türde Dizayn ve rejenerasyon aksonal yollarini MSS ve mikro-doku ile periferik sinir sistemi (PNS) sinir ağları (mikro-TENNs) ve doku Mühendisliği sinir grefti (TENGs), sırasıyla27,46,47,48mühendislik. Hem stratejileri doğal olarak Biyomimikri üzerinde temel alır. Mikro-TENNs yapısal ve işlevsel olarak beynin farklı nöron popülasyonları bağlanma aksonal yolları değiştirmek için tasarlanmış anatomik olarak ilham yapılardır. TENGs gelişimsel mekanizması “takipçisi” axon büyüme hedeflenen ana bilgisayar aksonal rejenerasyon35,46,48elde etmek için “öncü” akson boyunca örneği axon kolaylaştırdı aksonal rejenerasyon yararlanmak. Biz son zamanlarda yaşayan iskele çok yönlülük büyük harfle tekniği benzer bir encasement şeması mikro-TENNs ve glia tabanlı mekanizmaları ilham arayan mevcut geliştirme. Burada, kolajen Lümen hidrojel mikro-sütun49kapsayan hizalanmış astrositik demetleri oluşan yapıları geliştirdik. Bu astrositik yaşam iskele çapları için karşılık gelen bir içi boş silindirik hidrojel bir dış çap (OD) ve iç çapı (ID) ile oluşturmak için bir kılcal tüp-akupunktur iğne derleme sıvı özel ile doldurarak geliştirilir tüp ve iğne, anılan sıraya göre. Özel jelleşme ve hidrojel mikro-sütun çıkarma kılcal tüp, içi boş iç kısmıdır kaplı türü ile ben astrocyte yapışma için izin veren bir ortam sağlamak için kollajen ve paket oluşumu (şekil 1B uyumlu -1). Daha sonra lumen postnatal fare pups (şekil 1B-2) izole serebral kortikal astrocytes ile seribaşı. Elektrik alanları, micropatterned oluklar ve hücre dışı matriks uygulanması (ECM) protein desenlendirme, itimat iki boyutlu (2D) hizalama teknikleri astrocyte uyum içinde yaşayan iskele aksine tekniği üzerinde kendinden montajlı dayanıyor substrat eğriliği (sütun Kımlığı), hücre yoğunluğu ve kollajen konsantrasyonu50,51,52gibi kontrol değişkenleri göre. Astrocytes sözleşme ve kollajen yeni model ve iki kutuplu, boyuna hizalı Morfoloji vivo içinde (şekil 1B-3) gözlenen doğal iskele benzer elde etmek. Nitekim, biz aktif olarak bu kablo benzeri yapıların kullanımını hedeflenen rehberlik olgunlaşmamış nöronlar geçiş hem de özellikle bozuk MSS olumsuz ortamı üzerinden aksonal rejenerasyon kolaylaştırmak için fiziksel yüzeyler olarak devam ediyor memeli gliyal yara (şekil 1 c). Bu makalede, astrositik mikro-sütunlar için detaylı imalat yöntemi mevcut beklenen cytoarchitecture ve mevcut kısıtlamaları üzerinde kapsamlı bir tartışma kontrast ve ayirt görüntülerini ve gelecekteki yönleri faz tekniği.
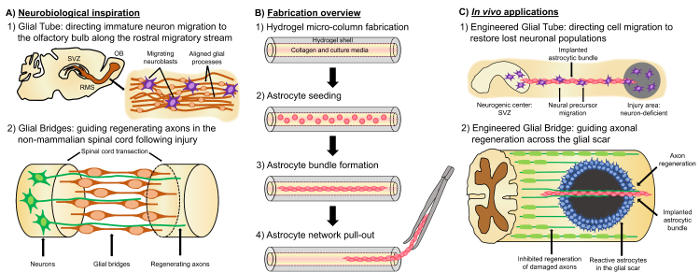
Şekil 1: ilham, imalat Protokolü ve hizalanmış astrositik ağlar için Önerilen uygulamalar. (A)nörobiyolojik ilham: (1) Neuroblasts Nörojenik subventricular bölgesinden (SVZ) kaynaklı boyuna hizalanmış gliyal tüp rostral göçmen akışı (RMS) olfaktör ampul (OB); doğru yönlendirilmiş geçiş için kullanmak (2) sonra sinir dokusuna zarar kısmen-bir lezyon (örneğin kopuk spinal kord) ucuna bağlanan ve rehberlik için bir iskele olarak hizmet veren bir gliyal köprü oluşumu nedeniyle kurbağa ve balık gibi sigara-memeliler rejenerasyon ayakta olabilir akson yeniden oluşturuluyor. (B) imalat genel bakış: mikron büyüklüğünde, içi boş hidrojel mikro-sütun ECM ile kaplı Lümen ile inşaat (1) (2) postnatal fare pups (3) kendinden montajlı, boyuna yönelik izole birincil kortikal astrocytes, tohum Kültür ve paket (4) çekme–dan biomaterial mantolama gelecekteki implantasyon Etütler demetleri. (C) In vivo uygulamaları: (1) bu yaşam iskele mühendislik gliyal tüpler için yönlendirilmiş nöron göç–dan nöron eksikliği bölgeleri; yeniden oluşturulacaktır için Nörojenik merkezleri olarak hizmet verebilir (2) tekrarlama axon rehberlik öncülük etmek gelişimsel mekanizması ve sigara-memelilerde gliyal köprüler rejeneratif mekanizması ile axon rejenerasyon sigara-keyfi arasında yönlendirmek için kapasite astrositik bu iskele bağışlamak memeli gliyal yara ortamı. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protocol
Representative Results
Discussion
PNS daha destekleyici bir ortam için karşılaştırıldığında, MSS özellikle zararlı sonuçları neurotrauma ve ateş işleme sınırlıdır. Memeli CNS ciddi bir hakaret sonra gliyal bir yara izi oluşan bir çekirdek axon akıbet inhibe Proteoglikanlar14salgılar dağınık reaktif astrocytes yoğun bir meshwork tarafından çevrili fibrotik ve inflamatuar hücre oluşan. Bu yara izi akson uçları12rejenerasyon karşı fiziksel ve biyokimyasal tıkanıklığı gib…
Declarações
The authors have nothing to disclose.
Acknowledgements
Mali destek sağlanan ulusal sağlık Enstitüleri [U01-NS094340 (Cullen) ve F31-NS090746 (Katiyar)], Michael J. Fox Vakfı [tedavi boru hattı Program #9998 (Cullen)], Penn tıp Neuroscience Center Pilot Ödülü (Cullen), tarafından Ulusal Bilim Vakfı [yüksek lisans araştırma bursu DGE-1321851 (Struzyna)], Department of Veterans Affairs [RR & D hak gözden #B1097-ben (Cullen)] ve ABD Ordusu tıbbi araştırma ve gereç komut [#W81XWH-13-207004 (Cullen) & W81XWH-15-1-0466 (Cullen)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
Referências
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

