Tredimensionella vävnadstekniska justerad Astrocyten nätverk att Recapitulate utvecklingsmässiga mekanismer och underlätta nervsystemet regenerering
Summary
Vi visa upp utvecklingen av själv monterade, tredimensionell buntar av längdriktningen justerad astrocytic somata och processer inom en roman biomaterial fodral. Dessa konstruerade ”levande ställningar”, uppvisar micron-skala diameter ännu att utvidga centimeter i längd, kan fungera som test-sängar att studera nervsystemets mekanismer eller underlätta neuroregeneration av rikta neuronala migration och/eller axonal pathfinding.
Abstract
Neurotrauma och neurodegenerativa sjukdomen ofta resultera i bestående neurologiska bortfall på grund av den begränsade kapaciteten på det centrala nervsystemet (CNS) att ersätta förlorade nervceller och regenerera axonal vägar. Dock under nervsystemet utveckling, neuronala migration och axonal förlängning ofta uppstå längs vägar som bildas av andra celler, kallad ”levande ställningar”. Detta manuskript strävar efter att efterlikna dessa mekanismer och utforma en strategi som kringgår den hämmande miljön i CNS, och presenterar ett protokoll för att fabricera vävnadstekniska Astrocyten-baserade ”levande ställningar”. För att skapa dessa konstruktioner, anställt vi en roman biomaterial fodral systemet att inducera astrocyterna att själv montera i tät tredimensionella buntar av bipolär longitudinellt-anpassade somata och processer. Första, ihåliga hydrogel mikro-kolumner var samlade, och inre lumen var belagda med kollagen-extracellulärmatrix. Dissocierade cerebral kortikal astrocyter levererades sedan in i lumen för cylindriska mikro-kolumnen och vid en kritisk inre diameter på < 350 µm, spontant själv arrangera i rak linje och kontrakterade att producera långa fiber-liknande kablar bestående av täta buntar Astrocyten processer och kollagen fibriller mäta 97% cellviabilitet och var nästan uteslutande består av astrocyter uttrycker en kombination av mellanliggande glödtråden proteiner glial fibrillary sura protein (Fredsgenomförande), vimentin, och nestin. Dessa linje Astrocyten nätverk hittades för att tillhandahålla ett tillåtande substrat för neuronal fastsättning och anpassad neurite förlängning. Dessutom upprätthålla dessa konstruktioner integritet och anpassning när den extraheras från den hydrogel fodral, vilket gör dem lämpliga för CNS implantation. Dessa förformade konstruktioner emulera strukturellt viktiga cytoarchitectural element av naturligt gliaceller-baserade ”living ställningar” in vivo. Som sådan, kan dessa konstruerade levande ställningar fungera som test-sängar att studera nervsystemets mekanismer i vitro eller underlätta neuroregeneration genom att rikta neuronala migration och/eller axonal pathfinding efter CNS degeneration i vivo .
Introduction
Det centrala nervsystemet (CNS) har begränsad förmåga att motverka den förlust eller dysfunktion av nervceller och axonal vägar som åtföljer villkor såsom traumatisk hjärnskada (TBI), stroke, ryggmärgen skadan (SCI) och neurodegenerativa sjukdomen1 ,2,3,4,5. Neurogenes i CNS är begränsad till ett begränsat antal områden i hjärnan, hämmar återställandet av förlorade nervceller6,7. Dessutom är regenerering av förlorade axonal vägar i CNS otillräcklig på grund av bristen på riktad vägledning, förekomsten av utväxt hämmare och reaktiva astrogliosis efter skada till nervvävnad2,8, 9,10. Astrocyterna har vanligtvis olika funktioner hjälpa nervceller med ion homeostas, signalsubstansen clearance, synaps bildas och neurovaskulära koppling11. Dock efter även lindriga skador till nervvävnad, kan astrocyter genomgå molekylär, strukturella och funktionella förändringar som de övergången till en hypertrofisk stat11. Svar på svåra neurotrauma resultera ändringarna i bildandet av ett ärr med en penumbra innehållande migrerar reaktiva astrocyter och en lesion kärna som innehåller leukocyter som läckt ut från en brusten blod – hjärnbarriären (BBB), mikroglia, oligodendrocyter och fibroblaster11,12,13. Dessa reaktiva astrocyter uppnå en morfologi av trådformiga, oorganiserad processer och uppvisar ökat uttryck av mellanliggande glödtråden proteiner och chondroitin sulfate proteoglykaner (CSPGs), som hindrar neurala regenerering12. Även om gliaceller ärret hjälper först återställa BBB integritet och undvika överföring av den inflammatoriska reaktionen till omkringliggande frisk vävnad, fungerar det som en fysiska och biokemiska barriär mot axon regenerering12,14 ,15,16. Exempelvis axoner som möter gliaceller ärret Visa uppsvällda dystrofa tillväxt kottar och hämmad tillväxt12. Dessutom hindrar desorganisation av astrocytic processer efter skada utvidgning av regenererande axoner17. Resultatet av dessa hämmande egenskaper manifesteras i de ofta permanenta fysiska och neurologiska funktionsnedsättningar som patienter lider efter svår neurotrauma, inklusive TBI och SCI.
Oavsett de yttre utmaningarna funktionell förnyelse i CNS, har axoner visat sig ha en inneboende förmåga att regenerera. Exempelvis antyder den dynamiska karaktären av dystrofa tillväxt kottarna i kontakt med gliaceller ärret att dessa ändelser behåller sin kapacitet att utöka12. Följaktligen, man tror att ett främsta hinder för axonal re-tillväxt är hämmande miljön efter skada CNS och som ger en mer tillåtande miljö via minska gliaceller ärrbildning och/eller tillhandahålla regenerativ broar över ärret skulle vara fördelaktiga. Ja, tidigare studier har visat att CNS nervceller kunde utvidga axoner genom en lesion med perifer nerv ympkvistar som broar, som medför en mer gynnsam miljö för axon regenerering12,18, 19. Flera andra strategier har bedrivits för att utnyttja denna rudimentära förnyelseförmåga. Till exempel har manipulation av cell tillväxt signalvägar i olika skada modeller resulterat i axonal regenerering och gliaceller scar minskning10,20,21. Studier har dessutom visat att behandling med chondroitinase ABC, som klyver majoriteten av sockerkedjor i CSPGs, minskar den hämmande effekten av CSPGs utsöndras av reaktiva astrocyter22. Trots de uppmuntrande resultat, dessa metoder ger inte riktat vägledningen av tillväxt kottar, vilket potentiellt kan resultera i aberrant regeneration12, och också inte redovisa förlust av nervceller. Cellbaserade metoder har använts i försök att övervinna effekterna av gliaceller ärret och att återanskaffa förlorade celler, särskilt nervceller. Vissa grupper har dedifferentiated reaktiv astrocyter till nervceller, medan andra har transplanterats neurala stamceller in i CNS-lesioner att återbefolka området skada och främja axon regenerering23,24, 25. stamcellstransplantation ensam är dock begränsad av låga överlevnaden, dålig integrering och blygsamma lagring i skadad vävnad5. Dessutom misslyckas dessa cellbaserade strategier att återställa långdistans axonal skrifter, särskilt på ett kontrollerat sätt. Därför biomaterial i kombination med andra metoder utforskas som leveransfordon för olika neurala och stamceller och tillväxt faktorer26. Biomaterial-baserade metoder har en hög grad av kontroll att producera konstruktioner som efterliknar den specifika fysiska, haptotaxic och chemotaxic cues presentera i den tredimensionella (3D) närmiljön för target host vävnad27, 28,29,30,31,32,33,34. Reproduktion av dessa Miljösignaler är avgörande för transplanterade celler presentera native morfologi, spridning, migration och signalering, bland andra neurobiologiska egenskaper29. Trots dessa fördelaktiga egenskaper krävs avancemang bortom traditionella cell seedade biomaterial ställningar att samtidigt främja riktad långdistans axonal regenerering och ersätta förlorade nervceller.
En lovande alternativa tillvägagångssätt bygger på nervvävnad konstruerad ”levande ställningar”, som är åtskilda från andra cell-baserat tillvägagångssätt på grund av levande neurala celler med en förformade cytoarchitecture som emulerar infödda neuroanatomi och/eller utvecklingsmässiga mekanismer för att underlätta riktade utbyte, återuppbyggnad och regenerering av neurala kretsar4,35. Överväganden för utformningen av levande ställningar inkluderar fenotyper och källor av neurala celler, samt mekanisk/fysiska egenskaperna och de biokemiska signalerna av sammansättningen av någon medföljande biomaterial35. Efter tillverkning i vitro, dessa levande ställningar kan vara implanterad i vivo till nuvarande cell-adhesionsmolekyler och kemotaktisk och neurotrofa signalerar att aktivt reglera neurala cellmigration och axon utväxt beroende på tillståndet och progression av regenerativ processer35. Gliaceller kan fungera som underlag för den bakåtkompilerade cytoarchitecture av levande ställningar eftersom dessa celler medla olika utvecklande mekanismer i vivo. Under hjärnans utveckling åberopa nya nervceller basala processer utvidgad genom radiella glia från ventrikulära zonen mot utveckla kortikala plattan som levande ställningar för riktad migration36,37. Dessutom sträcker sig tillväxt kottar är visat att orientera sig genom att känna attraktivt och motbjudande signaler som framkallas av gliaceller VÄGSTOLPE celler, och så kallade ”banbrytande” axoner föreslås för att nå de rätta målen genom att utvidga längs pre mönstrade gliaceller ställningar35,38,39. Gliaceller är således nödvändiga för vägledningen av banbrytande axoner, som senare tjäna som axon-baserade ”levande ställningar” direkt projektionen av ”efterföljare” axoner. Dessutom glia-medierad tillväxt mekanismer har visats kvarstå efter födseln, som neuroblasts följer rostralt flyttande strömmen (RMS) för att navigera från den subventrikulära zonen (SVZ), en av de få återstående områdena av neurogenes i den vuxna hjärnan, att den luktbulben (OB)40. Dessa neuroblasts i RMS migrera inom gliaceller röret (figur 1A-1), som består av longitudinellt-anpassade astrocytic processer, via direkt cell-cell sammanväxningar och lokaliserade lösliga faktorer37, 41. Slutligen, medan CNS skada i däggdjur orsakar stört astrocytic processen arrangemang bildar ett gliaceller ärr som fysiskt hindrar axonal regenerering17, många icke däggdjur system saknar bildandet av ett skadligt gliaceller ärr. Snarare, upprätthålla gliaceller icke däggdjur arter mer organiserad, justerad mönster som används som guider genom den skada regionen17,42,43. Exempelvis i icke däggdjur SCI modeller visas axoner att växa i nära samarbete med gliaceller broarna över lesionen, vilket tyder på en viktig roll för organiserade gliaceller ställningar som substrat underlätta axonal regenerering och funktionell återhämtning ( Figur 1A -2) 42 , 44 , 45. rekapitulation neuroanatomiska funktioner och de utvecklingsmässiga/regenerativa mekanismer som beskrivs ovan kan ge en ny klass av modifierade gliaceller-baserade levande ställningar som kan samtidigt driva omogna neuronala migration och axonal pathfinding genom annars icke-tillåtande miljöer, därmed potentiellt mildra effekterna av neuronala och axon tarmkanalen degeneration är associerad med CNS skada och sjukdom.
Vår forskargrupp har tidigare designat flera typer av levande ställningar för återuppbyggnad och regenerering av axonal skrifter i CNS och det perifera nervsystemet (PNS) via micro-vävnad konstruerade neurala nätverk (mikro-villkoren) och vävnad bakåtkompilerade nerv transplantat (TENGs), respektive27,46,47,48. Båda strategierna baseras sig på biomimicry. Micro-villkoren är anatomiskt-inspirerade strukturer för att strukturellt och funktionellt ersätta axonal skrifter ansluta distinkta neuronala populationer av hjärnan. TENGs utnyttja utvecklingsmässiga mekanismen av axon-stödda axonal regenerering, exemplifierat av ”efterföljare” axon tillväxt längs ”pioneer” axoner, att uppnå riktade värd axonal regenerering35,46,48. Vi nyligen balanserade på mångsidigheten hos levande schavotten tekniken använder ett liknande system för fodral som mikro-villkoren och söker inspiration från de glia-baserade mekanismerna presentera hela utveckling. Här utvecklade vi konstruktioner bestående justerad astrocytic buntar spanning kollagena lumen en hydrogel mikro-kolumn49. Dessa astrocytic levande ställningar är utvecklat av första fylla en kapillär tube-akupunktur nål församling med flytande agarosgelelektrofores för att skapa en ihålig cylindrisk hydrogel med ytterdiameter (OD) och innerdiameter (ID) motsvarar diametrarna på de röret och nål, respektive. Efter agaros gelation och utvinning av hydrogel mikro-kolumnen från kapillärröret, ihåliga interiören är belagda med typ I kollagen att tillhandahålla en miljö som är tillåtande för Astrocyten vidhäftning och justerad bunt bildandet (figur 1B -1). Efteråt, lumen är seedade med cerebral kortikal astrocyter isolerade från postnatal råttungar (figur 1B-2). Tvärtemot tvådimensionell (2D) justering tekniker som förlitar sig på tillämpningen av elektriska fält, micropatterned grooves och extracellulär matrix (ECM) protein mönstring, astrocyt justering i levande schavotten bygger teknik på självmontering enligt kontrollerbara variabler såsom substrat krökning (kolumnen ID), cell densiteten och kollagen koncentration50,51,52. Astrocyterna kontrakt och omskapa kollagen och förvärva en bipolär, longitudinellt-anpassade morfologi som är analoga med de naturliga ställningar som observerats i vivo (figur 1B-3). Faktiskt, vi bedriver aktivt användningen av dessa kabel-liknande strukturer som fysiska substrat för målinriktad vägledning av migrera omogna nervceller samt underlätta axonal regenerering genom den ogynnsamma miljön i skadade CNS, särskilt däggdjur gliaceller ärret (figur 1 c). Denna artikel kommer att presentera metoden detaljerade tillverkning för astrocytic mikro-kolumner, fas kontrast och immunofluorescens bilder av den förväntade cytoarchitecture och en omfattande diskussion om de nuvarande begränsningarna och framtida inriktningar av de teknik.
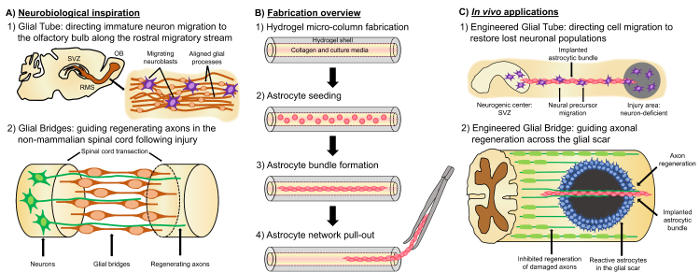
Figur 1: Inspiration, Fabrication protokoll och föreslagna program för de justerade Astrocytic nätverk. (A) neurobiologiska inspiration: (1) Neuroblasts med ursprung från neurogen subventrikulära zonen (SVZ) utnyttja längdriktningen justerad gliaceller röret i rostralt flyttande strömmen (RMS) för riktad övergång till luktbulben (OB); (2) icke-däggdjur såsom groddjur och fisk kan upprätthålla förnyelse efter nervvävnad skador delvis på grund av bildandet av en gliaceller bro som förbinder ändarna av en lesion (t.ex. transected ryggmärgen) och fungerar som en klätterställning för vägledningen av regenererande axoner. (B) tillverkning översikt: (1) byggandet av en micron stora, ihåliga hydrogel mikro-kolumn med lumen belagd med ECM, (2) sådd av primära kortikala astrocyter isolerade från postnatal råttungar, (3) självmontering av longitudinellt-orienterade buntar i kultur och (4) utvinning av bunten från den biomaterial fodral för framtida implantation studier. (C) In vivo program: (1) dessa levande ställningar kan tjäna som modifierade gliaceller rör för riktad neuron migrering från neurogen centra att återbefolka neuron-brist regioner. (2) rekapitulation av utvecklingstoxicitet mekanismen av banbrytande axon vägledning och regenerativ mekanismen av gliaceller broar i icke-däggdjur kan begåva dessa astrocytic ställningar med kapacitet att direkt axon regenerering över den icke-tillåtande miljön av däggdjur gliaceller ärr. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Jämfört med mer stödjande miljö av PNS, är CNS särskilt begränsade i hantering av de skadliga följderna av neurotrauma och neurodegeneration. Efter en allvarlig förolämpning mot däggdjur CNS bildas ett gliaceller ärr, bestående av en kärna av fibrotiska och inflammatoriska celler omges av en tät meshwork av oorganiserad reaktiva astrocyter som utsöndrar axon utväxt-hämmande proteoglykaner14. Detta ärr fungerar som en fysiska och biokemiska obstruktion mot förnyelse av axon änd…
Declarações
The authors have nothing to disclose.
Acknowledgements
Finansiella stöd tillhandahölls av National Institutes of Health [U01-NS094340 (Cullen) & F31-NS090746 (Svea)], Michael J. Fox Foundation [terapeutiska Pipeline Program #9998-(Cullen)], Penn medicin Neuroscience Center Pilot Award (Cullen), National Science Foundation [Graduate forskning stipendier DGE-1321851 (Struzyna)], Institutionen för Veterans Affairs [RR & D Merit granska #B1097-jag (Cullen)], och US Army Medical Research och Materielverk [#W81XWH-13-207004 (Cullen) & W81XWH-15-1-0466 (Cullen)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
Referências
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

