Un Sistema de Cultivo Hidropónico para el Análisis Simultáneo y Sistemático de Interacciones Moleculares de Plantas / Microbios y Señalización
Summary
El sistema de cocultivo hidropónico descrito soporta plantas intactas con mallas de malla metálica y las convierte en cocultivas con bacterias. El tejido de las plantas, las bacterias y las moléculas secretadas pueden ser recogidas separadamente para análisis de aguas abajo, permitiendo simultáneamente que se investiguen las respuestas moleculares tanto de los huéspedes de la planta como de los microbios o microbios que interactúan.
Abstract
Un diseño experimental que simula las interacciones naturales planta-microbio es muy importante para delinear los complejos procesos de señalización planta-microbio. Arabidopsis thaliana – Agrobacterium tumefaciens Proporciona un sistema modelo excelente para estudiar la patogénesis bacteriana y las interacciones de las plantas. Los estudios previos de las interacciones planta- Agrobacterium se han basado en gran medida en cultivos de suspensión de células de plantas, heridas artificiales de plantas o inducción artificial de factores de virulencia microbiana o defensas de plantas mediante productos químicos sintéticos. Sin embargo, estos métodos son distintos de la señalización natural in planta , donde las plantas y los microbios reconocen y responden en formas espaciales y temporales. Este trabajo presenta un sistema de cocultivo hidropónico donde las plantas intactas son soportadas por mallas de malla metálica y cocultivadas con Agrobacterium . En este sistema de cocultivación, no hay fitohormona sintética o producto químico que induzca micrLa virulencia obial o la defensa de la planta se complementa. El sistema de cocultivación hidropónica se asemeja mucho a las interacciones planta-microbios naturales y señala la homeostasis in planta . Las raíces de las plantas se pueden separar del medio que contiene Agrobacterium , y la señalización y las respuestas tanto de los huéspedes de la planta como de los microbios que interactúan pueden ser investigadas simultánea y sistemáticamente. En cualquier punto / intervalo dado, los tejidos vegetales o las bacterias se pueden cosechar por separado para diversos análisis "ómicos", demostrando la potencia y eficacia de este sistema. El sistema de cocultivación hidropónico se puede adaptar fácilmente al estudio: 1) la señalización recíproca de diversos sistemas de microbios de plantas, 2) señalización entre un huésped vegetal y múltiples especies microbianas ( es decir, consorcios o microbios microbianos), 3) cómo están implicados los nutrientes y los productos químicos En la señalización de microbios de plantas, y 4) cómo los microbios interactúan con los huéspedes de la planta y contribuyen a la tolerancia de las plantas aR estrés abióticos.
Introduction
Los microbios asociados a las plantas desempeñan un papel importante en el ciclo biogeoquímico, la biorremediación, la mitigación del cambio climático, el crecimiento y la salud de las plantas y la tolerancia de las plantas a las tensiones bióticas y abióticas. Los microorganismos interactúan con las plantas tanto directamente a través del contacto de la pared celular de la planta como indirectamente a través de la secreción y señalización química 1 , 2 , 3 . Como organismos sésiles, las plantas han desarrollado mecanismos directos e indirectos para resistir la infección por patógenos. Las defensas directas incluyen defensas estructurales y la expresión de proteínas de defensa, mientras que las defensas indirectas incluyen la producción secundaria de metabolitos de plantas y la atracción de organismos antagónicos a patógenos invasores 4 , 5 . Los exudados radiculares, secreciones, mucílagos, mucigel y lisados de las raíces alteran las propiedades físico-químicas de la rizosfera para atraer o repelerMicrobios hacia sus huéspedes 6 . La composición química de la secreción de las raíces es específica de la especie, sirviendo así como un filtro selectivo que permite que ciertos microorganismos capaces de reconocer tales compuestos florezcan en la rizosfera 6 . Por lo tanto, las especies microbianas compatibles pueden ser estimuladas para activar y mejorar sus asociaciones, ya sea en beneficio o detrimento de la planta huésped 1 .
La comprensión de las interacciones planta-microbio en la rizosfera es clave para mejorar la productividad de la planta y el funcionamiento del ecosistema, ya que la mayoría de la exposición microbiana y química ocurre en la estructura de la raíz y en la interfase suelo-aire 2 , 6 , 7 , 8 . Sin embargo, el examen de las interacciones planta-microbios subterráneas y respuestas recíprocas ha sido un desafío debido a su intrigante Compleja y dinámica y la falta de modelos experimentales adecuados con estructura de raíces naturales y morfología de plantas bajo condiciones de crecimiento controlables. Como uno de los fitopatógenos más estudiados, Agrobacterium infecta una amplia gama de plantas con importancia agrícola y hortícola, incluyendo cereza, manzana, pera, uva y rosa 9 . Agrobacterium es un organismo modelo importante para la comprensión de las interacciones planta-patógeno y es una herramienta poderosa en la transformación de plantas y la ingeniería de plantas 10 , 11 , 12 , 13 , 14 .
Las interacciones moleculares entre plantas y Agrobacterium han sido bien estudiadas durante varias décadas, y la comprensión actual de la patogenicidad de Agrobacterium es extensa 9 ,f "> 11, 15, 16. patogenicidad Agrobacterium se atribuye en gran parte a sus capacidades evolucionadas de percibir señales derivadas de plantas, dando como resultado la modulación fina de su programa de la virulencia y la comunicación de célula a célula, llamado quórum de detección 17. La El programa de virulencia de Agrobacterium está regulado por varias señales disponibles en la rizosfera e incluye dos sistemas de sistemas de dos componentes, el sistema ChvG / I y el sistema VirA / G. Las condiciones ácidas en la rizosfera activan la transcripción de chvG / I , virA / G , Y varios otros genes implicados en la patogenicidad de Agrobacterium , incluyendo virE0 , virE1 , virH1 , virH2 y genes del sistema de secreción de tipo VI (T6SS) 18. Compuestos fenólicos derivados de plantas, incluyendo acetosiringona (4'-hidroxi-3 ', 5 '-dimetoxiacetofenona), activar el VIrA / G sistema de 2 componentes a través de mecanismos de señalización de fosforilación 19 . VirA / G activa entonces todo el vir regulon, dando como resultado la transferencia e integración de un fragmento de ADN bacteriano de aproximadamente 20 kb denominado ADN de transferencia (T-DNA) desde su plásmido inductor de tumores (Ti) al núcleo de la planta 16 . T-DNA transporta genes responsables de la síntesis de las hormonas vegetales indol-3-acético (IAA) ( iaaM y iaaH ) y citoquinina ( ipt ), y una vez expresado en las células vegetales, se producen grandes cantidades de estas fitohormonas. Esto da lugar a la proliferación anormal del tejido y al desarrollo del tumor de la planta, conocida como enfermedad de la bilis de la corona, que es un problema crónico y resurgente para las plantas 9 , 11 , 20 . IAA también actúa colectivamente con ácido salicílico y ácido gamma-amino butírico para reprimir la virulencia de Agrobacterium o para reducir Agrobacteriu M quorum sensing (QS) 17 , 21 , 22 . Para contrarrestar esta represión, el T-DNA también lleva genes para la biosíntesis de opina, que activa la detección de Agrobacterium quorum para promover la patogenicidad de Agrobacterium y también sirve como fuente de nutrientes para el patógeno 22 , 23 .
A pesar de una profunda comprensión global de Agrobacterium- planta interacciones y la transferencia de T-DNA resultante en el huésped de la planta, los complejos eventos de señalización en la etapa inicial de la interacción son menos bien entendidos. Esto se debe en parte a las limitaciones de los métodos convencionales para investigar la señalización de planta de Agrobacterium . Los cultivos de suspensión de células vegetales y heridas artificiales específicas del sitio se usan comúnmente para estudiar las interacciones moleculares planta-microbio 24 ,. ef "> 26, 27 Sin embargo, las suspensiones de células carecen de morfología de la planta típica, en particular, células en suspensión planta no tienen estructuras profundas y los exudados de la raíz, que son muy importantes para la activación de la quimiotaxis microbiana y la virulencia 28, 29 El mantenimiento de la morfología de la planta. Y la estructura de la raíz se ha tratado de herir artificialmente a las plantas, lo que facilita la infección específica del sitio, lo que resulta en la detección de genes inducidos relacionados con la defensa de la planta en tejido vegetal directamente infectado 30 , 31. Sin embargo, la herida artificial es significativamente diferente de la infección patógena en la naturaleza , Particularmente como herida conduce a la acumulación de ácido jasmónico (JA), que sistemáticamente interfiere con la señalización de la planta natural y la defensa 26. Además, los productos químicos sintéticos se utilizan normalmente para inducir artificialmente las respuestas del huésped de la plantaO virulencia patógena. Aunque la suplementación de tales compuestos químicos refleja concentraciones en planta es posible, tal suplementación no explica la difusión de los exudados de raíz gradualmente en la rizosfera circundante, lo que genera un gradiente quimiotáctico detectado por los microbios 28 , 32 . Dadas las limitaciones de los enfoques convencionales para estudiar las interacciones planta-microbios, la exactitud y la profundidad de los datos obtenidos podrían ser impedidas y restrictivas, y el conocimiento generado a partir de los enfoques convencionales puede no traducir directamente in planta . Muchos aspectos de la señalización de Agrobacterium en las plantas aún no se entienden completamente, particularmente en la etapa temprana de las interacciones, cuando los síntomas de la enfermedad aún no se han desarrollado.
Para enmendar las limitaciones de los enfoques convencionales, este trabajo presenta un bajo costo, controlable, y flexible hydroponic cOcultivation sistema que permite a los investigadores a obtener una visión más profunda de la compleja de señalización y respuesta a las vías en la etapa inicial de la planta molecular microbio interacciones. La hidroponía se ha utilizado ampliamente para estudiar los nutrientes de las plantas, los exudados de las raíces, las condiciones de crecimiento y los efectos de la toxicidad metálica en las plantas 33 , 34 . Existen varias ventajas de los modelos hidropónicos, incluyendo las pequeñas exigencias espaciales, la accesibilidad de los diversos tejidos vegetales, el estricto control de las condiciones nutrientes / ambientales y el control de plagas / enfermedades. Los sistemas hidropónicos también son menos limitantes para el crecimiento de las plantas en comparación con las técnicas de placas de agar / phytoagar, que típicamente restringen el crecimiento después de 2-3 semanas. Es importante destacar que el mantenimiento de las estructuras de toda la planta facilita la secreción de raíces naturales necesarias para la quimiotaxis microbiana y la inducción de la virulencia [ 8 , 29] . El sistema descriLa cama aquí es más simple y menos laboriosa que las alternativas 33 , 34 . Utiliza menos piezas y no requiere ninguna otra herramienta que las tijeras estándar. Utiliza malla metálica (en oposición al nylon 33 ) como soporte fuerte para el crecimiento de la planta y un método simple de aireación en condiciones estériles mediante agitación para soportar el crecimiento microbiano. Además, el sistema puede utilizar malla metálica de varios tamaños para apoyar el crecimiento de la planta, que acomoda diversas especies de plantas sin restringir la anchura de sus raíces.
En el sistema de cocultivación hidropónica presentado aquí, las plantas se cultivan en un sistema hidropónico estéril donde las raíces de las plantas secretan compuestos orgánicos que apoyan el crecimiento de las bacterias inoculadas. En este sistema de cocultivación, no se suplementan productos químicos artificiales, tales como hormonas vegetales, elicitor de defensa, o productos químicos que inducen virulencia, lo que refleja la célula natural-significando la homeostasis durante las interacciones planta-microbio. Con este sistema de cocultivación hidropónica, fue posible determinar simultáneamente la expresión génica en el tejido de raíz de Col-0 de Arabidopsis thaliana tras la infección por Agrobacterium , así como la activación de genes de Agrobacterium tras la cocultivación con Arabidopsis . Se demostró además que este sistema es adecuado para estudiar la fijación de Agrobacterium a las raíces de las plantas, así como el perfil de secreto de la raíz de la planta, al cocultivar (infección) con Agrobacterium ( Figura 1 ).
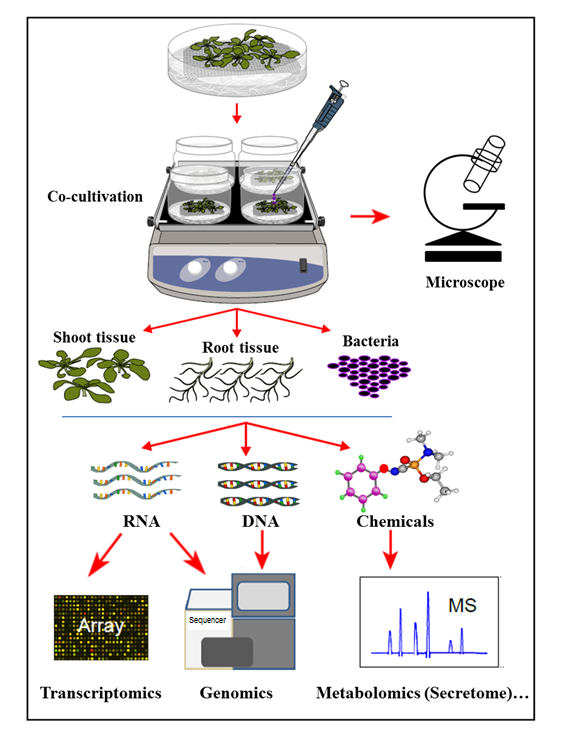
Figura 1: Visión general del sistema de cocultivación hidropónica, con análisis de muestras. Las plantas se cultivan en la parte superior de la malla (brotes por encima de la malla), con las raíces sumergidas en medio hidropónico que luego se inocula con bacterias fO el coculture. Los tejidos vegetales y las bacterias se separan para extracciones y análisis simultáneos. Esta cifra ha sido modificada a partir de la referencia 35 .
Protocol
Representative Results
Discussion
Dada la naturaleza gradual de la secreción de las raíces, la concentración de los productos químicos inducidos por la virulencia producidos in planta y sus efectos sobre las interacciones dinámicas planta-microbio ocurren en gradientes espaciales y temporales. En este sistema de co-cultivo hidropónico, no se añade fitohormona sintética o sustancia química que induce la virulencia microbiana o las defensas de las plantas. Por el contrario, utilizando métodos convencionales, la adición de productos qu?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Nos gustaría agradecer a Brian Weselowski y Alexander W. Eastman por su ayuda y útil discusión. También queremos dar las gracias a los Dres. Eugene W. Nester, Lingrui Zhang, Haitao Shen, Yuhai Cui y Greg Thorn por su ayuda, útiles discusiones y lectura crítica del manuscrito. Esta investigación fue financiada por Agricultura y Agroalimentación de Canadá, Growing Forward-AgriFlex (número RBPI 2555) y el proyecto de Cultivo de Frente II número 1670, realizado por los autores como parte de sus funciones. Este estudio también fue parcialmente financiado por el Consejo de Investigación de Ciencias Naturales e Ingeniería de Canadá (CRSNG) Discovery Grant RGPIN-2015-06052 otorgado a ZC Yuan.
Materials
| plant seeds (Arabidopsis thaliana Col-0) | Arabidopsis Biological Resource Centre | CS7000 | https://abrc.osu.edu/order-stocks |
| bacteria (Agrobacterium tumefaciens C58) | University of Washington | N/A | |
| labeled bacteria | in-house | optional, depends on downstream analyses | |
| vortex | (various) | ||
| microcentrifuge tubes | (various) | ||
| microcentrifuge | (various) | ||
| 5% sodium hypochlorite | (various) | ||
| double distilled water | (various) | ||
| autoclave | (various) | ||
| micropipette | (various) | ||
| 70 % ethanol | (various) | ||
| Murashige and Skoog (MS) basal salts | Sigma-Aldrich | M5524 | |
| sucrose | (various) | ||
| MES | (various) | ||
| B5 vitamin mix | Sigma-Aldrich | G1019 | |
| phytoagar | (various) | ||
| deep Petri dishes | (various) | ||
| stainless steel mesh | Ferrier Wire Goods Company Ltd | N/A | grade: 304; mesh count: 40 × 40; wire DIA: 0.01 |
| micropore tape, 1 inch | 3M | 1530-1 | |
| diurnal growth chamber | (various) | ||
| cylindrical glass tanks, 100 × 80 mm | Pyrex | 3250 | other sizes can be used, in which case liquid content may need adjustment |
| flow hood | (various) | ||
| forcepts | (various) | ||
| yeast extract | (various) | ||
| tryptone | (various) | ||
| MgSO4 | (various) | ||
| shaking incubator | (various) | ||
| spectrophotometer | (various) | ||
| NaCl | (various) | ||
| shaker | (various) | ||
| scissors | (various) | optional, depends on downstream analyses | |
| fluorescence microscope | (various) | optional, depends on downstream analyses | |
| microscope slides and cover slips | (various) | optional, depends on downstream analyses | |
| nail polish | (various) | optional, depends on downstream analyses | |
| Bacterial RNA extraction kit | (various) | optional, depends on downstream analyses | |
| plant RNA extraction kit (RNeasy Plant Mini Kit) | Qiagen | 74903 or 74904 | optional, depends on downstream analyses |
| material and equipment for RT-qPCR | (various) | optional, depends on downstream analyses | |
| material and equipment for microarray analysis | (various) | optional, depends on downstream analyses | |
| liquid nitrogen | (various) | optional, depends on downstream analyses | |
| mortar and pestle | (various) | optional, depends on downstream analyses | |
| 0.2 µm pore filter | (various) | optional, depends on downstream analyses | |
| 50 mL conical tubes | (various) | optional, depends on downstream analyses | |
| freeze dryer | (various) | optional, depends on downstream analyses | |
| sealable test tubes | (various) | optional, depends on downstream analyses | |
| ethyl acetate | (various) | optional, depends on downstream analyses | |
| nitrogen gas | (various) | optional, depends on downstream analyses | |
| material and equipment for HPLC | (various) | optional, depends on downstream analyses | |
| material and equipment for ESI-TOF-MS | (various) | optional, depends on downstream analyses |
Referências
- Lambers, H., Mougel, C., Jaillard, B., Hinsinger, P. Plant-microbe-soil interactions in the rhizosphere: An evolutionary perspective. Plant Soil. 321 (1), 83-115 (2009).
- Philippot, L., Raaijmakers, J. M., Lemanceau, P., vander Putten, W. H. Going back to the roots: The microbial ecology of the rhizosphere. Nat. Rev. Microbiol. 11 (11), 789-799 (2013).
- Somers, E., Vanderleyden, J., Srinivasan, M. Rhizosphere bacterial signalling: A Love Parade beneath our feet. Crit. Rev. Microbiol. 30 (4), 205-240 (2004).
- Barah, P., Winge, P., Kusnierczyk, A., Tran, D. H., Bones, A. M. Molecular signatures in Arabidopsis thaliana in response to insect attack and bacterial infection. PLoS ONE. 8 (3), (2013).
- Zhang, J., Zhou, J. -. M. Plant immunity triggered by microbial molecular signatures. Mol. Plant. 3 (5), 783-793 (2010).
- Paterson, E., Gebbing, T., Abel, C., Sim, A., Telfer, G. Rhizodeposition shapes rhizosphere microbial community structure in organic soil. New Phytol. 173 (3), 600-610 (2006).
- Hartmann, A., Schmid, M., van Tuinen, D., Berg, G. Plant-driven selection of microbes. Plant Soil. 321 (1-2), 235-257 (2008).
- Micallef, S. A., Shiaris, M. P., Colon-Carmona, A. Influence of Arabidopsis thaliana accessions on rhizobacterial communities and natural variation in root exudates. J. Exp. Bot. 60 (6), 1729-1742 (2009).
- Burr, T., Otten, L. Crown gall of grape: Biology and disease management. Annu. Rev. Phytopathol. 37, 53-80 (2001).
- Clough, S. J., Bent, A. F. Floral dip: A simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Binns, A. N., Costantino, P., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. The Agrobacterium oncogenes. The Rhizobiaceae. , (1998).
- Gheysen, G., Angenon, G., Van Montagu, M., Lindsey, K. Agrobacterium-mediated plant transformation: a scientifically intriguing story with significant applications. Transgenic Plant Research. , (1998).
- Valvekens, D., Von Montagu, M. V., Van Lijsebettens, M. Agrobacterium tumefaciens-mediated transformation of Arabidopsis thaliana root explants by using kanamycin selection. Proc. Natl. Acad. Sci. USA. 85 (15), 5536-5540 (1988).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283 (1999).
- Chilton, M. D., et al. Stable incorporation of plasmid DNA into higher plant cells: The molecular basis of crown gall tumorigenesis. Cell. 11 (2), 263-271 (1977).
- Gelvin, S. B. Agrobacterium in the genomics age. Plant Physiol. 150 (4), 1665-1676 (2009).
- Subramoni, S., Nathoo, N., Klimov, E., Yuan, Z. -. C. Agrobacterium tumefaciens responses to plant-derived signaling molecules. Front. Plant Sci. 5, 322 (2014).
- Yuan, Z., Liu, P., Saenkham, P., Kerr, K., Nester, E. W. Transcriptome profiling and functional analysis of Agrobacterium tumefaciens reveals a general conserved response to acidic conditions (pH 5.5) and a complex acid-mediated signaling involved in Agrobacterium-plant interactions. J. Bacteriol. 190 (2), 494-507 (2008).
- Stachel, S. E., Messens, E., Van Montagu, M., Zambryski, P. Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agrobacterium tumefaciens. Nature. 318 (6047), 624-629 (1985).
- Memelink, J., de Pater, B. S., Hoge, J. H. C., Schilperoort, R. A. T-DNA hormone biosynthetic genes: Phytohormones and gene expression in plants. Dev. Genet. 8 (5-6), 321-337 (1987).
- Yuan, Z. -. C., et al. The plant signal salicylic acid shuts down expression of the vir regulon and activates quormone-quenching genes in Agrobacterium. Proc. Natl. Acad. Sci. USA. 104 (28), 11790-11795 (2007).
- Yuan, Z. -. C., Haudecoeur, E., Faure, D., Kerr, K. F., Nester, E. W. Comparative transcriptome analysis of Agrobacterium tumefaciens in response to plant signal salicylic acid, indole-3-acetic acid and γ-amino butyric acid reveals signalling cross-talk and Agrobacterium-plant co-evolution. Cell. Microbiol. 10 (11), 2339-2354 (2008).
- Li, P. L., Farrand, S. K. The replicator of the nopaline-type Ti plasmid pTiC58 is a member of the repABC family and is influenced by the TraR-dependent quorum-sensing regulatory system. J. Bacteriol. 182 (1), 179-188 (2000).
- Atkinson, M. M., Huang, J., Knopp, J. A. Hypersensitivity of suspension-cultured tobacco cells to pathogenic bacteria. Phytopathology. 75 (11), 1270-1274 (1985).
- Veena, ., Jiang, H., Doerge, R. W., Gelvin, S. B. Transfer of T-DNA and Vir proteins to plant cells by Agrobacterium tumefaciens induces expression of host genes involved in mediating transformation and suppresses host defense gene expression. Plant J. 35 (2), 219-236 (2003).
- León, J., Rojo, E., Sanchez-Serrano, J. J. Wound signalling in plants. J. Exp. Bot. 52 (354), 1-9 (2001).
- Ditt, R. F., Kerr, K. F., de Figueiredo, P., Delrow, J., Comai, L., Nester, E. W. The Arabidopsis thaliana transcriptome in response to Agrobacterium tumefaciens. Mol. Plant Microbe In. 19 (6), 665-681 (2006).
- Mandimba, G., Heulin, T., Bally, R., Guckert, A., Balandreau, J. Chemotaxis of free-living nitrogen-fixing bacteria towards maize mucilage. Plant Soil. 90 (1-3), 129-139 (1986).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiol. 148 (3), 1547-1556 (2008).
- Lee, C. W., et al. Agrobacterium tumefaciens promotes tumor induction by modulating pathogen defense in Arabidopsis thaliana. Plant Cell. 21 (9), 2948-2962 (2009).
- Reymond, P., Weber, H., Damond, M., Farmer, E. E. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis. Plant Cell. 12 (5), 707-720 (2000).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front. Plant Sci. 5, 252 (2014).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14 (1), 69 (2014).
- Conn, S. J., et al. Protocol: Optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9 (1), 4 (2013).
- Nathoo, N. . Identification of putative plant defense genes using a novel hydroponic co-cultivation technique for studying plant-pathogen interaction. , (2015).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol. 22 (12), 1567-1572 (2004).
- Wise, A. A., Liu, H., Binns, A. N. Nucleic acid extraction from Agrobacterium strains. Methods Mol. Bio. 343, 67-76 (2006).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat. Protoc. 1 (3), 1559-1582 (2006).
- Salter, M. G., Conlon, H. E. Extraction of plant RNA. Methods Mol. Bio. 362, 309-314 (2007).
- Bao, Y., Wang, S., Yang, X., Li, T., Xia, Y., Meng, X. Metabolomic study of the intervention effects of Shuihonghuazi Formula, a Traditional Chinese Medicinal formulae, on hepatocellular carcinoma (HCC) rats using performance HPLC/ESI-TOF-MS. J. Ethnopharmacol. 198, 468-478 (2017).
- Korves, T. M., Bergelson, J. A developmental response to pathogen infection in Arabidopsis. Plant Physiol. 133 (1), 339-347 (2003).
- Lyons, R., Rusu, A., Stiller, J., Powell, J., Manners, J. M., Kazan, K. Investigating the association between flowering time and defense in the Arabidopsis thaliana-Fusarium oxysporum interaction. PLoS ONE. 10 (6), e0127699 (2015).
- Badri, D. V., Weir, T. L., vander Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: Plant-microbe interactions. Curr. Opin. Biotechnol. 20 (6), 642-650 (2009).
- Baerson, S. R., et al. Detoxification and transcriptome response in Arabidopsis seedlings exposed to the allelochemical benzoxazolin-2(3H)-one. J. Biol. Chem. 280 (23), 21867-21881 (2005).

