Bitki / Mikrop Moleküler Etkileşimlerinin ve Sinyalizasyonunun Eşzamanlı ve Sistematik Analizi için Hidroponik Birlikte Yetiştirme Sistemi
Summary
Tarif edilen hidrofobik kokültivasyon sistemi, metal örgülü elekler ile bozulmamış bitkileri destekler ve bunları bakteriler ile birlikte yetiştirir. Bitki dokuları, bakteriler ve salgılanan moleküller daha sonra aşağı akış analizleri için ayrıca hasat edilebilmekte, aynı anda her iki bitki barınağının ve etkileşen mikropların veya mikrobiyolojilerin moleküler tepkileri araştırılabilmektedir.
Abstract
Doğal bitki-mikrop etkileşimlerini taklit eden deneysel bir tasarım, kompleks bitki-mikrop sinyalizasyon süreçlerini tanımlamak için çok önemlidir. Arabidopsis thaliana – Agrobacterium tumefaciens Bakteriyel patogenez ve bitki etkileşimlerini incelemek için mükemmel bir model sistemi sağlar. Önceki bitki -Agrobacterium etkileşimleri çalışmaları, büyük oranda bitki hücre süspansiyon kültürleri, bitkilerin suni yaralanması veya sentetik kimyasallar ile mikrobik virulans faktörlerinin veya bitki savunmalarının yapay olarak indüklenmesine dayanıyordu. Ancak bu yöntemler bitkiler ve mikroplar tanımak ve mekansal ve zamansal şekillerde tepki plantanın doğal sinyalizasyon, farklıdır. Bu çalışma bozulmamış bitkilerin metal örgülü elekler tarafından desteklendiği ve Agrobacterium ile birlikte kültürlendiği bir hidroponik kokültivasyon sistemi sunmaktadır. Bu kokültivasyon sisteminde, sentetik fitotormon veya mikraya neden olan kimyasal madde bulunmamaktadırObial virulence veya bitki savunması tamamlanmaktadır. Hidroponik kokültivasyon sistemi, doğal bitki-mikrop etkileşimlerini ve planta sinyalizasyon homeostazı yakından andırıyor. Bitki kökleri, Agrobacterium içeren ortamdan ayrılabilir ve hem bitki barınaklarının hem de etkileşen mikropların sinyal ve tepkileri aynı anda ve sistematik olarak incelenebilir. Herhangi bir zaman / aralıkta, bitki dokuları veya bakteri, bu sistemin gücünü ve etkinliğini gösteren çeşitli "omiks" analizleri için ayrıca hasat edilebilir. Hidroponik kokültivasyon sistemi, 1) çeşitli bitki-mikrobik sistemlerin karşılıklı sinyal verme, 2) bitki konakçıları ile çoklu mikrobik türler ( örneğin mikrobik konsorsiyumlar veya mikrobiyomlar) arasındaki sinyalizasyon, 3) besin maddelerinin ve kimyasalların ilişkilendirilmesi Ve 4) mikropların bitki ev sahipleriyle nasıl etkileşime girdiğini ve bitki-biyolojik olara toleransını nasıl etkilediğiniR Abiyotik stresler.
Introduction
Bitki ile ilişkili mikrop biyojeokimyasal döngü, biyolojik giderme, iklim değişikliğinin hafifletilmesi, bitki büyümesi ve sağlığı ve biyotik ve abiyotik streslere karşı bitki toleransında önemli rol oynamaktadır. Mikroorganizmalar bitkilerle doğrudan bitki hücresi duvar teması yoluyla ve dolaylı olarak kimyasal salınım ve sinyalleme 1 , 2 , 3 aracılığıyla etkileşirler. Sabit organizmalar olarak, bitkiler patojenler tarafından enfeksiyona karşı doğrudan ve dolaylı mekanizmalar geliştirmiştir. Dolaylı savunma ikincil bitki metabolit üretimini ve patojenleri 4, 5 istila antagonistik organizmaların gözde içerisinde ise direkt savunma yapısal savunma ve savunma proteinlerinin ekspresyonunu içerir. Bitki kökenli kök sızıntıları, salgıları, müsilatları, müsigel ve lizatları rizosferin fiziksel-kimyasal özelliklerini çekme veya itme için değiştirirEv sahiplerine karşı mikrop 6 . Kök sekresyonunun kimyasal bileşimi, türe özgüdür, böylelikle bu bileşiklerin tanınması için yeterli mikroorganizmaların rizosfer 6'da gelişmesine izin veren seçici bir filtre görevini görür. Böylece uyumlu bir mikrobik türler de, bitki konakçıya 1 yararına veya zararına, aktif ve ilişkilerini geliştirmek için uyarılabilir.
Mikrobiyal ve kimyasal maruziyetin büyük bir kısmı kök yapısı ve toprak-hava arayüzü 2 , 6 , 7 , 8'de gerçekleştiği için, rizosferdeki bitki-mikrop etkileşimlerini anlamak, bitki verimliliğini ve ekosistemi işlerliği güçleştirmenin anahtarıdır. Bununla birlikte, yeraltı bitki-mikrop etkileşimlerinin ve karşılıklı tepkilerin incelenmesi, ilginç bir şekilde Karmaşık ve dinamik doğası ve sıkı kontrol edilebilir büyüme koşulları altında doğal kök yapısı ve bitki morfolojisi ile uygun deneysel modellerin olmaması. En ağır çalışılan fitopatojenlere biri olan Agrobacterium kiraz, elma, armut, üzüm dahil tarım ve bahçecilik öneme sahip bitkilerin geniş bir yelpazede bozar ve 9 yükseldi. Agrobacterium anlama bitki-patojen etkileşimlerinin önemli bir model organizma ve bitki transformasyonu ve tesis mühendisliği 10, 11, 12, 13, 14 bir güçlü bir araçtır.
Moleküler bitki- Agrobacterium etkileşimleri birkaç on yıl boyunca iyi çalışılmış ve Agrobacterium patojenisitesinin mevcut anlayışı geniş kapsamlı 9 ,F "> 11 , 15 , 16. Agrobacterium patojenitesi, büyük oranda, bitki kaynaklı sinyalleri algılama yetenekleri ve bunun virulans programının ve hücre-hücre iletişiminin ince modülasyonuyla sonuçlanan, yeterlilik nütrisyonu 17 olarak adlandırılan şekilde ortaya çıktığı anlamına gelmektedir. Agrobacterium virulence programı, rizosferdeki birkaç sinyal ile düzenlenir ve iki bileşenli sistemlerden oluşan ChvG / I sistemi ve VirA / G sistemini içerir: Rizosferdeki asidik koşullar, chvG / I , virA / G'nin transkripsiyonunu aktive eder ve virE0, virE1, virH1, virH2 ve tip VI salgılama sistemine (T6SS) 18. genleri de dahil olmak üzere, Agrobacterium patojenik, kapsanan çeşitli diğer genler asetosiringon (4'-hidroksi-3' , 5 de dahil olmak üzere fenolik bileşikleri, bitki-türevi '-dimetoksiasetofenon), V'yi aktive edinIrA / G 2 komponentli sistem fosforilasyon sinyal mekanizmaları vasıtasıyla 19 . VirA / G daha sonra tüm vir regülatörünü aktive eder ve transfer DNA'sı (T-DNA) olarak adlandırılan ~ 20 kb bakteri DNA fragmanının tümör kaynaklı (Ti) plasmidinden bitki çekirdeğine 16 aktarılması ve entegrasyonu ile sonuçlanır. T-DNA, indol-3-asetik asit (IAA) ( iaaM ve iaaH ) ve sitokinin ( ipt ) bitki hormonlarının sentezinden sorumlu genleri taşır ve bir zamanlar bitki hücrelerinde eksprese edildiğinde, bu bitkisel hormonların büyük miktarları üretilir. Bu, anormal doku çoğalması ve bitki tümörü gelişimine, yani 9 , 11 , 20 nolu bitkiler için kronik ve yeniden dirilme problemi olan kron kalp hastalığı ile sonuçlanır. IAA da Agrobacterium virulence'ı baskılamak veya Agrobacteriu'yu azaltmak için salisilik asit ve gama-amino bütirik asit ile birlikte hareket eder M zayıflama algılama (QS) 17 , 21 , 22 . Bu baskıya karşı koymak için, T-DNA da Agrobacterium patojenisitesini teşvik etmek için Agrobacterium çekirdeğini aktive eden ve ayrıca patojen 22 , 23 için bir besin kaynağı olarak görev yapan opine biyosentezi genleri taşır.
Agrobacterium -plant etkileşimleri ve bitki konakçığına dönüşen T-DNA transferinin derinlemesine anlaşılmasına rağmen, etkileşimin ilk aşamasındaki kompleks sinyal olayları daha az anlaşılır. Bu, kısmen Agrobacterium -plant sinyalizasyonunu araştıran konvansiyonel yaklaşımların kısıtlamalarına bağlı. Bitki hücre süspansiyon kültürleri ve suni bölgeye özgü yaralama, moleküler bitki-mikrop etkileşimleri 24 ,Ef "> 26 , 27. Ancak, hücre süspansiyonları tipik bitki morfolojisine sahip değildir, özellikle bitki süspansiyon hücreleri kök yapısı ve kök sızıntısı içermez ve bunlar mikrobiyal kemotaksis ve virülence aktive etmek için çok önemlidir 28 , 29. Bitki morfolojisinin korunması Ve kök yapısı, doğrudan enfekte bitki dokusunda 30 , 31 endüklenen bitki savunma ile ilgili genlerin saptanmasına neden olarak, bölgeye özgü enfeksiyonu kolaylaştıran yapay olarak yaralamış bitkiler tarafından ele alınmıştır.Ancak suni yaralanma, doğadaki patojen enfeksiyonundan belirgin olarak farklıdır , Çünkü özellikle yaralanma, doğal bitki sinyalizasyonunu ve savunmasını sistemik olarak engelleyen jasmonik asit (JA) birikimine neden olarak 26. Ayrıca, sentetik kimyasal maddeler tipik olarak bitki konukçu yanıtlarını yapay olarak indüklemek için kullanılırVeya patojen virulence. Bu tür kimyasal bileşiklerin planta konsantrasyonları yansıtacak şekilde takviye edilmesi mümkün olsa da, bu takviye, kök sızıntılarının, mikroskoplar 28 , 32 tarafından algılanan bir kemotaktik gradyan oluşturan çevresindeki rizosfer içerisindeki kademeli olarak difüzyonunu hesaba katmaz. Bitki-mikrop etkileşimlerinin incelenmesine yönelik geleneksel yaklaşımların sınırlamaları göz önüne alındığında, elde edilen verilerin doğruluğu ve derinliği engellenebilir ve kısıtlayıcı olabilir ve konvansiyonel yaklaşımlardan üretilen bilgiler doğrudan planta tercüme edilemez. Bitki- Agrobacterium sinyalizasyonunun bir çok yönü, özellikle hastalık semptomları henüz gelişmediğinde, etkileşimlerin erken evresinde tam olarak anlaşılamamıştır.
Konvansiyonel yaklaşımların sınırlamalarını değiştirmek için, bu çalışma, ucuz, sıkı kontrol edilebilir ve esnek hidroponik cAraştırmacılar moleküler bitki-mikrop etkileşimlerinin ilk aşamasında karmaşık sinyalizasyon ve yanıt yollarına daha derin kavrayışlar kazandıran bir ocultivation sistemi. Hidroponik bitki besin maddeleri, kök sızıntıları, büyüme koşulları ve metal toksisitesinin bitkiler üzerindeki etkilerini incelemek için yaygın bir şekilde kullanılmaktadır 33 , 34 . Küçük mekan gereksinimleri, çeşitli bitki dokularının erişilebilirliği, besin / çevre koşullarının sıkı kontrolü ve zararlı / hastalık kontrolü dahil olmak üzere hidrofobik modellerin pek çok avantajı vardır. Ayrıca, 2-3 hafta sonra büyümeyi sınırlayan agar / fitoagar kaplama teknikleriyle karşılaştırıldığında, hidrofobik sistemler bitki büyümesini daha az sınırlandırmaktadır. Önemli olarak, bütün bitki yapılarının bakım mikrobiyal kemotaksisi ve hastalık oluşturma indüksiyonu 8, 29 için gerekli doğal kök sekresyonunu kolaylaştıran. Sistem açıklamasıBurada yatak 33 ve 34 seçeneklerinden daha basit ve daha az emek-yoğun. Daha az parça kullanır ve standart makas haricinde herhangi bir alet gerektirmez. Bitki büyümesi için güçlü bir destek ve mikrobik büyümeyi desteklemek için sallayarak steril koşullar altında basit bir havalandırma yöntemi olarak metal örgü kullanır (naylon 33'e karşı). Buna ek olarak, sistem, köklerinin genişliğini sınırlamaksızın çeşitli bitki türlerini barındıran bitki büyümesini desteklemek için çeşitli ebatlarda metal örgü kullanabilir.
Burada sunulan hidroponik kokültivasyon sisteminde bitkiler, bitki köklerinin aşılanmış bakterilerin büyümesini destekleyen organik bileşikleri salgılayan steril bir hidroponik sistemde yetiştirilir. Bu ko-yetiştirme sisteminde, bitki hormonları, savunma elitörü veya virulans indükleyici kimyasallar gibi yapay kimyasallar eklenmemektedir; bu da doğal hücrenin-Bitki-mikrop etkileşimleri sırasında homeostazı işaretleme. Bu hidroponik kokültivasyon sistemi ile, Agrobacterium tarafından enfeksiyon üzerine Arabidopsis thaliana Col-0 kökü dokusunda gen ifadesinin yanı sıra Arabidopsis ile birlikte yetiştirme üzerine Agrobacterium genlerinin aktivasyonu aynı anda belirlenebilirdi. Bundan başka, bu sistem, Agrobacterium (Şekil 1) ile birlikte kültürün (enfeksiyon) üzerine, kökler, aynı zamanda, bitki kök secretome profilini bitki Agrobacterium eki incelemek için uygun olduğu gösterilmiştir.
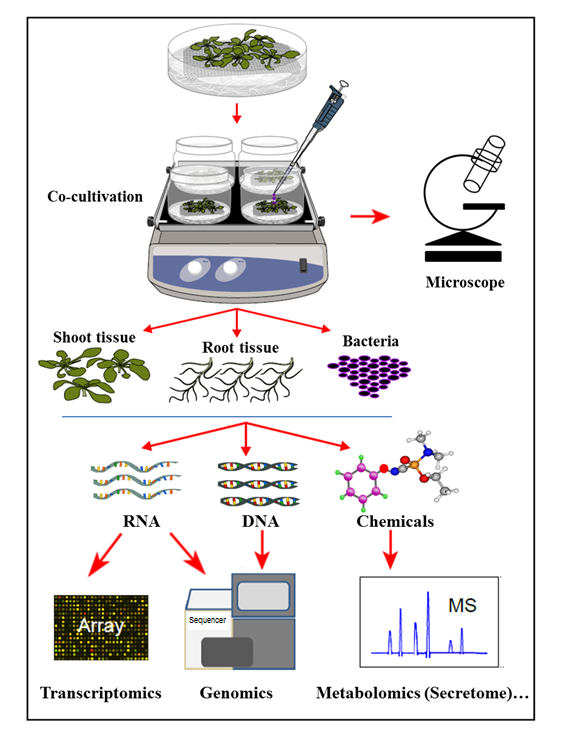
Şekil 1: Örnek Analizlerle Hidroponik Kokültürasyon Sistemine Genel Bakış. Bitkiler, ağın üstünde yetiştirilir (ağın üstünde sürgünler), kökleri hidrofobik ortamda daldırıp daha sonra bakteri fVeya kokültür. Bitki dokuları ve bakteriler daha sonra eşzamanlı ekstraksiyon ve analizler için ayrılır. Bu rakam referans 35'den değiştirildi.
Protocol
Representative Results
Discussion
Kök sekresyonunun aşamalı doğası göz önüne alındığında, planta üretilen virülence neden olan kimyasalların konsantrasyonu ve dinamik bitki-mikrop etkileşimleri üzerindeki etkileri, uzaysal ve zamansal gradyanlarda gerçekleşir. Bu hidroponik birlikte işleme sisteminde, herhangi bir sentetik fitotormon veya mikrobik virulans veya bitki savunmasına neden olan kimyasal eklenmez. Aksine, klasik yaklaşımları kullanarak, asetosiringon gibi sentetik kimyasalların eklenmesi, konsantrasy…
Declarações
The authors have nothing to disclose.
Acknowledgements
Yardımları ve yararlı tartışmaları için Brian Weselowski ve Alexander W. Eastman'a teşekkür etmek istiyoruz. Ayrıca Dr Dr teşekkür etmek istiyorum. Eugene W. Nester, Lingrui Zhang, Haitao Shen, Yuhai Cui ve Greg Thorn'a yardımları, faydalı tartışmaları ve elyazmasının eleştirel okumaları için teşekkür ederiz. Bu araştırma, yazarlar tarafından görevlerinin bir parçası olarak yürütülen Tarım ve Tarımsal Gıda Kanada, Büyüyen İleri-AgriFlex (RBPI numarası 2555) ve Büyüyen İleri II projesi 1670 tarafından finanse edildi. Bu çalışma kısmen ZC Yuan'a ödenecek Doğal Bilimler ve Kanada Mühendislik Araştırma Kurumu (NSERC) Discovery Grant RGPIN-2015-06052 tarafından finanse edildi.
Materials
| plant seeds (Arabidopsis thaliana Col-0) | Arabidopsis Biological Resource Centre | CS7000 | https://abrc.osu.edu/order-stocks |
| bacteria (Agrobacterium tumefaciens C58) | University of Washington | N/A | |
| labeled bacteria | in-house | optional, depends on downstream analyses | |
| vortex | (various) | ||
| microcentrifuge tubes | (various) | ||
| microcentrifuge | (various) | ||
| 5% sodium hypochlorite | (various) | ||
| double distilled water | (various) | ||
| autoclave | (various) | ||
| micropipette | (various) | ||
| 70 % ethanol | (various) | ||
| Murashige and Skoog (MS) basal salts | Sigma-Aldrich | M5524 | |
| sucrose | (various) | ||
| MES | (various) | ||
| B5 vitamin mix | Sigma-Aldrich | G1019 | |
| phytoagar | (various) | ||
| deep Petri dishes | (various) | ||
| stainless steel mesh | Ferrier Wire Goods Company Ltd | N/A | grade: 304; mesh count: 40 × 40; wire DIA: 0.01 |
| micropore tape, 1 inch | 3M | 1530-1 | |
| diurnal growth chamber | (various) | ||
| cylindrical glass tanks, 100 × 80 mm | Pyrex | 3250 | other sizes can be used, in which case liquid content may need adjustment |
| flow hood | (various) | ||
| forcepts | (various) | ||
| yeast extract | (various) | ||
| tryptone | (various) | ||
| MgSO4 | (various) | ||
| shaking incubator | (various) | ||
| spectrophotometer | (various) | ||
| NaCl | (various) | ||
| shaker | (various) | ||
| scissors | (various) | optional, depends on downstream analyses | |
| fluorescence microscope | (various) | optional, depends on downstream analyses | |
| microscope slides and cover slips | (various) | optional, depends on downstream analyses | |
| nail polish | (various) | optional, depends on downstream analyses | |
| Bacterial RNA extraction kit | (various) | optional, depends on downstream analyses | |
| plant RNA extraction kit (RNeasy Plant Mini Kit) | Qiagen | 74903 or 74904 | optional, depends on downstream analyses |
| material and equipment for RT-qPCR | (various) | optional, depends on downstream analyses | |
| material and equipment for microarray analysis | (various) | optional, depends on downstream analyses | |
| liquid nitrogen | (various) | optional, depends on downstream analyses | |
| mortar and pestle | (various) | optional, depends on downstream analyses | |
| 0.2 µm pore filter | (various) | optional, depends on downstream analyses | |
| 50 mL conical tubes | (various) | optional, depends on downstream analyses | |
| freeze dryer | (various) | optional, depends on downstream analyses | |
| sealable test tubes | (various) | optional, depends on downstream analyses | |
| ethyl acetate | (various) | optional, depends on downstream analyses | |
| nitrogen gas | (various) | optional, depends on downstream analyses | |
| material and equipment for HPLC | (various) | optional, depends on downstream analyses | |
| material and equipment for ESI-TOF-MS | (various) | optional, depends on downstream analyses |
Referências
- Lambers, H., Mougel, C., Jaillard, B., Hinsinger, P. Plant-microbe-soil interactions in the rhizosphere: An evolutionary perspective. Plant Soil. 321 (1), 83-115 (2009).
- Philippot, L., Raaijmakers, J. M., Lemanceau, P., vander Putten, W. H. Going back to the roots: The microbial ecology of the rhizosphere. Nat. Rev. Microbiol. 11 (11), 789-799 (2013).
- Somers, E., Vanderleyden, J., Srinivasan, M. Rhizosphere bacterial signalling: A Love Parade beneath our feet. Crit. Rev. Microbiol. 30 (4), 205-240 (2004).
- Barah, P., Winge, P., Kusnierczyk, A., Tran, D. H., Bones, A. M. Molecular signatures in Arabidopsis thaliana in response to insect attack and bacterial infection. PLoS ONE. 8 (3), (2013).
- Zhang, J., Zhou, J. -. M. Plant immunity triggered by microbial molecular signatures. Mol. Plant. 3 (5), 783-793 (2010).
- Paterson, E., Gebbing, T., Abel, C., Sim, A., Telfer, G. Rhizodeposition shapes rhizosphere microbial community structure in organic soil. New Phytol. 173 (3), 600-610 (2006).
- Hartmann, A., Schmid, M., van Tuinen, D., Berg, G. Plant-driven selection of microbes. Plant Soil. 321 (1-2), 235-257 (2008).
- Micallef, S. A., Shiaris, M. P., Colon-Carmona, A. Influence of Arabidopsis thaliana accessions on rhizobacterial communities and natural variation in root exudates. J. Exp. Bot. 60 (6), 1729-1742 (2009).
- Burr, T., Otten, L. Crown gall of grape: Biology and disease management. Annu. Rev. Phytopathol. 37, 53-80 (2001).
- Clough, S. J., Bent, A. F. Floral dip: A simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Binns, A. N., Costantino, P., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. The Agrobacterium oncogenes. The Rhizobiaceae. , (1998).
- Gheysen, G., Angenon, G., Van Montagu, M., Lindsey, K. Agrobacterium-mediated plant transformation: a scientifically intriguing story with significant applications. Transgenic Plant Research. , (1998).
- Valvekens, D., Von Montagu, M. V., Van Lijsebettens, M. Agrobacterium tumefaciens-mediated transformation of Arabidopsis thaliana root explants by using kanamycin selection. Proc. Natl. Acad. Sci. USA. 85 (15), 5536-5540 (1988).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283 (1999).
- Chilton, M. D., et al. Stable incorporation of plasmid DNA into higher plant cells: The molecular basis of crown gall tumorigenesis. Cell. 11 (2), 263-271 (1977).
- Gelvin, S. B. Agrobacterium in the genomics age. Plant Physiol. 150 (4), 1665-1676 (2009).
- Subramoni, S., Nathoo, N., Klimov, E., Yuan, Z. -. C. Agrobacterium tumefaciens responses to plant-derived signaling molecules. Front. Plant Sci. 5, 322 (2014).
- Yuan, Z., Liu, P., Saenkham, P., Kerr, K., Nester, E. W. Transcriptome profiling and functional analysis of Agrobacterium tumefaciens reveals a general conserved response to acidic conditions (pH 5.5) and a complex acid-mediated signaling involved in Agrobacterium-plant interactions. J. Bacteriol. 190 (2), 494-507 (2008).
- Stachel, S. E., Messens, E., Van Montagu, M., Zambryski, P. Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agrobacterium tumefaciens. Nature. 318 (6047), 624-629 (1985).
- Memelink, J., de Pater, B. S., Hoge, J. H. C., Schilperoort, R. A. T-DNA hormone biosynthetic genes: Phytohormones and gene expression in plants. Dev. Genet. 8 (5-6), 321-337 (1987).
- Yuan, Z. -. C., et al. The plant signal salicylic acid shuts down expression of the vir regulon and activates quormone-quenching genes in Agrobacterium. Proc. Natl. Acad. Sci. USA. 104 (28), 11790-11795 (2007).
- Yuan, Z. -. C., Haudecoeur, E., Faure, D., Kerr, K. F., Nester, E. W. Comparative transcriptome analysis of Agrobacterium tumefaciens in response to plant signal salicylic acid, indole-3-acetic acid and γ-amino butyric acid reveals signalling cross-talk and Agrobacterium-plant co-evolution. Cell. Microbiol. 10 (11), 2339-2354 (2008).
- Li, P. L., Farrand, S. K. The replicator of the nopaline-type Ti plasmid pTiC58 is a member of the repABC family and is influenced by the TraR-dependent quorum-sensing regulatory system. J. Bacteriol. 182 (1), 179-188 (2000).
- Atkinson, M. M., Huang, J., Knopp, J. A. Hypersensitivity of suspension-cultured tobacco cells to pathogenic bacteria. Phytopathology. 75 (11), 1270-1274 (1985).
- Veena, ., Jiang, H., Doerge, R. W., Gelvin, S. B. Transfer of T-DNA and Vir proteins to plant cells by Agrobacterium tumefaciens induces expression of host genes involved in mediating transformation and suppresses host defense gene expression. Plant J. 35 (2), 219-236 (2003).
- León, J., Rojo, E., Sanchez-Serrano, J. J. Wound signalling in plants. J. Exp. Bot. 52 (354), 1-9 (2001).
- Ditt, R. F., Kerr, K. F., de Figueiredo, P., Delrow, J., Comai, L., Nester, E. W. The Arabidopsis thaliana transcriptome in response to Agrobacterium tumefaciens. Mol. Plant Microbe In. 19 (6), 665-681 (2006).
- Mandimba, G., Heulin, T., Bally, R., Guckert, A., Balandreau, J. Chemotaxis of free-living nitrogen-fixing bacteria towards maize mucilage. Plant Soil. 90 (1-3), 129-139 (1986).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiol. 148 (3), 1547-1556 (2008).
- Lee, C. W., et al. Agrobacterium tumefaciens promotes tumor induction by modulating pathogen defense in Arabidopsis thaliana. Plant Cell. 21 (9), 2948-2962 (2009).
- Reymond, P., Weber, H., Damond, M., Farmer, E. E. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis. Plant Cell. 12 (5), 707-720 (2000).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front. Plant Sci. 5, 252 (2014).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14 (1), 69 (2014).
- Conn, S. J., et al. Protocol: Optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9 (1), 4 (2013).
- Nathoo, N. . Identification of putative plant defense genes using a novel hydroponic co-cultivation technique for studying plant-pathogen interaction. , (2015).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol. 22 (12), 1567-1572 (2004).
- Wise, A. A., Liu, H., Binns, A. N. Nucleic acid extraction from Agrobacterium strains. Methods Mol. Bio. 343, 67-76 (2006).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat. Protoc. 1 (3), 1559-1582 (2006).
- Salter, M. G., Conlon, H. E. Extraction of plant RNA. Methods Mol. Bio. 362, 309-314 (2007).
- Bao, Y., Wang, S., Yang, X., Li, T., Xia, Y., Meng, X. Metabolomic study of the intervention effects of Shuihonghuazi Formula, a Traditional Chinese Medicinal formulae, on hepatocellular carcinoma (HCC) rats using performance HPLC/ESI-TOF-MS. J. Ethnopharmacol. 198, 468-478 (2017).
- Korves, T. M., Bergelson, J. A developmental response to pathogen infection in Arabidopsis. Plant Physiol. 133 (1), 339-347 (2003).
- Lyons, R., Rusu, A., Stiller, J., Powell, J., Manners, J. M., Kazan, K. Investigating the association between flowering time and defense in the Arabidopsis thaliana-Fusarium oxysporum interaction. PLoS ONE. 10 (6), e0127699 (2015).
- Badri, D. V., Weir, T. L., vander Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: Plant-microbe interactions. Curr. Opin. Biotechnol. 20 (6), 642-650 (2009).
- Baerson, S. R., et al. Detoxification and transcriptome response in Arabidopsis seedlings exposed to the allelochemical benzoxazolin-2(3H)-one. J. Biol. Chem. 280 (23), 21867-21881 (2005).

