体外在拟南芥中受精卵分化和胚模式的活体细胞成像的胚珠培养
Summary
这份手稿描述了一个体外胚珠培养方法, 使受精卵和胚胎的活细胞成像的拟南芥。该方法用于在受精卵分化过程中对细胞内动力学进行可视化, 并对发育中的胚胎的胞命运规范进行研究。
Abstract
在大多数开花植物中, 受精卵和胚都深藏在母体组织中, 因此长期以来一直是它们动态发展的奥秘;例如, 受精卵对立如何建立体轴, 以及胚胎在器官形成过程中如何指定各种细胞的命运。这份手稿描述了一个体外胚珠培养方法, 以执行受精卵和胚胎的活体细胞成像的拟南芥。优化的培养基允许受精卵或早期胚胎长成肥沃的植物。将其与聚 (烷) micropillar 阵列器件相结合, 在同一位置的液体介质中保存胚珠。这种固定是至关重要的观察相同的胚珠在显微镜下数天, 从合分裂到晚期胚胎阶段。由此产生的活细胞成像可用于监测受精卵极化的 real-time 动力学, 如细胞核迁移和细胞骨架重排, 以及胚胎模式中的细胞分裂时序和电池命运规范。此外, 这种胚珠培养系统可以与抑制剂结合, 分析各种因素对胚胎发育的影响, 并与光学操作, 如激光干扰, 以检查细胞通讯的作用。
Introduction
生物体的基本身体计划由单细胞受精卵发育而来。在大多数开花植物中, 合分裂产生一个顶端和一个基底细胞, 分别发育成芽和根,1。因此, 了解植物体在胚胎发生过程中是如何形成的是很重要的, 但是没有一个有效的工具可以直接观察受精卵和胚胎的动态, 因为它们在花朵深处发育。在一些单子叶植物种, 如玉米和大米, 一个体外受精方法已经建立2,3。在这种方法中, 分离的精子和卵细胞被电或化学熔化, 生成的细胞可以发展成一个肥沃的植物。然而, 在双子植物, 没有体外受精方法, 可以产生适当的胚胎, 大概是由于同步细胞周期状态的男性和女性的配子4,5。此外, 胚周围组织 (胚乳) 在胚胎发育中起重要作用6。
在一个模型双子物种,一. 南芥, 一个体外培养方法是通过专注于整个胚珠, 其中包含胚胎和胚乳的7。该系统成功地用于分析各种化学试剂对胚胎发生的影响, 但由于其存活率低, 不宜用于延时成像。因此, 开发了一种新的体外胚珠培养体系, 以便早于合子阶段开始, 并在高比例的8中产生肥沃的植株。经多次试验, 发现 Nitsch 培养基和海藻糖对胚珠的存活率有显著提高8。此外, 由于胚珠随着它的生长而扩展, 因此经常从显微镜的观察场移开, 因此开发了一种用于在培养基9中固定胚珠的硅橡胶装置。该设备使长期成像 3-4 天, 这是足够的跟踪发展从受精卵到心脏阶段的胚胎。使用这种方法, 不仅在正常条件下, 而且在化学抑制剂或各种突变体背景下, 也可以可视化受精卵极化和胚模式的动态,8,10 ,11。
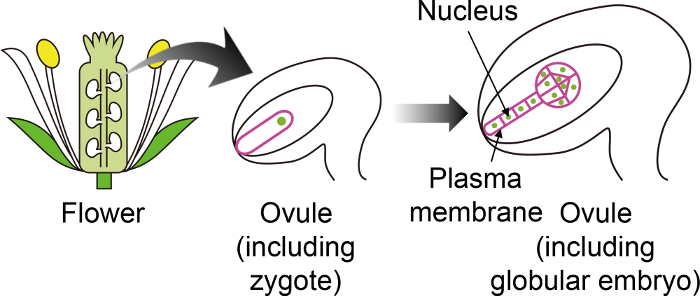
图 1: 用于显示受精卵和胚胎通过胚珠的特定荧光标记的原理图。
拟南芥受精卵发育成胚珠中的胚, 这是在花深处产生的。在这个体外培养系统中, 通过胚珠观察受精卵和胚胎, 因此使用其他胚珠组织中没有表达的特定荧光标记是很重要的。 请单击此处查看此图的较大版本.
Protocol
Representative Results
Discussion
这份手稿介绍了一个简单的体外胚珠培养协议, 这是有效的使用在活细胞成像的发展受精卵和胚胎。
根据胚阶段的需要, 对该装置的设计进行优化。第一个被开发的设备是一个 microcage 阵列调整方向和固定胚珠9的位置, 然后构造一个 micropillar 设备来更有效地捕获胚珠8。此外, micropillars 比 microcage 更薄、更柔软, 因此不会在长期观察中?…
Declarações
The authors have nothing to disclose.
Acknowledgements
这项工作的显微镜是在名古屋大学的变革性生物分子 (ITbM) 研究所进行的, 并得到日本先进植物科学网的支持。这项工作得到了日本科学技术局 (ERATO 项目到骅和 M.U.) 和日本促进科学协会的赠款的支持: 创新领域科学研究补助金 (Nos。JP24113514, JP26113710, JP15H05962, JP15H05955 M.U., Nos。JP16H06465, JP16H06464 和 JP16K21727 为 H), 补助金为年轻科学家 (B, Nos。JP24770045 和 JP26840093 为 M.U.), 和补助金挑战探索性研究 (No。JP16K14753 为 M.U.)。
Materials
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Referências
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).

