In Vitro Ovule dyrkning for Live-celle Imaging af Zygote polarisering og Embryo mønstre i Arabidopsis thaliana
Summary
Dette manuskript beskriver en in vitro- ovule dyrkning metode, der muliggør live-celle billeddannelse af Arabidopsis zygotes og embryoner. Denne metode er udnyttet til at visualisere den intracellulære dynamics under zygote polarisering og celle skæbne specifikation i udviklingen af embryoner.
Abstract
I de fleste blomstrende planter, befrugtede æg og embryo er skjult dybt inde i mor væv, og dermed har det længe været et mysterium af hvordan de udvikler sig dynamisk; for eksempel, hvordan zygote polarizes for at fastslå kroppens akse og hvordan fosteret angiver forskellige celle skæbner under orgel dannelse. Dette manuskript beskriver en in vitro- ovule kultur metode for at udføre live-celle imaging for at udvikle zygotes og embryoner fra Arabidopsis thaliana. Optimeret dyrkning medium tillader zygotes eller tidlige embryoner til at vokse i frodige planter. Ved at kombinere det med en poly(dimethylsiloxane) (PDMS) micropillar array enhed, afholdes ovule i Lage i samme situation. Denne fiksering er afgørende for at observere den samme ovule under et mikroskop i flere dage fra zygotisk division til embryo sent. Den resulterende live-celle billedbehandling kan bruges til at overvåge real-time dynamikken i zygote polarisering, som nukleare migration og cytoskeleton omlejring, og også celledeling timing og celle skæbne specifikation under embryo mønstre. Desuden, denne ovule dyrkning systemet kan kombineres med hæmmer behandlinger til at analysere forskellige faktorer virkninger på embryo udvikling og optisk manipulationer såsom laser forstyrrelser til at undersøge rollen i celle-celle kommunikation.
Introduction
Den grundlæggende kroppen plan af en organisme udvikler sig fra en encellet zygote. I de fleste blomstrende planter genererer zygotisk division en apikale og en basal celle, som udvikles til at skyde og rod, henholdsvis1. Derfor er det vigtigt at forstå hvordan selve planten er dannet under embryogenese, men der har ikke været et effektivt redskab til direkte observere dynamikken i levende zygotes og embryoner, fordi de udvikler dybt inde i blomsten. I flere monocot arter, såsom majs og ris, er en in vitro- befrugtning metode blevet etableret2,3. I denne metode, isolerede sæd- og ægceller er smeltet elektrisk eller kemisk og den genererede celle kan udvikle sig til en frugtbar plante. I dicot planter er der imidlertid ingen in vitro- befrugtning metode, der kan producere ordentlig embryoner, formentlig på grund af den ikke-synkroniseret cellecyklus tilstand af mandlige og kvindelige mælke4,5. Derudover spiller embryo-omkringliggende væv (endosperm) vigtige roller i embryo udvikling6.
I en model dicot arter, A. thaliana, blev en i vitro dyrkning metode udviklet ved at fokusere på hele ovule, som indeholder både Foster og frøhvide7. Dette system blev med held bruges til at analysere virkningerne af forskellige kemiske reagenser på embryogenese, men det er ikke egnet for time-lapse imaging, fordi det har en lav overlevelsesrate. Derfor, en roman i vitro ovule dyrkning systemet blev udviklet for at starte så tidligt som zygote fase og producere frugtbare planter på en høj forholdet8. Efter forskellige forsøg, det blev konstateret, at Nitsch medium og trehalose væsentligt forbedret overlevelsesraten for æganlæggene8. Derudover fordi ovule udvider som det vokser og dermed ofte bevæger sig væk fra feltet observation af mikroskopet, blev en PDMS enhed udviklet for at løse ovule i medium9. PDMS enheden aktiveret den langsigtede imaging for 3-4 dage, hvilket er tilstrækkeligt til at spore udviklingen fra en zygote til en hjerte-fase embryo. Brug denne metode, bliver det muligt at visualisere dynamikken i zygote polarisering og embryo mønster, ikke kun under normale forhold, men også i nærværelse af kemiske hæmmere eller i forskellige mutant baggrunde8,10 ,11.
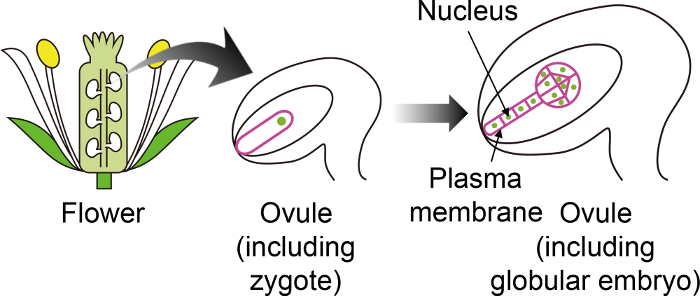
Figur 1: Skematisk Diagram over den specifikke fluorescerende markører, der anvendes til at visualisere Zygotes og embryoner gennem Ovule.
Arabidopsis zygote udvikler sig til et foster i ovule, som genereres dybt inde i blomsten. I dette in vitro dyrkning systemet, befrugtede æg og embryo er observeret gennem ovule, og derfor er det vigtigt at bruge specifikke fluorescerende markører, der ikke er udtrykt i andre ovule væv. Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Dette manuskript introducerer en enkel in vitro- ovule dyrkning protokol, der er effektiv til brug i live-celle imaging for at udvikle zygotes og embryoner.
Design af enhedens PDMS muligvis optimering efter den embryonale fase. Den første udviklede enhed var en microcage array til at justere retningen og til at fastsætte placeringen af ovules9, og derefter en micropillar enhed blev bygget for at fælde æganlæg mere effektivt8. Desude…
Declarações
The authors have nothing to disclose.
Acknowledgements
Mikroskopi i dette arbejde var udført på Institut for Transformative Bio-molekyler (WPI-ITbM) Nagoya University og understøttes af Japan avanceret anlæg videnskab netværk. Dette arbejde blev støttet af tilskud fra Japan videnskab og teknologi Agency (ERATO projekt til T.H. og M.U.) og fra Japan-samfund til fremme af videnskab: en licensbetaling for videnskabelig forskning på Innovative områder (Nos. JP24113514, JP26113710, JP15H05962 og JP15H05955 for M.U. og Nos. JP16H06465, JP16H06464 og JP16K21727 for T.H), en licensbetaling for unge forskere (B, nr. JP24770045 og JP26840093 for M.U.), og en licensbetaling for udfordrende sonderende forskning (nr. JP16K14753 for M.U.).
Materials
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Referências
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).

