생체 외에서 라이브 셀 이미징의 접합 자 양극 화와 애기 thaliana 패터 닝 태아 난 재배
Summary
이 원고는 체 외에 난 재배 방법을 라이브 셀 이미징 애기 zygotes 및 배아의 수를 설명 합니다. 이 메서드는 zygote 분극 동안 세포내 역학 및 배아 개발 세포 운명 명세를 시각화 하기 위해 이용 된다.
Abstract
대부분의 현 화 식물에 어머니 조직에 깊이 숨겨진 zygote과 태아 하 고 따라서 그것은 오래. 개발 방법의 신비 예를 들어는 zygote 몸 축 설정 하에서 어떻게 하 고 어떻게 태아 장기 형성 동안 다양 한 세포 운명을 지정 합니다. 이 원고는 체 외에 난 문화 메서드를를 라이브 셀 이미징 zygotes과 애기 thaliana의 배아 개발에 대해 설명 합니다. 최적화 된 재배 매체 zygotes 또는 초기 배아 비옥한 식물에 성장 수 있습니다. Poly(dimethylsiloxane) (PDMS) micropillar 배열 장치와 함께 그것을 결합 하 여는 난 같은 위치에 액체 매체에서 개최 됩니다. 이 기정은 늦은 배아 단계에 zygotic 부문에서 몇 일 동안 관찰 하는 현미경 같은 난 중요 합니다. 결과 라이브 셀 이미징 핵 이동 및 골격 재배열, 및 또한 세포 분열 타이밍 및 배아 패턴화 하는 동안 세포 운명 명세와 같은 접합 자 분극의 실시간 역학을 모니터링 하는 데 사용할 수 있습니다. 또한, 배아 개발, 다양 한 요인의 영향을 분석할 억제제 치료와 레이저-셀 통신의 역할을 검토 중단 등 광학 조작이 난 재배 시스템에 결합할 수 있습니다.
Introduction
체의 기본적인 몸 계획 단 세포 접합 자에서 개발 한다. 대부분 꽃 식물, zygotic 사업부는 꼭대기와 촬영 및 루트, 각각1로 발전 하는 기저 세포를 생성 합니다. 따라서, embryogenesis, 동안 식물 몸은 형성 하는 방법을 이해 하는 것이 중요 하다 하지만 그들은 꽃에서 깊은 곳에서 개발 하기 때문에 직접 생활 zygotes 및 배아의 역학을 관찰 하는 효과적인 도구가 되지 않았습니다. 옥수수, 쌀, 등 여러 monocot 종, 체 외에서 수정 방법 설립된2,3되었습니다. 이 방법에서는, 고립 된 정자 및 난 자 세포 융합 하는 전기적 또는 화학적으로, 그리고 생성 된 셀 비옥한 식물으로 개발할 수 있습니다. 그러나, dicot 식물, 체 외에서 수정 방법 남성과 여성 gametes4,5의 세포 주기 비 동기화 상태 때문에 아마도 적절 한 배아를 생산할 수 있다. 또한, 태아를 둘러싼 조직 (endosperm) 배아 개발6에 중요 한 역할을 담당합니다.
모델 dicot 종, A. thaliana, 생체 외에서 재배 방법 배아와 endosperm7포함 전체 난에 초점을 맞춤 으로써 개발 되었다. 이 시스템은 성공적으로 embryogenesis에 다양 한 화학 시 약의 효과 분석 하는 데 사용 됩니다 하지만 낮은 생존 율을가지고 있기 때문에 시간 경과 영상에 적합 하지 않습니다. 따라서, 소설 체 외에 난 재배 시스템 접합 자 단계도 일찍 시작 하 고 높은 비율8에 비옥한 식물 생산 개발 되었다. 다양 한 실험 후 그 니 매체 발견 이었고, 트 레 할 로스는 크게 ovules8의 생존 율을 개선. 또한, 때문에 난 그것은 성장 하 고 따라서 현미경의 관측 분야에서 자주 이동 확장, PDMS 장치 매체9에 난을 해결 하기 위해 개발 되었다. PDMS 장치는 심장-단계 배아에는 접합 자에서 개발을 추적 하기에 충분 한 3-4 일에 대 한 장기적인 이미지를 사용할 수 있습니다. 이 방법을 사용 하 여, 그것은 된다 zygote 양극 화와 패턴, 뿐만 아니라 정상적인 조건 하에서 하지만 또한 화학 억제제 존재 또는 다양 한 돌연변이 배경8,10에서에서 배아의 역학을 시각화 수 ,11.
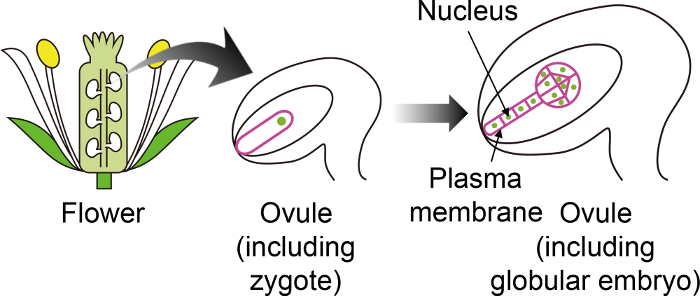
그림 1: 특정 형광 마커 난 통해 배아 Zygotes 시각화 하는 데 사용의 회로도.
애기 zygote 꽃 깊숙한 생성 되는 난에 배아로 발전 한다. 이 체 외에서 배양 시스템, zygote 및 태아는 난을 통해 관찰 하 고 따라서 다른 난 조직에 표시 되지 않는 특정 형광 마커를 사용 하는 것이 중요 하다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Protocol
Representative Results
Discussion
이 원고는 간단한 체 외에 난 재배 하는 프로토콜 zygotes와 배아 개발의 라이브 셀 이미징에 사용 하기 위해 효율적인 소개 합니다.
PDMS 장치 디자인은 배아 단계에 따라 최적화를 할 수 있습니다. 첫 번째 개발된 장치 microcage 배열 방향을 조정 하 고 수정 ovules9의 위치를 그리고 다음 micropillar 장치 ovules를 보다 효율적으로 함정을 건설 되었다<sup class="xre…
Declarações
The authors have nothing to disclose.
Acknowledgements
이 작품에서 현미경에서 연구소의 Transformative 바이오-분자 (WPI-ITbM) 나고야 대학의 실시 되었고 일본 고급 식물 과학 네트워크에 의해 지원. 이 작품 과학의 승진을 위한 일본 사회와 일본 과학 및 기술 기관 (ERATO 프로젝트 남 M.U.)에서 교부 금에 의해 지원 되었다: 선진적인 과학 연구에 대 한 혁신적인 지역 (번호. JP24113514, JP26113710, JP15H05962, 및 M.U., 및 개에 대 한 JP15H05955. JP16H06465, JP16H06464 및 JP16K21727 T.H에 대 한), (B, Nos 젊은 과학자에 대 한 특정. JP24770045 및 M.U.에 대 한 JP26840093), 그리고 도전적인 탐구 연구 (제에 대 한 특정 M.U.에 대 한 JP16K14753)입니다.
Materials
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Referências
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).

