In Vitro Ovule dyrking for Live-celle Imaging av zygoten polarisering og Embryo mønstre Arabidopsis thaliana
Summary
Dette manuskriptet beskriver en i vitro ovule dyrking metode gjør live-celle avbildning av Arabidopsis zygotes og embryo. Denne metoden benyttes for å visualisere intracellulær dynamikken i zygote polarisering og celle skjebne spesifikasjonen i utvikling embryo.
Abstract
I de fleste planter, zygote og embryo er skjult dypt i mor vev, og dermed det har lenge vært et mysterium hvordan de utvikler dynamisk; for eksempel hvordan zygoten polarizes for å etablere den kroppen og hvordan embryoet angir ulike celle skjebne under orgel formasjon. Dette manuskriptet beskriver en i vitro ovule kultur metode for å utføre live-celle imaging for å utvikle zygotes og embryoene til Arabidopsis thaliana. Optimalisert dyrking mediet kan zygotes eller tidlig embryo å vokse inn i frodige planter. Ved å kombinere det med en poly(dimethylsiloxane) (PDMS) micropillar matrise enhet, holdes ovule i flytende medium i samme posisjon. Denne fiksering er avgjørende å observere den samme ovule under et mikroskop i flere dager fra zygotic divisjon til sent embryoet stadium. Den resulterende live-celle bildebehandling kan brukes til å overvåke sanntid dynamikken i zygote polarisasjon, som kjernefysisk migrasjon og cytoskjelett omorganisering, og også celledeling timing og celle skjebne spesifikasjoner under embryoet mønstre. Videre kan ovule dyrking systemet kombineres med hemmer behandlinger å analysere effekten av ulike faktorer på embryo utvikling, og optiske endringer som laser forstyrrelsen å undersøke rollen av celle-celle kommunikasjon.
Introduction
Den grunnleggende kropp planen for en organisme utvikler seg fra en encellet zygote. I de fleste planter genererer zygotic divisjon en apikale og en basal celle, som utvikler seg til skyte- og rot, henholdsvis1. Derfor er det viktig å forstå hvordan selve anlegget dannes under embryogenesis, men det er ikke et effektivt verktøy til å direkte observere dynamikken i levende zygotes og embryo fordi de utvikle dypt i blomst. I flere monocot arter, som mais og ris, har en i vitro fertilisering metoden vært etablert2,3. I denne metoden isolert sæd og egg celler er smeltet elektrisk eller kjemisk og genererte cellen kan utvikle seg til en frodig plante. Men i dicot planter finnes det ingen i vitro fertilisering metode som kan produsere riktig embryoer, antagelig grunn ikke-synkroniserte celle syklus av mannlige og kvinnelige gameter4,5. I tillegg spiller embryoet omkringliggende vev (endosperm) viktige roller i embryo utvikling6.
I modellen dicot Art, A. thaliana, ble en i vitro dyrking metoden utviklet ved å fokusere på det hele ovule, som inneholder både embryoet og endosperm7. Dette systemet ble brukt til å analysere effekten av ulike kjemiske reagenser på embryogenesis, men det er ikke egnet for time-lapse imaging fordi den har en lav overlevelse. Derfor ble en roman i vitro ovule dyrking-systemet utviklet for å starte så tidlig som zygote trinn og produsere fruktbare planter på høy ratio8. Etter ulike forsøk, det ble funnet at Nitsch medium og trehalose forbedret overlevelse av ovules8. I tillegg fordi ovule utvides som det vokser og dermed ofte flytter fra feltet observasjon av mikroskopet, ble en PDMS enhet utviklet for å fastsette ovule i middels9. PDMS enheten aktivert langsiktige avbilding for 3-4 dager, som er tilstrekkelig til å spore utviklingen fra en zygote til en hjerte-trinns fosteret. Bruker denne metoden, blir det mulig å visualisere dynamikken i zygote polarisering og embryo mønstre, ikke bare under normale forhold, men også i nærvær av kjemiske hemmere eller i ulike mutant bakgrunner8,10 ,11.
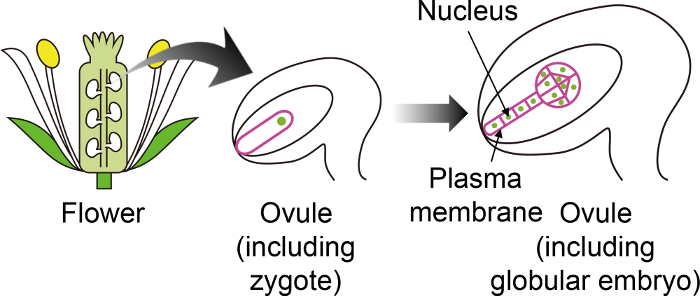
Figur 1: Skjematisk Diagram for den bestemte fluorescerende brukes til å visualisere Zygotes og embryo gjennom Ovule.
Arabidopsis zygoten utvikler seg til et embryo i ovule, som genereres dypt inni blomsten. I dette i vitro dyrking systemet, zygote og embryo er observert gjennom ovule, og derfor er det viktig å bruke bestemte fluorescerende markører som ikke er uttrykt i andre ovule vev. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Dette manuskriptet introduserer en enkel i vitro ovule dyrking protokoll som er effektiv for bruk i live-celle avbilding av utvikle zygotes og embryo.
Utformingen av PDMS enheten må optimalisering ifølge embryoet scenen. Den første utviklede enheten var en microcage matrise å justere retningen og fastsette posisjonen av ovules9, og deretter en micropillar enhet ble bygget for å fange ovules mer effektivt8. Videre, micropillars er ty…
Declarações
The authors have nothing to disclose.
Acknowledgements
Mikroskopi i dette arbeidet ble utført ved Institutt for Transformative Bio-molekylene (WPI-ITbM) i Nagoya University og støttes av Japan avansert Plant Science nettverket. Dette arbeidet ble støttet av tilskudd fra Japan vitenskap og teknologi Agency (ERATO prosjekt th og M.U.) og Japan Society for fremme av vitenskap: en Grant-in-Aid for vitenskapelig forskning på nyskapende områder (Nos. JP24113514, JP26113710, JP15H05962 og JP15H05955 for M.U. og Nos. JP16H06465, JP16H06464 og JP16K21727 for T.H), en Grant-in-Aid for unge forskere (B, Nos. JP24770045 og JP26840093 for M.U.), og en Grant-in-Aid for utfordrende utforskende forskning (nr. JP16K14753 for M.U.).
Materials
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Referências
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).

