病人体温控制的食管传热及靶温管理
Summary
本研究提出了一种新的方法, 以提供有效的病人体温控制降温或变暖患者。一个单一的使用, 三重流明装置被放置到食道, 类似于一个标准的 orogastric 管, 并连接到现有的热交换单位执行自动病人温度管理。
Abstract
控制病人体温对各种临床情况都很重要。冷却到正常或低于正常体温通常是对缺血性侮辱后的神经保护 (如出血性中风, 蛛网膜下腔出血, 心脏骤停, 或其他缺氧性损伤)。从发热状态降温可以治疗发热, 减少热疗对受损神经元的负面影响。患者在手术室内进行加温, 以防止意外的围手术期体温过低, 这是众所周知的导致增加失血, 伤口感染, 和心肌损伤, 同时也延长恢复时间。有许多报告的温度管理方法, 包括重新调整标准用品 (如: 如, 冰, 冷盐水, 风扇, 毛毯) 的简易方法, 但更复杂的技术设计的温度管理通常更成功地提供优化的协议。在过去的十年中, 先进的技术已经开发了大约两种传热方法: 表面设备 (水毯, 强迫空气加热器) 或血管内设备 (不育导管需要血管放置)。最近, 一种新颖的装置被放置在食道, 类似于标准的 orogastric 管, 提供有效的热量传递通过病人的核心。该设备连接到现有的热交换单元, 允许通过伺服机构自动病人温度管理, 使用标准温度传感器 (直肠, 福利, 或其他核心温度传感器) 的病人温度作为输入变量。这种方法消除了血管放置并发症 (深静脉血栓, 中央线相关的血流感染), 减少阻碍病人进入, 并导致较少颤抖时, 与表面的方法。公布的数据也显示了高度的准确性和维护的目标温度使用食道方法的温度管理。因此, 这种方法的目的是提供一种低风险的替代方法, 以控制病人的体温在关键护理设置。
Introduction
在治疗范围广泛的情况下, 有必要对病人进行体温管理, 包括心跳骤停、顽固性或复发性发热、神经原发热和大手术。在美国, 每年有50万次心脏骤停是在医院 (例如, 在接受一般医疗或外科治疗的病人中)1或出院 (例如, 在家里或在公共场所,然后被带到紧急部门)2。在这两种情况下, 患者的结果是显着改善的, 当积极的温度管理是3和目标温度管理 (TTM) 是一个标准的护理心脏骤停自2005年以来。在美国的4中, 每年有超过500万患者被送往重症监护病房。其中, 发热发展多达45% 的 non-neurologically 受伤患者5和多达70% 的神经受伤患者6。在重症监护病房发烧控制与改善的结果和减少死亡的风险相关, 因为升高的温度增加新陈代谢的需求, 恶化脑缺血, 并且增加神经元损失7。美国每年至少进行1000万次手术, 需要积极的患者加温, 以防止意外的围手术期体温过低8。在手术室, 手术患者应保持体温在36° c 以上, 避免大量的不良反应。在手术前、期间或术后, 未计划的体温下降会增加失血、感染和住院时间, 这使每位患者的住院费增加了7000美元或更多的费用9,10,11 ,12。
尽管临床上有很大的需要, 但最广泛的温度管理协议显示了不充分的表现或给病人带来重大风险。表面设备 (如水毯、传导床垫和强制空气盖) 都很繁琐, 传热能力有限, 必须将其移除, 以使病人能够获得病人的护理和程序。血管内设备是侵入性的, 难以放置, 并容易引起患者感染和血栓。现有的方法, 以防止意外的围手术期低温无法维持常温70% 的时间12,13,14,15,16和回顾性分析post-cardiac 逮捕冷却发现, 总体而言, 30% 的患者未能达到目标温度在6小时17。
食道的病人温度管理方法为现有技术提供了很大的优势18。食道温度管理装置保持胃管的功能, 通常放置在危重护理和外科病人人群。它允许持续的胃吸气和减压的气体和液体, 同时增加能力, 以安全有效地控制病人的体温, 利用良好的热交换环境的食道 (图 1)。通过将食道温度管理装置与使用水作为冷却剂的几种外部热交换器 (也称为冷水机组) 连接, 实现了温度调制。几家供应商生产的兼容热交换器可在医院为现有的温度控制产品 (通常是水毯子) 提供动力。护士, 护士医生, 或医生通常放置一个食道温度管理装置, 但它也可以插入任何提供培训, 以放置一个标准的 orogastric 管。食道温度管理装置不限制病人的接触, 不需要消毒, 避免了在提供者中发生针刺伤的风险, 避免了患者的皮肤并发症、血液感染和血栓的风险。因此, 这种方法的目的是提供一个低风险的替代方法, 控制病人的体温在危重护理和手术室设置。
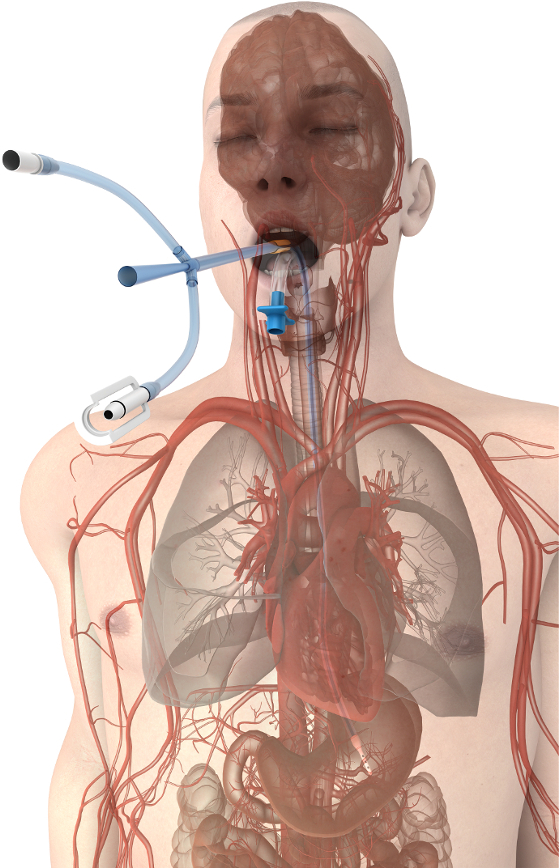
图1。食管温度管理装置放置.设备接近伟大的船只和心脏促进有效的传热在病人的核心。请单击此处查看此图的较大版本.
Protocol
Representative Results
Discussion
此协议所需的修改和故障排除通常仅限于上面所述的内容, 并涉及在关键护理设置中使用的病人护理的典型监控。在越来越多的临床场景中, 调节核心温度对患者的预后至关重要。这些包括有意诱导低温从常温, 温从无意或故意低温, 并积极保持正常体温 (即, 常温) 的情况下, 在无意中低温常见的, 如在手术室里。作为具体的临床例子, 病人谁遭受缺血再灌注损伤, 如发生在心脏骤停, 受益于降温 (一般温度低于正常体温), 其次是温和的温和发烧预防高达3复苏后的天数28,29,30。新生儿缺氧缺血性脑病得到改善的结果, 如果冷却低于正常体温31。肾脏捐献者在器官移植前的神经死亡后冷却, 已被证明可以降低延迟移植功能的速度32。控制感染性休克患者的发烧可能减少升压的需求, 并有助于降低早期死亡率33。维持常温在外科手术中的病人减少手术伤口感染, 心肌并发症, 失血和输血要求, 同时缩短住院时间和减少死亡的可能性10,11,16。
该技术的局限性包括在管理危重病人方面遇到的挑战。虽然目标温度管理可以促进良好的结果, 但最常见的温度调制技术会给患者带来风险, 给提供者带来后勤挑战 (包括安置困难、血液感染、血栓、皮肤损伤和成本)。食道温度管理是为了克服这些缺点而设计的34,35,36。当适当地管理, 食道温度管理设备不接触与血管 (象血管内温度调节装置) 或皮肤 (象表面温度调制设备), 因此避免血液凝结, 血液感染和皮肤退化。该设备可由各种医疗保健提供商快速放置, 通常在几分钟内21,37。插入技术模仿标准的 orogastric 管放置, 这会使工作流中断最小化, 从而延缓治疗的启动。使用核心的方法也显得比表面的方法更少颤抖的负担27,38,39,40 。这样做的好处是减少镇静剂和 anti-shivering 的药物成本, 从而缩短病人的住院时间, 从较低的镇静程度中更快地觉醒。这些功能, 考虑与上述临床表现, 支持食道温度管理作为一个可行的选择提供者在急诊室, 重症监护病房和手术室。在设备上发布的一组不断增长的数据同样支持此新方法21、22、23、24、27、41。
协议中的关键步骤包括在插入之前在设备内启动流程, 为设备提供足够的润滑, 以确保容易放置, 执行胃吸痰和减压, 以允许最大程度的接触设备和病人, 并解决任何病人颤抖, 可能会发展。遵循这一协议将提供最佳的结果, 并允许高度的性能和安全的照顾这一重要的病人人口。
Declarações
The authors have nothing to disclose.
Acknowledgements
没有.
Materials
| EnsoETM | Attune Medical | ECD01 | Device compatible with Gaymar/Stryker Medi-Therm III and Stryker Altrix Precision Temperature Management System |
| EnsoETM | Attune Medical | ECD02 | Device compatible with Cincinnati SubZero Blanketrol II and Cincinnati SubZero Blanketrol III |
| Gaymar/Stryker Medi-Therm III | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Cincinnati SubZero Blanketrol II | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Cincinnati SubZero Blanketrol III | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Stryker Altrix Precision Temperature Management System | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Water-soluble lubricant | Various | n/a | Standard water-soluble lubricant used to ease insertion of tubes, catheters, and digits |
| Securement device | Various | n/a | E.g., Guard360 by PrimeGuard Medical |
Referências
- Chan, P. S., Krumholz, H. M., Nichol, G., Nallamothu, B. K. Delayed time to defibrillation after in-hospital cardiac arrest. N Engl J Med. 358 (1), 9-17 (2008).
- Callans, D. J. Out-of-Hospital Cardiac Arrest — The Solution Is Shocking. N Engl J Med. 351 (7), 632-634 (2004).
- Kochanek, P. M., Jackson, T. C. The Brain and Hypothermia-From Aristotle to Targeted Temperature Management. Crit Care Med. 45 (2), 305-310 (2017).
- Laupland, K. B., et al. Occurrence and outcome of fever in critically ill adults. Crit Care Med. 36 (5), 1531-1535 (2008).
- Diringer, M. N., Reaven, N. L., Funk, S. E., Uman, G. C. Elevated body temperature independently contributes to increased length of stay in neurologic intensive care unit patients. Critical Care Medicine. 32 (7), 1489-1495 (2004).
- Laupland, K. B. Fever in the critically ill medical patient. Critical care medicine. 37 (Suppl 7), S273-S278 (2009).
- Mathias, J. M. Hospitals to report on normothermia. OR manager. 25 (9), 22-24 (2009).
- Rajagopalan, S., Mascha, E., Na, J., Sessler, D. I. The effects of mild perioperative hypothermia on blood loss and transfusion requirement. Anesthesiology. 108 (1), 71-77 (2008).
- Kurz, A., Sessler, D. I., Lenhardt, R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N Engl J Med. 334 (19), 1209-1215 (1996).
- Sessler, D. I. New surgical thermal management guidelines. Lancet. 374 (9695), 1049-1050 (2009).
- Young, V. L., Watson, M. E. Prevention of perioperative hypothermia in plastic surgery. Aesthet Surg J. 26 (5), 551-571 (2006).
- Hedrick, T. L., et al. Efficacy of protocol implementation on incidence of wound infection in colorectal operations. J Am Coll Surg. 205 (3), 432-438 (2007).
- Forbes, S. S., et al. Implementation of evidence-based practices for surgical site infection prophylaxis: results of a pre- and postintervention study. J Am Coll Surg. 207 (3), 336-341 (2008).
- Sun, Z., et al. Intraoperative core temperature patterns, transfusion requirement, and hospital duration in patients warmed with forced air. Anesthesiology. 122 (2), 276-285 (2015).
- Leary, M., et al. The association of body mass index with time to target temperature and outcomes following post-arrest targeted temperature management. Resuscitation. 85 (2), 244-247 (2014).
- Naiman, M., Shanley, P., Garrett, F., Kulstad, E. Evaluation of advanced cooling therapy’s esophageal cooling device for core temperature control. Expert Rev Med Devices. 13 (5), 423-433 (2016).
- Naiman, M., Markota, A., Hegazy, A. F., Dingley, J., Kulstad, E. Temperature Management in Critical Care and Burn Patients using an Esophageal Heat Transfer Device. Military Medicine. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Althenayan, E. Temperature control in critically ill patients with a novel esophageal cooling device: a case series. BMC Anesthesiol. 15, 152 (2015).
- Bukovnik, N., Markota, A., Velnar, T., Rebol, J., Sinkovic, A. Therapeutic hypothermia and inhalation anesthesia in a patient with severe pneumococcal meningitis and secondary cardiac arrest. Am J Emerg Med. 35 (4), 665.e665-665.e666 (2017).
- Markota, A., Fluher, J., Kit, B., Balazic, P., Sinkovic, A. The introduction of an esophageal heat transfer device into a therapeutic hypothermia protocol: A prospective evaluation. Am J Emerg Med. 34 (4), 741-745 (2016).
- Markota, A., Kit, B., Fluher, J., Sinkovic, A. Use of an oesophageal heat transfer device in therapeutic hypothermia. Resuscitation. 89, e1-e2 (2015).
- Schroeder, D. C., et al. Oesophageal heat exchangers with a diameter of 11mm or 14.7mm are equally effective and safe for targeted temperature management. PLoS One. 12 (3), e0173229 (2017).
- Williams, D., et al. Use of an Esophageal Heat Exchanger to Maintain Core Temperature during Burn Excisions and to Attenuate Pyrexia on the Burns Intensive Care Unit. Case Reports in Anesthesiology. 2016, 6 (2016).
- Khan, I., et al. . 14th Annual Neurocritical Care Society Meeting. , (2016).
- HACA. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 346 (8), 549-556 (2002).
- Bernard, S. A., et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med. 346 (8), 557-563 (2002).
- Callaway, C. W., et al. Part 8: Post-Cardiac Arrest Care: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S465-S482 (2015).
- Wyckoff, M. H., et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S543-S560 (2015).
- Niemann, C. U., et al. Therapeutic Hypothermia in Deceased Organ Donors and Kidney-Graft Function. N Engl J Med. 373 (5), 405-414 (2015).
- Schortgen, F., et al. Fever control using external cooling in septic shock: a randomized controlled trial. Am J Respir Crit Care Med. 185 (10), 1088-1095 (2012).
- Reccius, A., Mercado, P., Vargas, P., Canals, C., Montes, J. Inferior Vena Cava Thrombosis Related to Hypothermia Catheter: Report of 20 Consecutive Cases. Neurocrit Care. 23 (1), 72-77 (2015).
- Maze, R., et al. Endovascular cooling catheter related thrombosis in patients undergoing therapeutic hypothermia for out of hospital cardiac arrest. Resuscitation. 85 (10), 1354-1358 (2014).
- Simosa, H. F., Petersen, D. J., Agarwal, S. K., Burke, P. A., Hirsch, E. F. Increased risk of deep venous thrombosis with endovascular cooling in patients with traumatic head injury. Am Surg. 73 (5), 461-464 (2007).
- Kulstad, E., et al. Induction, maintenance, and reversal of therapeutic hypothermia with an esophageal heat transfer device. Resuscitation. 84 (11), 1619-1624 (2013).
- van Zanten, A. R., Polderman, K. H. Blowing hot and cold? Skin counter warming to prevent shivering during therapeutic cooling. Crit Care Med. 37 (6), 2106-2108 (2009).
- Tommasi, E., et al. Cooling techniques in mild hypothermia after cardiac arrest. J Cardiovasc Med. , (2014).
- Diringer, M. N. Treatment of fever in the neurologic intensive care unit with a catheter-based heat exchange system. Crit Care Med. 32 (2), 559-564 (2004).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. 46 (3), 143-148 (2017).

