In Vivo EPR-Bewertung der pH, pO2, Redox-Status, und Konzentrationen von Phosphat und Glutathion in der Tumor-Mikroumgebung
Summary
Low-Bereich (L-Band, 1,2 GHz) Elektron paramagnetischen Resonanz mit löslichen Nitroxyl und Trityl Sonden wird zur Beurteilung der physiologisch wichtigen Parameter in den Tumor Mikroumgebung in Mausmodellen von Brustkrebs gezeigt.
Abstract
Dieses Protokoll zeigt die Fähigkeit der Low-Bereich Elektron paramagnetischen Resonanz (EPR)-basierte Techniken in Kombination mit funktionalen paramagnetischen Sonden quantitative Angaben zu den chemischen Tumor Mikroumgebung (TME), einschließlich p O2, pH-Wert, Redox-Status, Konzentrationen von interstitiellen anorganischem Phosphat (Pi) und intrazellulären Glutathion (GSH). Insbesondere eine Anwendung einer neu entwickelten lösliche multifunktionale Trityl Sonde bietet unübertroffene Möglichkeit für in Vivo gleichzeitige Messungen von pH, pO2 und Pi E Xtracellular Raum (Hoffnung Sonde). Die Messungen der drei Parameter, die mit einer einzigen Sonde erlauben ihre Korrelation Analysen unabhängig von Sonde Verteilung und Zeit der Messungen.
Introduction
Eine zentrale Rolle des TME in der Tumorprogression und Therapie ist immer geschätzt1. Unter wichtige physiologische Parameter von TME in soliden Tumoren, Gewebe Hypoxie2, Azidose3,4, hohe Reduzierung Kapazität5, erhöhte Konzentrationen von intrazellulären GSH-6,–7, und interstitielle Pi8 sind gut dokumentiert. Nicht-invasive in-vivo pO2, pH-Wert, Pi, GSH und Redox Bewertungen bieten einzigartige Einblicke in die biologischen Prozesse im TME und voraus-Tools für präklinische Screening von Anti-Krebs-Medikamente und TME-gezielte therapeutische Strategien zu helfen. Eine vernünftigen Radiofrequenz Eindringtiefe im Gewebe durch Magnetresonanz-Bildgebung (MRI) und Low-Bereich EPR-basierte Techniken macht sie das am besten geeignete Ansätze für nicht-invasive Beurteilung dieser TME-Parameter. MRI stützt sich weitgehend auf bildgebende Wasser Protonen und ist weit verbreitet in klinischen Einrichtungen, anatomische Auflösung bieten aber funktionelle Lösung fehlt. Die Kernspinresonanz Phosphor-31 (31P-NMR) Messungen der extrazellulären Pi Konzentration und pH-Wert basierend auf ein Signal von endogenen Phosphat sind potentiell attraktiv für TME Charakterisierung, aber sind normalerweise um ein Vielfaches maskiert höheren intrazellulären Pi Konzentrationen9,10. Im Gegensatz dazu EPR-Messungen setzen auf Spektroskopie und Bildgebung des speziell entworfen paramagnetische Sonden, funktionelle Lösung bereitzustellen. Beachten Sie, dass exogene EPR-Sonden einen Vorteil gegenüber exogenen haben Sonden NMR wegen der viel höheren inneren Empfindlichkeit des EPR und Fehlen von endogenen Hintergrund EPR Signalen. Die jüngste Entwicklung von einer Doppelfunktion pH und Redox Nitroxyl probe11 und multifunktionale Trityl Sonde12 bietet unübertroffene Möglichkeiten für in Vivo gleichzeitige Messungen von mehreren TME-Parameter und ihre Korrelation Analysen unabhängiger Sonde Verteilung und Uhrzeit der Messung. Unseres Wissens gibt es keine anderen Methoden zur Verfügung, um gleichzeitig in Vivo physiologisch wichtigen chemischen TME Parameter in lebendigen Subjekten, z. B. pO2pHe, Pi, Redox und GSH bewerten.
Sonden für In Vivo Funktionsmessungen:
Abbildung 1 zeigt die chemische Strukturen der paramagnetischen Sonden TME Zugriff auf Parameter, darunter Partikel- und lösliche Sonden verwendet. Hohe funktionale Empfindlichkeit, Stabilität in lebendem Gewebe und minimale Toxizität sind ein paar Vorteile, die partikuläre Sonden bevorzugt über lösliche Sonden für in Vivo EPR Pulsoxymetrie machen. Zum Beispiel haben partikuläre Sonden Retentionszeiten auf dem Gelände des Gewebes Implantat im Vergleich zu löslichen Sonden für longitudinale Messung des Gewebes pO2 über mehrere Wochen erhöht. Auf der anderen Seite lösliche Sonden übertreffen partikuläre Sonden durch die Bereitstellung von räumlichen gelöst Messungen mittels EPR-basierte bildgebende Verfahren sowie die begleitende Analysen von mehreren Funktionalitäten (pO2, pH, Pi, Redox, und GSH).
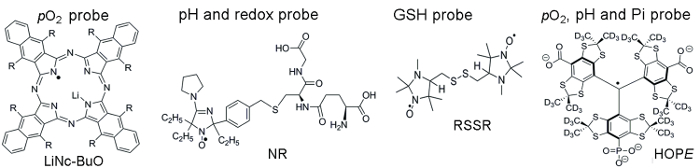
Abbildung 1. Chemische Strukturen der paramagnetischen Sonden, die TME Bewertung Assay zusammenbauen. Dazu gehören die Partikel pO2 Sonde, LiNc-Auftrieb (R = – O (CH2)3CH3), und lösliche Sonden: Doppelfunktion pH und Redox Sonde, NR; GSH-Sensitive Sonde, RSSR; und multifunktionale pO2, pH und Pi-Sonde von der extrazellulären Mikroumgebung, die Hoffnung Sonde. Die Synthese von diese Sonden wurde in die angegebenen Referenzen 11,12beschrieben. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
Die vorgestellten Methoden können für nicht-invasive in Vivo Beurteilung der kritischen Parameter der chemischen TME pO2, pH-Wert, Redox-Status und Konzentrationen von interstitiellen Pi und intrazellulären GSH. Magnet-Resonanz-Techniken, wie MRI und Low-Bereich EPR, sind die Methoden der Wahl für die nicht-invasive in Vivo Profilierung dieser TME-Parameter. MRI anatomische Strukturen visualisiert aber funktionelle Sensitivität fehlen. Im Gegensatz zu MRI bieten EPR-Techniken fu…
Declarações
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde teilweise unterstützt von NIH CA194013, CA192064 und U54GM104942 gewährt. Die WVCTSI ist für Start-up zum VVK, AB und TDE anerkannt. Die Autoren danken Dr. M. Gencheva und K. Steinberger für die Hilfe mit den anschaulichen Experimenten. Der Inhalt ist ausschließlich in der Verantwortung der Autoren und nicht unbedingt die offizielle Meinung des NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Referências
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

