Ontleden multi signalering eiwitcomplexen door Bimolecular complementatie affiniteit zuivering (BiCAP)
Summary
Dit manuscript beschrijft het protocol voor Bimolecular complementatie affiniteit zuivering (BiCAP). Deze nieuwe methode vergemakkelijkt de specifieke isolatie en downstream proteomic karakterisering van elk twee interacterende eiwitten, terwijl met uitzondering van VN-complexvorm individuele eiwitten evenals complexen gevormd met concurrerende bindende partners.
Abstract
De vergadering van eiwitcomplexen is een centraal mechanisme dat ten grondslag ligt aan de regulering van vele cel signalering trajecten. Een belangrijk aandachtspunt van het biomedisch onderzoek is hoe deze dynamische eiwitcomplexen handelen om signalen van meerdere bronnen om een specifieke biologische reactie te integreren, en hoe dit wordt gedereguleerd in veel instellingen van ziekte ontcijferen. Ondanks het belang van dit belangrijke biochemische mechanisme is er een gebrek aan experimentele technieken die de specifieke en gevoelige deconvolutie van deze multi moleculaire signalering complexen kan vergemakkelijken.
Hier is deze tekortkoming aangepakt door de combinatie van een kwantitatieve analyse van eiwit, complementeren met een conformatie-specifieke nanobody, die wij hebben genoemd Bimolecular complementatie affiniteit zuivering (BiCAP). Deze nieuwe techniek faciliteert de specifieke isolatie en downstream proteomic karakterisering van elk paar van interacterende eiwitten, met uitsluiting van het un-complexvorm individuele eiwitten en complexen gevormd met concurrerende bindende partners.
De BiCAP techniek is aanpasbaar aan een breed scala van downstream experimentele tests en de hoge mate van specificiteit die worden geboden door deze techniek laat meer genuanceerde onderzoek naar de mechanica van eiwit complex vergadering dan momenteel mogelijk is met behulp van standaard affiniteit zuivering technieken.
Introduction
Eiwit complex vergadering is een belangrijke proces bij het handhaven van de spatio specificiteit van vele seingeving trajecten1,2. Terwijl de kritische aard van deze regelgevende rol wordt algemeen erkend, is er een gebrek aan experimentele technieken beschikbaar om onderzoekt deze complexen. Meeste interactomics studies richten op interacties met afzonderlijke proteïnen, of de sequentiële verrijking van individuele complexe componenten. Hier presenteren we een techniek voor de isolatie van een specifieke proteïne-dimeer terwijl met uitzondering van de individuele wordt van het onderdeel eiwitten evenals complexen gevormd met concurrerende partners3bindend. We hebben deze techniek genaamd Bimolecular complementatie affiniteit zuivering (BiCAP), als het is een combinatie van een eerder bestaande eiwit fragment complementatie assay, Bimolecular fluorescentie complementatie (BiFC), met het nieuwe gebruik van een de recombinante nanobody conformatie-specifieke richting GFP en derivaten daarvan (Zie tabel of Materials).
Een typisch eiwit-fragment complementatie assay is afhankelijk van de expressie van “aas” en “prooi” eiwitten gesmolten als u wilt splitsen fragmenten van verslaggevers zoals luciferase4, β-galactosidase5of groen fluorescente proteïne (GFP)6 ( Figuur 1A). Door de interactie van de aas en prooi eiwitten, worden de split verslaggever domeinen aangemoedigd om refold in een functionele structuur, waardoor de interactie van het aas en prooi eiwitten worden gevisualiseerd of gekwantificeerd. BiCAP werd aangepast van een versie van deze techniek die gebruik van fragmenten van het GFP-variant Venus. Fluorescent proteïne complementatie testen zijn een populaire methode voor het visualiseren van eiwit-eiwitinteractie in een levende cel, maar tot nu toe beperkt gebleven tot en met dit één functie7. BiCAP vertegenwoordigt een belangrijke stap vooruit in dit opzicht, aangezien deze techniek niet alleen voor visualisatie, maar ook de isolatie en ondervraging van de resulterende eiwit-eiwit interactie staat.
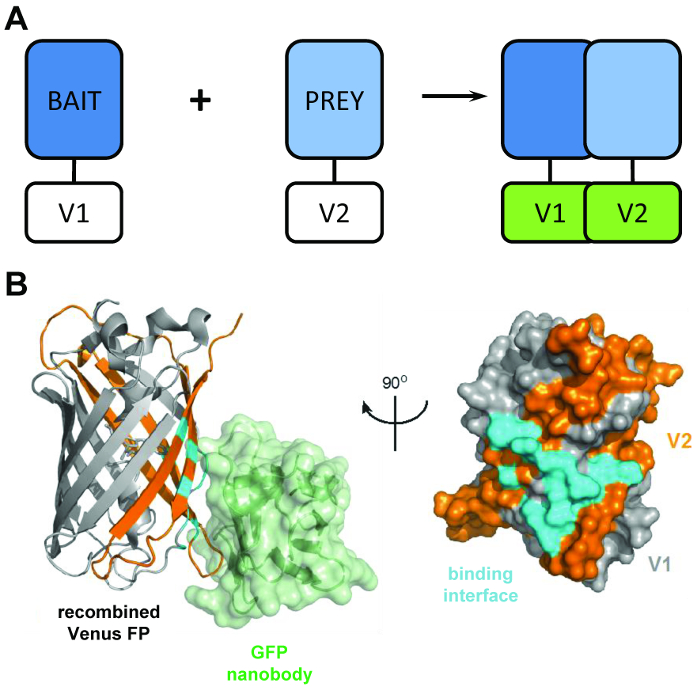
Figuur 1: de structurele opdrachtgever achter de techniek BiCAP. (A) een schema waarin de opdrachtgever achter bimolecular fluorescentie complementatie weergegeven: de ‘aas’ en ‘prooi’ eiwitten gelabeld met de N-terminale V1 of V2 C-terminal fragmenten van de full-length Venus proteïne. (B) structurele analyse van de interactie interface (cyaan) tussen de GFP nanobody (groen) en gerecombineerde Venus, waarop de plaats van de (grijze) V1 en V2 (oranje) fragmenten (VOB toetreding 3OGO). Dit cijfer is heruitgegeven fromCroucher et al.3 herdrukt met toestemming van AAAS. Klik hier voor een grotere versie van dit cijfer.
De BiCAP techniek maakt gebruik van twee niet-belichting fluorescerende fragmenten van Venus (met de naam V1 en V2) die associëren met een lage graad van verwantschap, tenzij een interactie tussen de partners van hun fusie plaatsvindt. In dit geval refold de twee gesplitste domeinen naar de functionele structuur van de β-vat van de fluorophore (figuur 1B)6. De belangrijkste vernieuwing van BiCAP komt uit de invoering van de recombinante GFP-nanobody, die een driedimensionale epitoop herkend op de β-vat van GFP (en varianten zoals Venus) die alleen aanwezig op het fluorophore correct gerecombineerde en gevouwen ( is Figuur 1B)8. De nanobody van GFP bindt is cruciaal, niet tot een van de afzonderlijke fragmenten van Venus. Dit vergemakkelijkt de isolatie van de eiwit-Dimeren pas nadat de twee eiwitten een complex van hun eigen houtje, wat leidt tot meer representatieve resultaten dan die verworven van methoden waarmee het gebruik van chemisch geïnduceerde, gedwongen interacties9hebben gevormd.
BiCAP is een krachtige techniek die zich specifiek op meerdere eiwitcomplexen, die potentieel kunnen worden gecombineerd met een aantal downstream toepassingen richt ter verbetering van de granulariteit van ons begrip van de rol van deze complexen in signaaltransductie . Het omvat ook de belangrijke functie van het toestaan van visualisatie van eiwit interacties in situ. Tot op heden als een effectieve methode van het analyseren van de interactome van receptor tyrosine kinase (RTK) Dimeren3BiCAP is aangetoond, maar het aanpassingsvermogen van deze methode betekent dat het kan worden aangenomen in bijna elke context van de interactie eiwit.
Protocol
Representative Results
Discussion
BiCAP is een krachtige methode voor het isoleren van de specifieke proteïne Dimeren terwijl met uitzondering van de afzonderlijke bestanddelen en hun concurrerende bindende partners3. BiCAP is gebaseerd op de aanpassing van een fluorescentie eiwit complementatie assay genaamd BiFC6. Bestaande methoden, met inbegrip van BiFC en nabijheid afbinding testen, uitgebreid om te visualiseren en te kwantificeren eiwitinteractie in levende cellen7zijn gebruik…
Declarações
The authors have nothing to disclose.
Acknowledgements
D.R.C is een kanker instituut NSW Fellow en D.N.S was eerder een kanker instituut NSW kerel. De onderzoeksresultaten gepresenteerd in dit manuscript werden gefinancierd door de kanker instituut NSW (13/FRL/1-02 en 09/CDF/2-39), NHMRC (Project Grant GNT1052963), Science Foundation Ireland (11/SIRG/B2157), NSW Office of Science en medisch onderzoek, gastgezin Fellowship en Mostyn Family Foundation. J.F.H. en R.S. waren ontvangers van een Australische Postgraduaat Award.
Materials
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid – Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) – 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
Referências
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).

