ויבתר חלבון רב מתחמי איתות על ידי טיהור זיקה קומפלמנטציה ריאקציה דו-מולקולרית (BiCAP)
Summary
כתב יד זה מתאר את הפרוטוקול לטיהור ריאקציה דו-מולקולרית קומפלמנטציה זיקה (BiCAP). שיטה חדשנית זו מקלה על ספציפיות בידוד ואפיון פרוטיאומיה מבנית במורד הזרם של כל שני חלבונים אינטראקציה, בעוד למעט האו ם-ומורכבת חלבונים בודדים, כמו גם מתחמי הקים עם שותפים איגוד מתחרות.
Abstract
ההרכבה של מתחמי חלבון הוא מנגנון מרכזי שבבסיס ברגולציה של תאים רבים מסלולי איתות. והמוקד העיקרי של המחקר הביו-רפואי הוא בפענוח כיצד אלה מתחמי חלבון דינמי לפעול כדי לשלב את אותות ממקורות מרובים כדי לכוון תגובה ביולוגית ספציפית, איך זה הופך deregulated בהגדרות למחלות רבות. למרות חשיבותו של מנגנון הביוכימי מפתח זה, יש מחסור של טכניקות ניסיוני יכול להקל deconvolution בדיקה רגישה וספציפית של אלה מתחמי איתות רב מולקולרית.
כאן זה חסרון הוא ממוען באמצעות שילוב שיטת קומפלמנטציה עם nanobody קונפורמציה ספציפיים, אשר אנו יש להגדירו קומפלמנטציה ריאקציה דו-מולקולרית זיקה טיהור (BiCAP). טכניקה חדשנית זו מקלה על ספציפיות בידוד ואפיון פרוטיאומיה מבנית במורד הזרם של כל זוג חלבונים אינטראקציה, עד כדי של האו ם-ומורכבת חלבונים בודדים, מתחמי הקים עם שותפים איגוד מתחרות.
הטכניקה BiCAP לסגלה מגוון רחב של מבחני ניסיוני במורד הזרם, רמה גבוהה של ירידה לפרטים המוענקת על ידי טכניקה זו מאפשרת יותר הניואנסים חקירות המכניקה של חלבון הרכבה מורכב ממה שאפשרי כיום באמצעות טכניקות טיהור זיקה סטנדרטי.
Introduction
חלבונים מורכבים הרכבה הוא תהליך מפתח בשמירה על יחודיות ייתכן של רבים האיתות מסלולים1,2. מהות תפקיד רגולטורי זה קריטי ידועה ומוכרת, יש חוסר לרשות לבחון אלו מתחמי ניסיוני טכניקות. רוב המחקרים interactomics מתמקדים אינטראקציות עם חלבונים בודדים, או את העשרת רציפים של רכיבים מורכבים בודדים. כאן אנו מציגים טכניקה עבור בידודו של דיימר חלבון ספציפי בזמן למעט את moieties בודדים של רכיב חלבונים, כמו גם מתחמי הקים עם מתחרים האיגוד שותפים3. . קראנו טכניקה זו קומפלמנטציה ריאקציה דו-מולקולרית זיקה טיהור (BiCAP), כפי שהוא הוא שילוב של קיימים בעבר חלבון פרגמנט קומפלמנטציה assay, קרינה פלואורסצנטית ריאקציה דו-מולקולרית קומפלמנטציה (BiFC), עם השימוש הרומן nanobody רקומביננטי קונפורמציה ספציפי כלפי GFP ונגזרותיו (ראה טבלה של חומרים).
Assay קומפלמנטציה חלבון-קטע טיפוסי מסתמך על הביטוי של חלבונים “בית” ו- “טרף” התמזגו לפצל שברי כתבים כמו לוציפראז4, β-galactosidase5או חלבון פלואורסצנטי ירוק (GFP)6 ( איור 1A). דרך האינטראקציה של החלבונים פיתיון וטרף, התחומים כתב פיצול מומלץ לקפל לתוך מבנה פונקציונאלי, המאפשר את האינטראקציה של הפיתיון, טרף חלבונים דמיינו או לכמת. BiCAP הותאם בגרסה של טכניקה זו כי עשה שימוש שברי variant GFP ונוס. חלבון פלואורסצנטי קומפלמנטציה מבחני שיטה פופולארית להמחשת אינטראקציות חלבון בתא בשידור חי, אבל עד עכשיו היה מוגבל ל זו פונקציה אחת7. BiCAP מייצג התקדמות משמעותית בהקשר זה, כמו טכניקה זו מאפשרת לא רק עבור ויזואליזציה, אבל גם הבידוד והחקירות של אינטראקציה חלבון שנוצר.
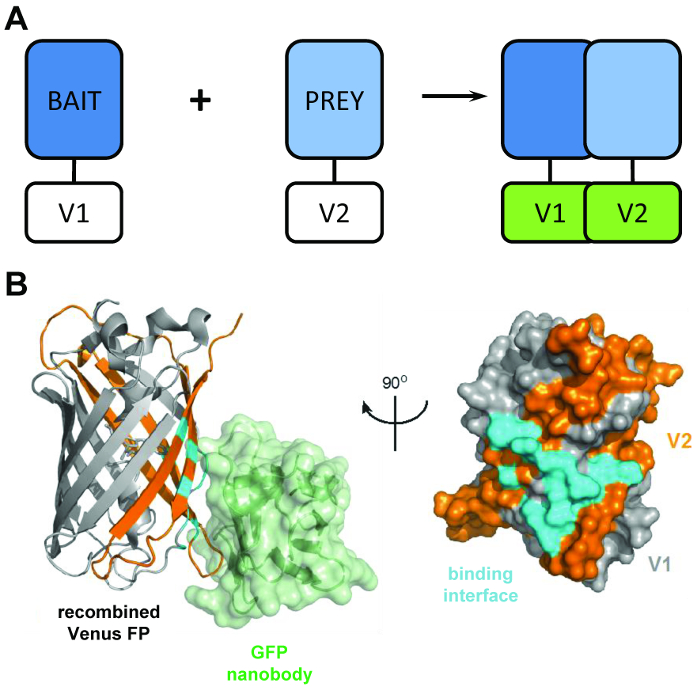
איור 1: המנהל מבניים מאחורי הטכניקה BiCAP. (א) סכימטי בהתוויית המנהלת מאחורי מראה קומפלמנטציה פלורסצנטיות ריאקציה דו-מולקולרית החלבונים “פיתיון” וגם של “טרף” מתויג עם N-מסוף V1 או C-מסוף V2 קטעים של החלבון ונוס באורך מלא. (B) ניתוח מבנה של הממשק אינטראקציה (ציאן) בין ה-GFP nanobody (ירוק) משולבות מחדש של ונוס, מציג את המיקום של V1 (אפור), שברי V2 (כתום) (PDB הצטרפותן 3OGO). איור זה הוא פרסום מחדש fromCroucher et al.3 Reprinted באישור AAAS. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
BiCAP טכניקת עושה שימוש שני קטעים שאינם-פלורסנט של ונוס (בשם V1 ו- V2) אשר מקשרים עם רמה נמוכה של זיקה אלא אם מתרחשת אינטראקציה בין בני הזוג שלהם פיוז’ן. במקרה זה, התחומים פיצול שני לקפל לתוך המבנה β-חבית התפקודי של fluorophore (איור 1B)6. החידוש מפתח של BiCAP נובע המבוא של nanobody GFP רקומביננטי, אשר מזהה epitope תלת מימדי על β-החבית של GFP (וגם משתנים כגון ונוס) אשר קיים רק fluorophore משולבות מחדש של כראוי, מקופל ( איור 1B)8. ויותר חשוב, nanobody ה-GFP אינו מאגד גם של השברים ונוס בודדים. זה מקל על בידודו של חלבון הדימרים רק לאחר שני חלבונים נוצר קומפלקס מרצונם, מובילים לתוצאות נציג יותר מאשר אלה שנרכשה מן השיטות שעושים שימוש של אינטראקציות בהשפעת כימיקלים, כפו9.
BiCAP היא טכניקה חזקה במיוחד המתמקד חלבון מרובת קומפלקסים, אשר באופן פוטנציאלי יכול להיות משולב עם מספר יישומים במורד הזרם כדי לשפר את צפיפות הרשת של הבנתנו תפקיד שאלה מתחמי לשחק אותות . זה גם כוללת את התכונה החשובה של המאפשר ויזואליזציה של אינטראקציות חלבון בתוך באתרו. עד היום הוכח BiCAP כאל שיטה יעילה של מנתח את interactome של קולטן טירוזין קינאז (RTK) הדימרים3, אבל יכולת ההתאמה של שיטה זו אומר כי זה יכול להיות מאומץ כמעט בכל הקשר אינטראקציית חלבון.
Protocol
Representative Results
Discussion
BiCAP היא שיטה חזקה עבור בידוד חלבון ספציפי הדימרים שיתופם של רכיבים בודדים ו שלהם שותפים מתחרות מחייב3. BiCAP מבוסס על עיבוד של קרינה פלואורסצנטית assay קומפלמנטציה חלבון הנקרא BiFC6. שיטות קיימות, כולל מבחני מצדו BiFC וקירבה, נעשה שימוש נרחב כדי להמחיש ולכמת אינטראקציות חל?…
Declarações
The authors have nothing to disclose.
Acknowledgements
D.R.C הוא בחור NSW מכון הסרטן, D.N.S היה בעבר בחור NSW מכון הסרטן. ממצאי המחקר הציג כתב יד זה במימון NSW מכון הסרטן (13/FRL/1-02 ו- 09/CDF/2-39), NHMRC (פרוייקט גרנט GNT1052963), קרן מדעי לאירלנד (11/SIRG/B2157), NSW Office של מדע ומחקר רפואי, חוות המשפחה אחווה, קרן משפחת המרגיעה. J.F.H. R.S. היו מקבלי פרס לתארים מתקדמים אוסטרלי.
Materials
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid – Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) – 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
Referências
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).

