Combinant la microfluidique et microrhéologie pour déterminer les propriétés rhéologiques de la matière molle au cours de Transitions de phases répétées
Summary
Nous démontrons la fabrication et l’utilisation d’un dispositif microfluidique qui permet le suivi des mesures microrhéologie pour étudier les effets rhéologiques des transitions de phases répétées sur la matière molle de particules multiples.
Abstract
La microstructure de la matière molle directement effets macroscopiques propriétés rhéologiques et peut être modifiée par des facteurs incluant colloïdal réarrangement lors des changements de la phase précédente et appliqué au cisaillement. Pour déterminer l’ampleur de ces changements, nous avons développé un dispositif microfluidique que permet répété des transitions de phase induites par l’échange de la caractérisation de fluides et microrheological environnante tout en limitant au cisaillement sur l’échantillon. Cette technique est µ2rhéologie, la combinaison de la microfluidique et microrhéologie. Le dispositif microfluidique est une conception de la bicouche avec des flux d’entrée symétrique entrant dans une chambre à échantillon qui intercepte l’échantillon de gel en place au cours de l’échange de fluides. Succion peut être appliquée très loin de la chambre de mesure extraire des fluides dans le compartiment de mesure. Propriétés rhéologiques des matériaux sont caractérisées à l’aide de plusieurs particules, suivi de microrhéologie (MPT). MPT, sonde fluorescente particules sont incorporées dans le matériau et le mouvement brownien des sondes est enregistré à l’aide de la microscopie vidéo. Le mouvement des particules est suivi et le déplacement quadratique moyenne (MSD) est calculé. Le TMS est liée à des propriétés rhéologiques macroscopiques, en utilisant la Relation de Stokes-Einstein généralisée. La phase de la matière est identifié par comparaison à l’exposant critique de relaxation, déterminée à l’aide de superposition de temps-cure. Les mesures d’un gel colloïdal fibreux illustrent l’utilité de la technique. Ce gel a une structure délicate qui peut être irréversiblement changée lorsque l’inclinaison est appliquée. données de rhéologie µ2montrent que le matériau s’équilibre à plusieurs reprises pour les mêmes propriétés rhéologiques après chaque phase de la transition, indiquant que les transitions de phase ne jouent pas un rôle dans modifications microstructurales. Pour déterminer le rôle de cisaillement, les échantillons peuvent être cisaillés avant injection dans notre dispositif microfluidique. rhéologie de2µ est une technique largement applicable pour la caractérisation de la matière molle permettant la détermination des caractéristiques rhéologiques des microstructures délicates dans un seul échantillon au cours de transitions de phase en réponse aux changements répétés dans le conditions environnementales existantes.
Introduction
Transitions de phase dans la matière molle peuvent changer la structure de l’échafaudage, qui a des implications dans la stabilité de transformation et finale de la matière1,2,3. La caractérisation de matériaux mous au cours de transitions de phase dynamique fournit des informations essentielles sur la relation entre l’évolution structurale et structure d’équilibre et des propriétés rhéologiques. Par exemple, de nombreux produits de soins à domicile nécessitent un changement de phase au cours de l’utilisation par les consommateurs. Aussi, lors de sa fabrication, étapes de traitement, y compris la dilution et le mixage, peut donner au cisaillement qui affectent les propriétés rhéologiques et microstructure finale du produit. Comprendre les propriétés rhéologiques tout au long d’un changement de phase permet d’utiliser le produit comme prévu. En outre, si les forces modifient la rhéologie départ du matériau lors de sa fabrication, transitions de phase peuvent donner des résultats inattendus et indésirables, changer la fonction et l’efficacité. Au point critique de gélation, défini comme le point où le matériau passe d’une solution de colloïdes associés ou de polymères à un réseau s’étendant sur échantillon de gel, les propriétés du matériau changent radicalement avec de légères modifications à l’association. Toute modification apportée à la structure au point critique de gel peut influer sur le produit final4. Pendant ces transitions dynamiques, matériaux souples ont de faibles propriétés mécaniques et des mesures qui utilisent des techniques expérimentales classiques peuvent être dans la mesure bruit limite5,6,7. Pour tenir compte de cette, techniques telles que microrhéologie, qui est sensible dans la gamme de modules d’élasticité faible (10-3 – 4 Pa), sont utilisés pour caractériser le gel naissant faible au cours de l’évolution dynamique. Certains matériaux sont sensibles à l’évolution de la microstructure en raison des forces extérieures, qui présente un défi lors de la caractérisation, que tout transfert de matériel ou de fluide peut influer sur la structure et, en fin de compte, les propriétés du matériau finales. Pour éviter d’altérer la microstructure des matériaux, nous avons développé un dispositif microfluidique qui peut échanger le fluide environnement autour d’un échantillon tout en minimisant le cisaillement. En échangeant l’environnement fluide, changements dans les propriétés rhéologiques et la microstructure sont mesurées au cours de transitions de phase avec des contributions minimales de cisaillement. Le dispositif est combiné avec plusieurs particules microrhéologie (MPT) de suivi dans une technique appelée µ2rhéologie. Cette technique est utilisée pour quantifier les propriétés matérielles lors des changements de phase consécutive d’un gel en réponse à un moteur externe. La technique sera illustrée à l’aide d’un gel colloïdal fibreux, l’huile de ricin hydrogénée (HCO)9,10,11.
Gel échafaudages peuvent subir des changements dans l’association et de dissociation en raison de leur échantillon environnement12,13,14,15. La force motrice de gélification et de dégradation sont matériel spécifique et doit être adaptée pour chaque matériau d’intérêt. rhéologie de2µ peut servir à caractériser les systèmes de gel qui répondent à des stimuli externes, y compris les réseaux colloïdaux et polymères. Modification de pH, pression osmotique ou concentration en sel est des exemples de moteurs qui peuvent induire des changements dans la microstructure du matériau. Par exemple, HCO subit des transitions de phase contrôlée en créant un gradient de pression osmotique. Lorsqu’un échantillon de gel concentré HCO (4 % en poids HCO) est immergé dans l’eau, les forces d’attraction entre les particules colloïdales s’affaiblir, entraînant la dégradation. Par ailleurs, lorsqu’une solution diluée d’HCO (0,125 % de poids HCO) est en contact avec un matériau hydrophile (dénommé le gélifiant et composé principalement de glycérine et agent tensio-actif), la séduisante forces retour, causant la gélification. Ce système de gel servira à montrer le fonctionnement de l’appareil comme un outil pour mesurer les transitions de phases consécutives sur un seul échantillon9,10. Pour caractériser ces échafaudages de gel au cours des transitions dynamiques et la structure délicate gel naissante à la transition de la phase critique, les MPT nous permet de caractériser ces matériaux avec une haute résolution temporelle.
Microrhéologie est utilisée pour déterminer les propriétés du gel et structure, en particulier pour la transition critique, d’un tableau des matériaux souples, y compris les gels colloïdaux et polymères5,6,9,16. MPT est une technique de microrheological passive qui utilise la microscopie vidéo pour enregistrer le mouvement brownien des particules sonde fluorescente intégré au sein d’un échantillon. Les positions des particules dans les vidéos sont précisément déterminées à 1/10ème d’un pixel à l’aide classique suivi algorithmes17,18. L’ensemble en moyenne quadratique moyenne cylindrée (MSD, (Δr2(t))) est calculé à partir de ces trajectoires de particules. Le TMS est lié aux propriétés des matériaux, tels que la conformité de fluage, en utilisant la Relation de Stokes-Einstein généralisée17,19,20,21,22, 23. L’état de la matière est déterminée en calculant la pente logarithmique de la courbe MSD en fonction du temps de latence, α,
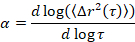
où t est le temps de latence et en le comparant à l’exposant critique de relaxation, n. n est déterminé à l’aide de superposition de temps-cure, une technique bien documentée qui a été modifiée pour analyser les données de la MPT de Larsen et Furst6. En comparaison de n α l’état de la matière est déterminé quantitativement. Lorsque α > n le matériau est un sol et quand α < n le matériau est un gel. Les travaux précédents a caractérisé le système HCO utilisant microrhéologie pour déterminer l’ exposant critique de relaxation9. En utilisant cette information, nous déterminons précisément lorsque le matériel effectue une transition d’un gel d’un sol pendant une expérience. En outre, le paramètre non gaussiennes, αNG, peut être calculé pour déterminer le degré d’hétérogénéité structurelle d’un système,
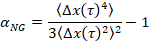
Δx(t) étant le mouvement de la particule unidimensionnel dans la direction x . À l’aide de MPT, nous pouvons caractériser une transition de phase unique, mais de caractériser les matériaux avec MPT dans un dispositif microfluidique, nous sommes en mesure de manipuler le milieu liquide environnant et de recueillir des données de plusieurs transitions de phase sur un échantillon de gel unique.
Ce dispositif microfluidique est conçu pour étudier les transitions critiques d’un échantillon de gel unique qui subit des changements de phase en réponse aux changements dans le milieu liquide environnant. Le dispositif échange liquide entourant l’échantillon lorsqu’il est dans l’état de gel ou de sol en verrouillant l’échantillon permettant d’induire une transition de phase tout en minimisant le cisaillement. Un bassin de solvant se situe directement au-dessus de la chambre de mesure, qui sont reliées par six canaux d’entrée symétriquement espacés. Cette symétrie permet l’échange de liquide dans le bassin de solvant pour le compartiment de mesure tout en créant une pression égale autour de l’échantillon, verrouiller en place. Il y a eu plusieurs études qui utilisent cette technique pour une seule particule et le piégeage de l’ADN, mais ce travail évolue au volume de molécules simples vers des exemples qui sont environ 10 µL24,25,26. Cette conception unique permet également la caractérisation microrheological en temps réel au cours de transitions de phase.
rhéologie de2µ est une technique robuste qui s’applique à de nombreux systèmes de matière molle. La technique décrite dans le présent document a été conçue pour les gels colloïdaux, mais il peut être facilement adaptée à d’autres matériaux tels que le polymère ou solutions micellaires. Avec cette technique, nous déterminons non seulement comment les transitions de phase affectent les propriétés matérielles de l’équilibre, mais aussi comment les différentes étapes peuvent avoir des effets sur l’évolution rhéologique du matériau et la structure de l’échafaudage final durables et Propriétés.
Protocol
Representative Results
Discussion
Le dispositif microfluidique diploblastique (Figure 1) peut être facilement fait par suivant bien documenté microfluidique fabrication techniques29. Supports de verre sont ajoutées à la partie inférieure de l’appareil pour diminuer les effets vibratoires sur le mouvement de la sonde. La lame de verre est très mince (0,10 mm) afin d’adapter le travail à distance de l’objectif de microscope. Cela rend l’appareil sensible aux petites vibrations dans le bâ…
Declarações
The authors have nothing to disclose.
Acknowledgements
Ce travail a été financé par Procter & Gamble Co. et l’américain chimique société Petroleum Research Fund (54462-DNI7). Accusé de réception est faite pour les donateurs de l’American Chemical Society pétrole fonds de recherche du prise en charge partielle de cette recherche. Les auteurs tiennent à remercier le Dr Marco Caggioni discussions utiles.
Materials
| 150 x 15 mm Petri Dish | Corning, Inc. | 351058 | |
| 75 x 50 x 0.15 mm glass slide | Fisher Scientific | Custom | |
| 75 x 50 x 1.0 mm glass slide | Fisher Scientific | 12-550-C | |
| 75 x 25 x 1.0 mm glass Slide | Fisher Scientific | 12-550-A3 | |
| 22 x 22 Glass cover slips | Fisher Scientific | 12-542-B | |
| Acetone, 99.5% | VWR Analytical | 67-64-1 | |
| Low intensity UV source | UVP | UVL-56 | |
| Chloroform, 99.9% | Fisher Chemical | C298-500 | |
| Cotton Swabs | Q-tips | 83289205 | |
| Ethanol, 90% | Fisher Chemical | A962-4 | |
| Fluoresbrite® YG Carboxylate Microspheres 0.50µm | Polysciences, Inc. | 15700-10 | |
| High-Intensity UV Lamp | Spectroline Corp. | SB-100P | |
| Hot plate | Corning, Inc. | PC-420 | |
| Hydrochloric Acid, 6N | Ricca Chemical Company | 3750-32 | |
| Methyltriethyoxysilane, 98% | Acros Organics | 174622500 | |
| Microcentrifuge | Eppendorf | 5424 | |
| Plasma cleaner | Harrick Plasma, Inc. | PDC-32G | |
| Polydimethylsiloxane (PDMS) | Robert McKwown Company | 2065622 | |
| Sonicator | Branson, Emerson Electric | 1800 | |
| Steel connectors, ID 0.023 inch | New England Small Tube Corp. | Custom | |
| Tetraethoxysilane, 98% | Alfa Aesar | A14965 | |
| Thiol-ene Resin (UV curable) | Norland Products, Inc. | NOA81 | |
| Transparency | Staples Inc. | 21828 | |
| Tygon tubing, ID 1/32 inch | McMaster-Carr | E-3603 | |
| Vacuum oven | Fisher Scientific | 282A | |
| Biopsy punch 8 mm | World Precision Instruments | 504535 | |
| Bioposy punch 0.5 mm | World Precision Instruments | 504528 | |
| Syringe, 30 mL | BD | 309659 | |
| Syringe, 3 mL | BD | 309651 | |
| Needle, 18 gauge | BD | 305195 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 22-36-320-4 | |
| High-speed Camera | Vision Research | Miro M120 | |
| Microscope | Carl Zeiss AG | Zeiss Observer, Z1 | |
| Syringe pump | New Era Pump Systems | NE-300 | |
| Hydrogenated castor oil | Procter & Gamble | N/A | |
| Afício MP 6002 Printer | Ricoh Company, Ltd. | 415877 |
Referências
- Mitchell, P. Microfluidics-downsizing large-scale biology. Nat. Biotech. 19, 717-721 (2001).
- Haber, C. Microfluidics in commercial applications; an industry perspective. Lab Chip. 6, 1118-1121 (2006).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Huang, X., Raghavan, S. R., Terech, P., Weiss, R. G. Distinct kinetic pathways generate organogel networks with contrasting fractality and thixotropic properties. J. Am. Chem. Soc. 128, 15341-15352 (2006).
- Larsen, T. H., Schultz, K. M., Furst, E. M. Hydrogel microrheology near the liquid-solid transition. Korea-Aust. Rheol. J. 20, 165-173 (2008).
- Larsen, T. H., Furst, E. M. Microrheology of the liquid-solid transition during gelation. Phys. Rev. Lett. 100, 146001 (2008).
- Schultz, K. M., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid rheological screening to identify conditions of biomaterial hydrogelation. Soft Matter. 5, 740-742 (2009).
- Switzer, L. H., Klingenberg, D. J. Flocculation in simulations of sheared fiber suspensions. Int. J. Multiph. Flow. 30, 67-87 (2004).
- Wehrman, M. D., Lindberg, S., Schultz, K. M. Quantifying the dynamic transition of hydrogenated castor oil gels measured via multiple particle tracking microrheology. Soft Matter. 12, 6463-6472 (2016).
- Wehrman, M. D., Milstrey, M. J., Lindberg, S., Schultz, K. M. Using µ2rheology to quantify rheological properties during repeated reversible phase transitions of soft matter. Lab Chip. 17, 2085-2094 (2017).
- Wehrman, M. D., Lindberg, S. E., Schultz, K. M. Impact of shear on the structure and rheological properties of a hydrogenated castor oil colloidal gel during dynamic phase transitions. J. Rheol. , (2018).
- Loh, X. J. Dual-responsive “reversible micelles”. J. Appl. Polym. Sci. 127, 992-1000 (2013).
- Kern, F., Zana, R., Candau, S. J. Rheological properties of semidilute and concentrated aqueous solutions of cetyltrimethylammonium chloride in the presence of sodium salicylate and sodium chloride. Langmuir. 7, 1344-1351 (1991).
- Trappe, V., Prasad, V., Cipelletti, L., Segre, P. N., Weitz, D. A. Jamming phase diagram for attractive particles. Nature. 411, 772-775 (2001).
- Philipse, A. P., Wierenga, A. M. On the density and structure formation in gels and clusters of colloidal rods and fibers. Langmuir. 14, 49-54 (1998).
- Schultz, K. M., Bayles, A. V., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid, high resolution screening of biomaterial hydrogelators by mu2rheology. Biomacromolecules. 12, 4178-4182 (2011).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179, 298-310 (1996).
- Mason, T. G. Estimating the viscoelastic moduli of complex fluids using the generalized Stokes–Einstein equation. Rheol. Actac. 39, 371-378 (2000).
- Mason, T. G., Ganesan, K., van Zanten, J. H., Wirtz, D., Kuo, S. C. Particle tracking microrheology of complex fluids. Phys. Rev. Lett. 79, 3282-3285 (1997).
- Mason, T. G., Weitz, D. A. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74, 1250-1253 (1995).
- Squires, T. M., Mason, T. G. Fluid mechanics of microrheology. Annu. Rev. Fluid Mech. 42, 413-438 (2010).
- Gittes, F., Schnurr, B., Olmsted, P. D., MacKintosh, F. C., Schmidt, C. F. Microscopic viscoelasticity: shear moduli of soft materials determined from thermal fluctuations. Phys. Rev. Lett. 79, 3286-3289 (1997).
- Mai, D. J., Brockman, C., Schroeder, C. M. Microfluidic systems for single DNA dynamics. Soft Matter. 8 (41), 10560-10572 (2012).
- Tanyeri, M., Ranka, M., Sittipolkul, N., Schroeder, C. M. A microfluidic-based hydrodynamic trap: design and implementation. Lab Chip. 11, 1786-1794 (2011).
- Lee, J. S., Dylla-Spears, R., Teclemariam, N. P., Muller, S. J. Microfluidic four-roll mill for all flow types. Appl. Phys. Lett. 90, 074103 (2007).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179 (1), 298-310 (1996).
- Mason, T. G., Weitz, D. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74 (7), 1250 (1995).
- Schultz, K. M., Furst, E. M. High-throughput rheology in a microfluidic device. Lab on a chip. 11, 3802-3809 (2011).
- Abate, A. R., Lee, D., Do, T., Holtze, C., Weitz, D. A. Glass coating for PDMS microfluidic channels by sol-gel methods. Lab Chip. 8, 516-518 (2008).
- Happel, J., Brenner, H. . Low Reynolds Number Hydrodynamics: with special applications to particulate media. , (1965).

