마우스 기본 Oligodendrocytes의 신속 하 고 구체적인 Immunomagnetic 절연
Summary
우리는 생체 외에서 문화에 대 한 셀의 신속 하 고 특정 격리 수 있는 기본 마우스 oligodendrocytes의 immunomagnetic 절연을 설명 합니다.
Abstract
효율적이 고 강력한 격리와 기본 oligodendrocytes (OLs)의 문화는 oligodendroglia의 개발 뿐만 아니라 demyelinating 다 발성 경화 증과 같은 질병의 생물학의 생체 외에서 연구에 대 한 유용한 도구와 Pelizaeus-Merzbacher-같은 질병 (PMLD). 여기, 우리 간단 하 게 제시 하 고의 immunomagnetic 절연에 대 한 효율적인 선택 방법을 단계 3 O4+ preoligodendrocytes 세포에서 신생아 쥐 새끼. 미 숙 OL 80% 이상 설치류 뇌 백색 질 출생 후 제 7 일에의 (P7)이 격리 방법 뿐만 아니라 셀룰러 고수익을 보장 뿐만 아니라 이미 oligodendroglial 계보 최선을 다하고 OLs의 특정 격리 구성, 이후 감소 하는 이다 등 오염 셀과 다른 셀 쥐의 뇌에서 분리 가능성. 이 방법은 기술 이전, 보고의 이며 약 4 시간에 80% 이상 oligodendrocyte 준비 순수성을 제공 합니다.
Introduction
Oligodendrocytes (OLs) 중앙 신경 시스템 (CNS)1의 myelinating 세포 이다. 분리와 밀접 하 게 환경에서 기본 oligodendrocytes의 문화는 oligodendroglia의 개발 뿐만 아니라 demyelinating 질병 다 발성 경화 증2의 생물학의 생체 외에서 연구를 위한 유용한 도구 . 이는 효율적이 고 강력한 oligodendrocyte 고립과 문화 방법3필요합니다. 이 연구에서 우리는 신속 하 고 구체적인 수정된 격리 기술을 구현 하는 독특한 oligodendrocyte 세포 표면 마커 표현의 활용을 했다.
Oligodendrocyte 성숙의 4 단계로 발견 되었습니다, 그리고 각 각 발달 단계 (그림 1)에 대 한 독특한 세포 표면 마커 표현의 특징. 이러한 세포 표면 마커 특정 항 체4,5에 의해 인식 될 수 있다 그리고 특정 단계에서 OLs를 격리 하는 데 사용할 수 있습니다. 첫 번째 단계에서 oligodendrocyte 선구자 세포 (OPCs) 증식, 마이그레이션, 특히 혈소판 파생 된 성장 인자 수용 체 (PDGF-Rα)6, ganglioside A2B5, proteoglycan NG27,8 표현 하 능력을가지고 , polysialic 산 신경 세포 접착 분자9 및 지방 산 묶는 단백질 7 (FABP7)10. OPCs는 신경 선구자 세포11의 특성은 세포 체의 반대 극에서 나오는 몇 가지 짧은 프로세스와 바이 폴라 형태가 있다.
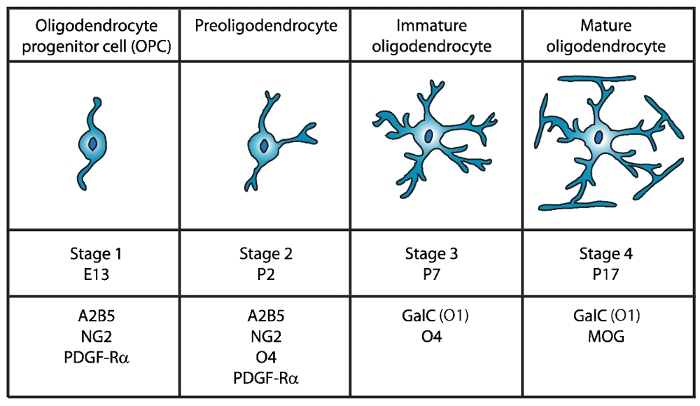
그림 1: 식 세포 표면 마커 마우스 oligodendrocyte 개발 중. OLs 세포 표면 마커 같은 A2B5, GalC (o 1), NG2, O4, 및 PDGF Rα 구체적으로 특정 항 체를 사용 하 여 특정 발달 단계에서 oligodendrocytes를 분리 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
두 번째 단계에서 OPCs preoligodendrocytes 하 고 세포 막에 표현 OPC 표식, 뿐만 아니라 O4 항 체12,13, 그리고14GPR17 단백질 의해 인식 하는 sulfatide (sulfated galactolipid) 미 성숙한 oligodendrocyte (OL) 단계까지 지속합니다. 이 단계에서 preoligodendrocytes는 다중 짧은 프로세스를 확장합니다. Preoligodendrocytes에 있는 주요 OL 무대 출생 후 하루 2 (P2)에 미 숙 OLs15의 작은 인구와 가진 쥐와 쥐의 대뇌 백 질.
세 번째 단계에서 미 숙 OLs O4 표현, 표현의 A2B5 및 NG2 마커를 잃고과 galactocerebroside C16을 표현 하기 시작 계속. 이 단계에서 OLs oligodendroglial 계보에 최선을 다하고 있습니다 그리고 긴 없는 분기17,18와 포스트 mitotic 세포가. 미 숙 OL P7에 설치류 백색 물질의 80% 이상 구성 하 고이 이번에 첫 번째 MBP+ 셀15,19,,2021관찰 된다. 따라서, P7에 OLs의 격리 수 셀룰러 고수익을 확인 하십시오.
OL 개발의 최종적이 고 4 단계에서 성숙 OLs 익스프레스 myelinating 단백질 (myelin 기본적인 단백질 (MBP), proteolipid 단백질 (PLP), 수 초 관련 된 당단백질 (MAG) 및 myelin oligodendrocyte 당단백질 (MOG)22,23 ,,2425,26. 이 단계에서 성숙 OLs 확장 막 투과성 축 삭 주위 sheaths 그 양식 컴팩트 하 고 미 수 있습니다. 이 쥐와 쥐 두뇌에 MBP+ 세포 P1419,,2021에서 점점 더 풍부한가 관찰과 일치 한다.
Fewster와 동료 196727oligodendrocyte의 첫 번째 분리 이후 설치류 CNS에서에서 OLs의 격리를 위해 여러 가지 방법은 immunopanning28,,2930를 포함 하 여 구현 되었습니다. 형광 활성화 된 세포 분류 (FACS) 세포 표면의 특정 항 원28,31, 차동 그라데이션 원심32,,3334,35 이용 및 다른 CNS 명과36,37의 차동 준수에 따라 떨고 방법. 그러나, 기존의 문화 방법 특히 순도, 수율 및38의 절차 수행 하는 데 필요한 시간 측면에서 한계를가지고. 따라서, oligodendrocytes에 대 한 보다 효율적인 절연 방법이 제시해 주셔야 합니다.
이 문서에서는 간단한 소개 및 immunomagnetic 격리에 대 한 효율적인 선택 방법을 단계 3 O4+ preoligodendrocytes 세포에서 신생아 쥐 새끼. 이 방법은 기술에 머리 외 에 의해 보고 수정 39 그리고 Dincman 외. 40 약 4 h에서 80% 이상이 oligodendrocyte 준비 순수성을 제공 합니다.
Protocol
Representative Results
Discussion
이 통신에 우리는 높게 순화 된 미 숙 마우스 oligodendrocyte 문화의 효율적인 격리 하는 방법을 제시. 이전에 게시 프로토콜39,40에 비해,이 방법은 GFAP 양성 이다의 훨씬 더 낮은 수준 및 기타 비 특징 셀의 매우 낮은 비율 높은 순도 나왔고. 그것은 이들은 미 숙 OLs oligodendroglial 계보 이미 최선을 다하고 지적 하는 것이 중요입니다. 따라서,이 세포 분화의 초…
Declarações
The authors have nothing to disclose.
Acknowledgements
이 연구는 국가 다 발성 경화 증 사회 (RG4591A1/2)와 건강의 국가 학회 (R03NS06740402)에서 교부 금에 의해 지원 되었다. 저자는 실험실 공간, 장비 및 조언을 제공 하기 위한 박사 이반 에르난데스와 그의 연구실 회원을 감사 합니다.
Materials
| 10ml serological pipets | Fisher Scientific | 13-676-10J | |
| 10ml syringe Luer-Loc tip | BD, Becton Dickinson | 309604 | |
| 15ml conical tubes | Falcon | 352097 | |
| 24-well tissue culture plates | Falcon | 353935 | |
| 40µm cell strainer | Fisher Scientific | 22368547 | |
| 50ml conical tubes | Falcon | 352098 | |
| 5ml serological pipets | Fisher Scientific | 13-676-10H | |
| 60mm tissue culture plates | Falcon | 353002 | |
| 70µm cell strainer | Fisher Scientific | 22363548 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) secondary antibody | Invitrogen | A11001 | |
| Alexa Fluor 488 goat anti-rabbit IgM (H+L) secondary antibody | Invitrogen | A21042 | |
| Alexa Fluor 488 goat anti-rabbit IgM (H+L) secondary antibody | Invitrogen | A11008 | |
| Alexa Fluor 594 goat anti-chicken IgG (H+L) secondary antibody | Invitrogen | A11042 | |
| Anti-O4 beads- Anti-O4MicroBeads | Miltenyi Biotec | 130-094-543 | |
| Apo-Transferrin human | Sigma | T1147 | |
| Autofil complete bottle top filter assembly, 0.22um filter, 250ml | USA Scientific | 6032-1101 | |
| Autofil complete bottle top filter assembly, 0.22um filter, 250ml | USA Scientific | 6032-1102 | |
| B27 Supplement | Invitrogen | 17504-044 | |
| Boric acid | Sigma | B7660 | |
| Bovine Growth Serum (BGS) | GE Healthcare Life Sciences | SH30541.03 | |
| BSA | Fisher Scientific | BP-1600-100 | |
| CNTF | Peprotech | 450-50 | |
| d-Biotin | Sigma | B4639 | |
| Desoxyribonuclease I (DNAse I) | Worthington | LS002007 | |
| EDTA | Fisher Scientific | S311 | |
| Epifluorescence microscope with an Olympus DP70 camera | Olympus | Bx51 | |
| Feather disposable scalpels | Andwin Scientific | EF7281C | |
| Forskolin | Sigma | F6886 | |
| German glass coverslips, #1 thickness, 12mm diameter round | NeuVitro | GG-12-oz | |
| GFAP antibody | Aves | GFAP | |
| Glucose | Fisher Scientific | D16-1 | |
| GlutaMAX | Invitrogen | 35050-61 | |
| Insulin | Invitrogen | 12585-014 | |
| Magnetic separator stand – MACS multistand | Miltenyi Biotec | 130-042-303 | |
| Magnetic separator-MiniMACS separator | Miltenyi Biotec | 130-042-302 | |
| Millex PES 0.22µm filter unit | Millipore | SLG033RS | |
| Mounting media- Prolong Gold with DAPI | Thermo Fisher | P36930 | |
| N-acetyl-cysteine (NAC) | Sigma | A8199 | |
| Natural mouse laminin | Invitrogen | 23017-015 | |
| Neurobasal Medium A | Invitrogen | 10888-022 | |
| Neurotrophin-3 (NT-3) | Peprotech | 450-03 | |
| NG2 antibody | Millipore | AB5320 | |
| Papain | Worthington | LS003126 | |
| PBS without Ca2+ and Mg2+ | Sigma | D5652 | |
| PDGF | Peprotech | 100-13A | |
| Petri dishes | Falcon | 351029 | |
| Poly-D-Lysine | Sigma | P6407 | |
| Primocin | Invivogen | ant-pm-2 | |
| Progesterone | Sigma | P8783 | |
| Putrescine | Sigma | P5780 | |
| Selection column-LS columns | Miltenyi Biotec | 130-042-401 | |
| Sodium Selenite | Sigma | S5261 | |
| Trace elements B | Corning | 25-000-CI | |
| Triiodothyronine (T3) | Sigma | T6397 | |
| Triton-X | Sigma | T8787 | |
| Trypan Blue Solution | Corning | 25-900-CI | |
| Tween 20 | Sigma | P1379 | |
| B27NBMA | 487.75 mL Neurobasal Medium A; 10 mL B27 Supplement; 1 mL Primocin; 1.25 mL Glutamax; Filter sterilize and store at 4 °C until use. | ||
| B27NBMA + 10% BGS | 27 mL B27NBMA; 3 mL Bovine growth serum | ||
| CNTF solution stock (10 µg/ml; 1000X) | Order from Peprotech (450-50). Make up at 0.1 to 1 mg/ml according to Manufacturer’s instruction (may vary from lot to lot) in buffer (e.g. DPBS + 0.2% BSA). Store at -80 °C. Working solution (10 µg/ml, 1000X) 1. Make on 0.2% BSA (Fisher scientific BP-1600-100) in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 10µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80 °C. |
||
| d-Biotin stock solution (50 µg/ml; 5000X) | Resuspend d-Biotin (Sigma-B4639) in double-distilled H2O at 50 µg/ml (e.g. 2.5 mg in 50 ml of ddH2O). Resuspension might take fair amount of agitation/vortexing, or mild warming briefly at 37°C. If the d-Biotin still will not solubilize, it is fine to make up a less concentrated (e.g. 10µg/ml), and to add a higher volume to the B27NBMA (1/1000), instead of 1/5000). Store at 4°C. | ||
| DNase I stock solution | 1. Dissolve at 12,500 U Deoxyribonuclease I / ml in HBSS chilled on ice. 2. Filter sterilize on ice 3. Aliquot at 200 µl and freeze overnight at -20°C. 4. Store aliquots at -20 to -30°C. |
||
| Dulbecco’s Phosphate Buffered Saline (w/o Ca2+ and Mg2+) | Dissolve pouch in 1 Liter of water to yield 1 liter of medium at 9.6 grams of powder per liter of medium. Store at 2-8 °C. | ||
| Forskolin stock solution (4.2 mg/ml; 1000X) | Add 1 ml of sterile DMSO to 50 mg Forskolin in bottle (Sigma-F6886) and pipette until resuspended. Transfer to a 15 ml centrifuge tube and add 11 ml of sterile DMSO to bring to 4.2 mg/ml. Aliquot (e.g. 20 µl) and store at -20°C. | ||
| Hank’s balanced salts (HBSS) (Sigma | 1. Measure 900 ml of water (temperature 15-20 °C) in a cylinder and stir gently. 2. Add the power and stir until dissolved. 3. Rinse original package with a small amount of water to remove all traces of the powder. 4. Add to the solution in step 2. 5. Add 0.35 gr of sodium bicarbonate (7.5% w/v) for each liter of final volume. 6. Keep stirring until dissolved. 7. Adjust the pH of the buffer while stirring to 0.1-0.3 units below pH= 7.4 since it may rise during filtration. The use of 1N HCl or 1N NaOH is recommended to adjust the pH. 8. Add additional water to bring the final volume to 1L. 9. Sterilize by filtration using a membrane with a porosity of 0.22 microns. 10. Store at 2-8 °C. |
||
| Insulin stock solution (4000 µg/ml) | Thaw the bottle and aliquot 25 µl per microcentrifuge tube and store at -20°C. | ||
| Laminin solution | Slowly thaw laminin in the cold (2°C to 8°C) to avoid gel formation. Then, aliquot into polypropylene tubes. Store at 5° C to -20° C in aliquots (e.g. 20 µl) and do not freeze/thaw repeatedly. Laminin may be stored at these temperatures for up to six months. | ||
| Magnetic Cell Sorting (MCS) Buffer | Prepare the solution containing phosphate-buffered saline (PBS), pH 7.2, and 0.5% bovine serum albumin (BSA), 0.5 mM EDTA, 5µg/ml Insulin, 1 g/L Glucose. Sterilize and degas by filtration the buffer by passing it through a 0.22 µm Millex filter. Store the buffer at 4°C until use | ||
| N-Acetyl-L-cysteine (NAC) stock solution (5mg/ml; 1000X) | Dissolve N-Acetyl-L-cysteine (Sigma-A8199) at 5 mg/ml in DMEM (e.g. 50 mg NAC in 10 ml B27NBMA). Filter sterilize and aliquot (e.g. 20 µl). Store at -20°C. | ||
| NT3 stock solution (1 µg/ml; 1000X) | Master stock: Order from Peprotech (450-03). Make up at 0.1 to 1 mg/ml according to manufacturer’s instructions (may vary from lot to lot), in buffer (e.g. DPBS + 0.2% BSA). Store at -80°C. Working stock (1µg/ml; 1000X): 1. Make on 0.2% BSA in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 1 µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (e.g. 20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80°C. |
||
| PDGF stock solution (10 µg/ml; 1000X) | Master stock: Order from Peprotech (100-13A). Make up at 0.1 to 1 mg/ml according to manufacturer’s instructions (may vary from lot to lot) in buffer (e.g. DPBS) + 0.2% BSA). Store at -80°C. Working stock (1µg/ml; 1000X): 1. Make on 0.2% BSA in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 1µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (e.g. 20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80°C. |
||
| Poly-D-lysine (1mg/ml; 100X) | Resuspend poly-D-lysine, molecular weight 70-150 kD (Sigma P6407) at 0.5mg/ml in 0.15M boric acid pH 8.4 (e.g. 50mg in 50ml borate buffer). Filter sterilize and aliquot (e.g. 100µl/tube). Store at -20°C. Prior to use, dilute the 100X stock (1mg/ml) to 50 µg/ml in sterile water. | ||
| Oligodendrocyte proliferation media | see Supplementary Table 1 | ||
| Oligodendrocyte differentiation media | see Supplementary Table 1 | ||
| Sato supplement (100X) | see Supplementary Table 1 | ||
| References: the list of reagents and recipes were adopted from the protocols previously described by Emery et. al. 2013 (Emery, B. & Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harb Protoc. 2013 (9), 854-868, doi:10.1101/pdb.prot073973, (2013)) and Dincman et. al. (Dincman, T. A., Beare, J. E., Ohri, S. S. & Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. J Neurosci Methods. 209 (1), 219-226, doi:10.1016/j.jneumeth.2012.06.017, (2012)) |
Referências
- Emery, B. Regulation of oligodendrocyte differentiation and myelination. Science. 330 (6005), 779-782 (2010).
- Yang, Z., Watanabe, M., Nishiyama, A. Optimization of oligodendrocyte progenitor cell culture method for enhanced survival. J Neurosci Methods. 149 (1), 50-56 (2005).
- Niu, J., et al. An efficient and economical culture approach for the enrichment of purified oligodendrocyte progenitor cells. J Neurosci Methods. 209 (1), 241-249 (2012).
- Zhang, S. C. Defining glial cells during CNS development. Nat Rev Neurosci. 2 (11), 840-843 (2001).
- Pfeiffer, S. E., Warrington, A. E., Bansal, R. The oligodendrocyte and its many cellular processes. Trends Cell Biol. 3 (6), 191-197 (1993).
- Hart, I. K., Richardson, W. D., Heldin, C. H., Westermark, B., Raff, M. C. PDGF receptors on cells of the oligodendrocyte-type-2 astrocyte (O-2A) cell lineage. Development. 105 (3), 595-603 (1989).
- Nishiyama, A., Lin, X. H., Giese, N., Heldin, C. H., Stallcup, W. B. Interaction between NG2 proteoglycan and PDGF alpha-receptor on O2A progenitor cells is required for optimal response to PDGF. J Neurosci Res. 43 (3), 315-330 (1996).
- Pringle, N. P., Mudhar, H. S., Collarini, E. J., Richardson, W. D. PDGF receptors in the rat CNS: during late neurogenesis, PDGF alpha-receptor expression appears to be restricted to glial cells of the oligodendrocyte lineage. Development. 115 (2), 535-551 (1992).
- Grinspan, J. B., Franceschini, B. Platelet-derived growth factor is a survival factor for PSA-NCAM+ oligodendrocyte pre-progenitor cells. J Neurosci Res. 41 (4), 540-551 (1995).
- Sharifi, K., et al. Differential expression and regulatory roles of FABP5 and FABP7 in oligodendrocyte lineage cells. Cell Tissue Res. 354 (3), 683-695 (2013).
- Chittajallu, R., Aguirre, A., Gallo, V. NG2-positive cells in the mouse white and grey matter display distinct physiological properties. J Physiol. 561 (Pt 1), 109-122 (2004).
- Bansal, R., Warrington, A. E., Gard, A. L., Ranscht, B., Pfeiffer, S. E. Multiple and novel specificities of monoclonal antibodies O1, O4, and R-mAb used in the analysis of oligodendrocyte development. J Neurosci Res. 24 (4), 548-557 (1989).
- Sommer, I., Schachner, M. Monoclonal antibodies (O1 to O4) to oligodendrocyte cell surfaces: an immunocytological study in the central nervous system. Dev Biol. 83 (2), 311-327 (1981).
- Boda, E., et al. The GPR17 receptor in NG2 expressing cells: focus on in vivo cell maturation and participation in acute trauma and chronic damage. Glia. 59 (12), 1958-1973 (2011).
- Dean, J. M., et al. Strain-specific differences in perinatal rodent oligodendrocyte lineage progression and its correlation with human. Dev Neurosci. 33 (3-4), 251-260 (2011).
- Yu, W. P., Collarini, E. J., Pringle, N. P., Richardson, W. D. Embryonic expression of myelin genes: evidence for a focal source of oligodendrocyte precursors in the ventricular zone of the neural tube. Neuron. 12 (6), 1353-1362 (1994).
- Armstrong, R. C., Dorn, H. H., Kufta, C. V., Friedman, E., Dubois-Dalcq, M. E. Pre-oligodendrocytes from adult human CNS. J Neurosci. 12 (4), 1538-1547 (1992).
- Gard, A. L., Pfeiffer, S. E. Oligodendrocyte progenitors isolated directly from developing telencephalon at a specific phenotypic stage: myelinogenic potential in a defined environment. Development. 106 (1), 119-132 (1989).
- Bjelke, B., Seiger, A. Morphological distribution of MBP-like immunoreactivity in the brain during development. Int J Dev Neurosci. 7 (2), 145-164 (1989).
- Hardy, R. J., Friedrich, V. L. Progressive remodeling of the oligodendrocyte process arbor during myelinogenesis. Dev Neurosci. 18 (4), 243-254 (1996).
- Hartman, B. K., Agrawal, H. C., Kalmbach, S., Shearer, W. T. A comparative study of the immunohistochemical localization of basic protein to myelin and oligodendrocytes in rat and chicken brain. J Comp Neurol. 188 (2), 273-290 (1979).
- Wei, Q., Miskimins, W. K., Miskimins, R. Stage-specific expression of myelin basic protein in oligodendrocytes involves Nkx2.2-mediated repression that is relieved by the Sp1 transcription factor. J Biol Chem. 280 (16), 16284-16294 (2005).
- Stolt, C. C., et al. Terminal differentiation of myelin-forming oligodendrocytes depends on the transcription factor Sox10. Genes Dev. 16 (2), 165-170 (2002).
- Emery, B., et al. Myelin gene regulatory factor is a critical transcriptional regulator required for CNS myelination. Cell. 138 (1), 172-185 (2009).
- Reynolds, R., Wilkin, G. P. Development of macroglial cells in rat cerebellum. II. An in situ immunohistochemical study of oligodendroglial lineage from precursor to mature myelinating cell. Development. 102 (2), 409-425 (1988).
- Scolding, N. J., et al. Myelin-oligodendrocyte glycoprotein (MOG) is a surface marker of oligodendrocyte maturation. J Neuroimmunol. 22 (3), 169-176 (1989).
- Fewster, M. E., Scheibel, A. B., Mead, J. F. The preparation of isolated glial cells from rat and bovine white matter. Brain Res. 6 (3), 401-408 (1967).
- Gard, A. L., Williams, W. C., Burrell, M. R. Oligodendroblasts distinguished from O-2A glial progenitors by surface phenotype (O4+GalC-) and response to cytokines using signal transducer LIFR beta. Dev Biol. 167 (2), 596-608 (1995).
- Gard, A. L., Pfeiffer, S. E. Glial cell mitogens bFGF and PDGF differentially regulate development of O4+GalC- oligodendrocyte progenitors. Dev Biol. 159 (2), 618-630 (1993).
- Barres, B. A., Raff, M. C. Proliferation of oligodendrocyte precursor cells depends on electrical activity in axons. Nature. 361 (6409), 258-260 (1993).
- Behar, T., McMorris, F. A., Novotny, E. A., Barker, J. L., Dubois-Dalcq, M. Growth and differentiation properties of O-2A progenitors purified from rat cerebral hemispheres. J Neurosci Res. 21 (2-4), 168-180 (1988).
- Vitry, S., Avellana-Adalid, V., Lachapelle, F., Baron-Van Evercooren, A. Migration and multipotentiality of PSA-NCAM+ neural precursors transplanted in the developing brain. Mol Cell Neurosci. 17 (6), 983-1000 (2001).
- Duncan, I. D., Paino, C., Archer, D. R., Wood, P. M. Functional capacities of transplanted cell-sorted adult oligodendrocytes. Dev Neurosci. 14 (2), 114-122 (1992).
- Goldman, J. E., Geier, S. S., Hirano, M. Differentiation of astrocytes and oligodendrocytes from germinal matrix cells in primary culture. J Neurosci. 6 (1), 52-60 (1986).
- Althaus, H. H., Montz, H., Neuhoff, V., Schwartz, P. Isolation and cultivation of mature oligodendroglial cells. Naturwissenschaften. 71 (6), 309-315 (1984).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85 (3), 890-902 (1980).
- Szuchet, S., Yim, S. H. Characterization of a subset of oligodendrocytes separated on the basis of selective adherence properties. J Neurosci Res. 11 (2), 131-144 (1984).
- Chew, L. J., DeBoy, C. A., Senatorov, V. V. Finding degrees of separation: experimental approaches for astroglial and oligodendroglial cell isolation and genetic targeting. J Neurosci Methods. 236, 125-147 (2014).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harb Protoc. 2013 (9), 854-868 (2013).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. J Neurosci Methods. 209 (1), 219-226 (2012).
- Buttery, P. C., ffrench-Constant, C. Laminin-2/integrin interactions enhance myelin membrane formation by oligodendrocytes. Mol Cell Neurosci. 14 (3), 199-212 (1999).
- Chun, S. J., Rasband, M. N., Sidman, R. L., Habib, A. A., Vartanian, T. Integrin-linked kinase is required for laminin-2-induced oligodendrocyte cell spreading and CNS myelination. J Cell Biol. 163 (2), 397-408 (2003).
- Colognato, H., Ramachandrappa, S., Olsen, I. M., ffrench-Constant, C. Integrins direct Src family kinases to regulate distinct phases of oligodendrocyte development. J Cell Biol. 167 (2), 365-375 (2004).
- ffrench-Constant, C., Colognato, H. Integrins: versatile integrators of extracellular signals. Trends Cell Biol. 14 (12), 678-686 (2004).
- Oh, L. Y., Yong, V. W. Astrocytes promote process outgrowth by adult human oligodendrocytes in vitro through interaction between bFGF and astrocyte extracellular matrix. Glia. 17 (3), 237-253 (1996).
- Besnard, F., Perraud, F., Sensenbrenner, M., Labourdette, G. Effects of acidic and basic fibroblast growth factors on proliferation and maturation of cultured rat oligodendrocytes. Int J Dev Neurosci. 7 (4), 401-409 (1989).
- Armstrong, R., Friedrich, V. L., Holmes, K. V., Dubois-Dalcq, M. In vitro analysis of the oligodendrocyte lineage in mice during demyelination and remyelination. J Cell Biol. 111 (3), 1183-1195 (1990).
- Grinspan, J. B., Stern, J. L., Franceschini, B., Pleasure, D. Trophic effects of basic fibroblast growth factor (bFGF) on differentiated oligodendroglia: a mechanism for regeneration of the oligodendroglial lineage. J Neurosci Res. 36 (6), 672-680 (1993).
- Mason, J. L., Goldman, J. E. A2B5+ and O4+ Cycling progenitors in the adult forebrain white matter respond differentially to PDGF-AA, FGF-2, and IGF-1. Mol Cell Neurosci. 20 (1), 30-42 (2002).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J Vis Exp. (71), (2013).

