その場で有髄軸索のスペクトル反射型顕微鏡
Summary
イメージング分光反射率に基づくラベル無料ナノを使用して固定脳スライスの髄軸索をイメージングのためのステップバイ ステップ プロトコルを紹介します。
Abstract
哺乳類の神経系ミエリンは多層スパイラル軸索線維の enwrapping で電気絶縁を提供します。その度に編成されて細胞内建築に触発され、我々 は最近という名前のスペクトル反射 (領域)、原ライブ有髄軸索の前例のないラベル無料ナノスケール イメージングを可能にする新しいイメージング法を開発しました。基本原理は、多層の細胞レベル下の構造の反射スペクトルを分析することによりナノ構造情報を得ることです。この記事で商業共焦点顕微鏡システム、白色光レーザーと波長可変フィルターを用いた神経組織の基本的な領域イメージングを実行するための詳細なステップバイ ステップ プロトコルについて述べる。スペクトル データ、およびナノ構造の情報を得るための画像処理による試料作製の手順を紹介します。
Introduction
哺乳類の神経系のミエリンは enwrapping 多層膜鞘と軸索線維によって急速な神経伝導と軸索の整合性を提供します。多層構造が細胞膜から成るなナノスケール薄膜を交互で構成される (〜 5 nm)、細胞質 (~ 3 nm)、および細胞外スペース (〜 7 nm)1,2。最近超解像顕微鏡などの光学顕微鏡は光の回折3,4、5のための不十分な解像度のためのナノスケール ミエリンの動態を観察するため適していません。電子顕微鏡は、ミエリン ナノ構造の細部を提供できますが、生物系化学固定法と ultrasectioning67,を含む高度侵襲的なサンプルの準備のために互換性がないです。.最近までなかった技術適用有髄軸索原のナノスケール動態を観察します。
Schainらは、有髄軸索がカラフルな光の反射率8を示すことを報告しました。反射光の分光分析を採用し、我々 はスペクトル反射 (領域)9の名前の有髄軸索のナノスケール イメージングのための新しいイメージング法を考案しました。領域は、髄鞘 (図 1) の多層構造で発生する薄膜干渉に基づいています。様々 な軸索の光学シミュレーションによる我々 は反射率スペクトル波数とその周期の周期関数であることを明らかにしている (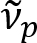 ) は軸索の直径 (d) に反比例します。この簡単な関係 (
) は軸索の直径 (d) に反比例します。この簡単な関係 (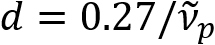 ) 領域データから軸索直径の安易な定量化を提供しています。これを利用して、私たちは私たちの前のレポートで軽度外傷性脳損傷の下で膨らんだ流行している軸索を明らかにしました。
) 領域データから軸索直径の安易な定量化を提供しています。これを利用して、私たちは私たちの前のレポートで軽度外傷性脳損傷の下で膨らんだ流行している軸索を明らかにしました。
スピア システム共焦点顕微鏡に基づいて成っている特殊な光源とフィルター (図 2)。入力ソースがホワイト ライト レーザー, 広帯域スペクトル出力赤外領域に表示を提供することです。2 つの音響光学素子のスペクトル スキャン、システムが搭載されて: 入力広帯域光源と音響光ビームスプリッター (AOBS) から選択した波長を提供して反映選択を導くための音響光学波長可変フィルター (AOTF)検出器波長。ハイパー共焦点の顕微鏡検査のためソフトウェアは、さまざまな入力波長における反射率画像を順次取得するカスタマイズ可能なスペクトル スキャン オプションを提供します (材料の表を参照してください)。さらに、色収差は批判的にスペクトル測定に干渉することがしたがって、アポクロマート対物レンズの使用をお勧めします。
注記のうち、白色光レーザー出力不均一なスペクトルと光学部品もスペクトルのプロファイルに影響を与えます。したがって、得られたスペクトルは後続の定量分析用のキャリブレーションする必要があります。保護されたシルバー ミラーは通常、完全可視領域にほぼ一定の反射 (> 97%) を提供する参照として使用されます。得られたスペクトルは、ミラーからの参照スペクトルで、分かれています。
スペクトル スキャン スペクトル ステップ サイズ決定集録速度;したがって、それを最適化する必要があります。大きい軸索が高いスペクトル期間、細かいスペクトル サンプリングが必要です。例えば、直径 10 μ m、最大の生理学的な軸索の 1 つの軸索はスペクトル期間 〜 8 nm。4 のスペクトル サンプリング間隔を用いてナイキスト サンプリング条件を適用すると、マウス神経系における生理学的神経軸索をカバーする nm。このアプローチは完全スペクトル スキャンに数秒以上かかります、従っていないアプリケーションに適しています生体内で、生理学的運動 (例えば呼吸・心拍) が安定したスペクトル取得を妨害します。私たちは以前配列分析計 (集録速度 ≒ ピクセルあたり 30 ms) を使用して各ポイントの完全なスペクトルを取得するように設計、カスタマイズされた正立顕微鏡をインストルメント化することによってこの問題を解決しました。
このレポートでは、商業ハイパー スペクトル顕微鏡で行うことができる固定脳スライスの領域イメージングに関する詳細なプロトコルについて述べる (材料の表を参照してください)。したがって、プロトコルは、光計測の専門知識のない実験者で完了ことができます。私たちはまた、潜在的な問題および領域データの取得と解析のトラブルシューティングをカバーします。
Protocol
Representative Results
Discussion
スピアはスペクトル干渉法による、初めてのライブの有髄軸索のナノスケール情報を提供する新しいラベル無料画像モダリティです。現在獲得プロトコルで軸索直径の空間分解能が 10 nm。また、スピア利用; 他の超解像顕微鏡と比較して桁の低光量したがって、光毒性とフォトブリーチを行なったから無料です。スピアは、有髄軸索のナノスケール動態を研究するための新しい道を提供しま?…
Declarações
The authors have nothing to disclose.
Acknowledgements
この作品は、によって、研究所の基礎科学 (IBS R015 D1)、基本的な科学研究開発プログラムを通じて、国立研究財団の韓国 (NRF) 文部省 (2017R1A6A1A03015642) によって資金を供給にサポートされていました。
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
Referências
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

