Microscopia de reflectométrica espectral em dendritos In Situ
Summary
Aqui, apresentamos um protocolo passo a passo para imagem mielinizados axônios em uma fatia do cérebro fixo usando uma rótulo livre nanoescala imagem técnica baseada na reflectometria espectral.
Abstract
Em um sistema nervoso de mamíferos, mielina fornece um isolamento eléctrico por enwrapping as fibras de axônio em uma espiral de várias camada. Inspirado por sua arquitetura subcellular altamente organizado, desenvolvemos recentemente uma nova modalidade de imagem, chamada reflectometria espectral (provador), que permite que a imagem latente de nanoescala rótulo livre sem precedentes dos axônios mielinizadas ao vivo em situ. O princípio subjacente é obter informações nanoestrutural, analisando o espectro de refletância da estrutura subcelular várias camada. Neste artigo, descrevemos um protocolo detalhado passo a passo para a realização de uma imagem de provador básica dos tecidos nervosos usando um sistema comercial microscópico confocal, equipado com um laser de luz branca e um filtro sintonizável. Cobrimos os procedimentos de preparação da amostra, aquisição de dados espectrais e processamento de imagem para obtenção de informações nanoestrutural.
Introduction
No sistema nervoso dos mamíferos, mielina fornece condução nervosa rápida e integridade axonal por enwrapping as fibras de axônio com bainhas membranosas em várias camadas. É composta por sua estrutura várias camada alternando nanoescala fino-filmes compostas por membranas de plasma (~ 5 nm), citoplasma (~ 3 nm) e espaços extracelulares (~ 7 nm)1,2. Microscopia ótica, incluindo a recente microscopia de super-resolução, não são adequados para observar a dinâmica de mielina nanoescala devido a sua resolução insuficiente devido à difração óptica3,4,5. Apesar de microscopia eletrônica pode fornecer detalhes de nanostructure a mielina, não é compatível com os sistemas biológicos vivos devido a preparações altamente invasivo amostra envolvendo fixação química e,ultrasectioning67 . Até recentemente, não houve nenhuma técnica aplicável para observar a dinâmica de nanoescala de dendritos em situ.
Schain et al relataram anteriormente que dendritos exibem refletância de luz colorido8. Adotando a análise espectroscópica da luz refletida, criámos uma nova modalidade de imagem para a imagem latente de nanoescala de axônios mielinizados, chamado reflectometria espectral (provador)9. Provador baseia-se a interferência de filme fino que ocorrem na estrutura multi-camadas da bainha de mielina (Figura 1). Por simulação óptica em vários axônios, revelamos que o espectro de refletância é uma função periódica do número de onda e sua periodicidade (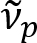 ) é inversamente proporcional ao diâmetro do axônio (d). Esta relação simples (
) é inversamente proporcional ao diâmetro do axônio (d). Esta relação simples (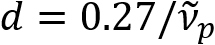 ) oferece fácil quantificação do diâmetro do axônio a partir dos dados do provador. Utilizando este, revelamos o axônio prevalente abaulamento sob leve traumatismo crânio-encefálico em nosso relatório prévio.
) oferece fácil quantificação do diâmetro do axônio a partir dos dados do provador. Utilizando este, revelamos o axônio prevalente abaulamento sob leve traumatismo crânio-encefálico em nosso relatório prévio.
O sistema de provador baseia-se na microscopia confocal e consiste de uma fonte de laser especializado e filtros (Figura 2). A fonte de entrada é um laser de luz branca, fornecendo banda larga saída espectral visível para regiões de infravermelhas. Para a varredura espectral, o sistema é equipado com dois dispositivos óptico-acústico: um filtro sintonizável Acusto-óptica (AOTF) para a entrega de um comprimento de onda selecionado de fonte entrada de banda larga e um divisor de feixe óptico-acústico (AOBS) para guiar o selecionado refletido comprimento de onda do detector. O software para a microscopia confocal hiperespectral (ver Tabela de materiais) oferece uma opção de varredura espectral personalizável para adquirir sequencialmente as imagens de reflectância em vários comprimentos de onda de entrada. Além disso, a aberração cromática criticamente pode interferir na medição espectral; Portanto, recomenda-se uso de uma lente objetiva de apochromat.
Digno de nota, lasers de luz branca produzir uma saída espectral desigual e componentes ópticos também afetam o perfil espectral. Portanto, os espectros adquiridos precisam ser calibrados para posterior análise quantitativa. Um espelho de prata protegido é geralmente usado como uma referência, que fornece uma reflectância quase constante (> 97%) sobre a região completamente visível. Os espectros adquiridos dividem-se em seguida pelos espectros de referência do espelho.
O tamanho de etapa espectral para a varredura espectral determina a velocidade de aquisição; assim, ele precisa ser otimizado. Como um axónio maior tem um período maior de espectral, requer mais fino amostragem espectral. Por exemplo, um axônio com um diâmetro de 10 µm, dentre os axônios fisiológicos maiores, tem um período espectral de ~ 8 nm. Aplicando os critérios de amostragem de Nyquist, utilizamos o intervalo de amostragem espectral de 4 nm para cobrir todos os axônios fisiológicos nos tecidos nervosos do mouse. Esta abordagem geralmente leva vários segundos para uma varredura espectral completa e, portanto, não é adequada para aplicações na vivo , onde o movimento fisiológico (por exemplo, respiração e batimentos cardíacos) interfere aquisição espectral estável. Anteriormente, resolvemos esse problema por instrumentação um microscópio vertical personalizado, concebido para adquirir todo o espectro para cada ponto usando um espectrômetro de matriz (aquisição velocidade ≈ 30 ms por pixel).
Neste relatório, descrevemos um protocolo detalhado do provador de imagens sobre uma fatia de cérebro fixa, que pode ser executada em um microscópio hiperespectrais comercial (ver Tabela de materiais). Assim, o protocolo pode ser concluído por experimentadores sem especialização em instrumentação óptica. Também abordamos os problemas potenciais e solução de problemas para a aquisição e análise de dados do provador.
Protocol
Representative Results
Discussion
Provador é uma nova modalidade de imagem livre de rótulo baseada na interferometria espectral, que pela primeira vez, oferece a informação de nanoescala em axônios mielinizadas ao vivo. No actual protocolo de aquisição, a resolução espacial para o diâmetro do axônio é da ordem de 10 nm. Além disso, o provador utiliza ordens de magnitude menor dose leve em comparação com outros microscopies de super-resolução; assim, é livre de fototoxicidade e fotobranqueamento. Provador forneceria uma nova avenida para…
Declarações
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi financiado pelo Instituto de ciência básica (IBS-R015-D1) e pelo programa de pesquisa de ciência básica através da nacional Research Foundation de Coreia (NRF) financiado pelo Ministério da educação (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
Referências
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

