Isolera och införliva ljus-skörd antenner från kiselalger Cyclotella Meneghiniana i liposomer med tylakoida lipider
Summary
Här presenterar vi ett protokoll för att isolera fucoxanthin klorofyll a/c-bindande proteiner (FCP) från kiselalger och införliva dem i liposomer med naturliga lipid kompositioner att studera excitation energiöverföring på ion sammansättning ändras.
Abstract
Fotosyntetiska prestanda av växter, alger och kiselalger beror starkt på snabb och effektiv reglering av ljuset skörd och energi överföring processer i tylakoida membranet i kloroplaster. Ljuset skörd antenn av kiselalger, de så kallade fucoxanthin klorofyll a/c-bindande proteinerna (FCP), krävs för ljusabsorption och effektiv överföring till fotosyntetiska reaktionen centrerar liksom när det gäller foto-skydd mot alltför stora ljus. Växla mellan dessa två funktioner handlar mångåriga forskning. Många av dessa studier har genomförts med FCP i tvättmedel miceller. För interaktionsstudier har tvätt tagits bort, vilket ledde till en ospecifik aggregering av FCP komplex. I detta synsätt är det svårt att diskriminera mellan artefakter och fysiologiskt relevanta data. Därför kan mer värdefull information om FCP och andra membran bunden ljus skörd komplex erhållas genom att studera protein-protein interaktioner, energiöverföring och andra spektroskopiska funktioner om de är inbäddade i deras infödda lipid miljö. Den största fördelen är att liposomer har en definierad storlek och en definierad lipid/proteinkvot som omfattningen av FCP klustring är kontrollerad. Ytterligare, förändringar i pH och ion sammansättning som reglerar ljus avverkning i vivo simuleras enkelt. I jämförelse med det tylakoida membranet är liposomer mer homogen och mindre komplex, vilket gör det lättare att få och förstå spektroskopiska data. Protokollet beskrivs förfarandet FCP isolering och rening, Liposom förberedelse och införlivande av FCP i liposomer med naturliga lipid sammansättning. Resultat från en typisk tillämpning ges och diskuterade.
Introduction
Fotosyntetiska organismer såsom kiselalger måste klara av ständigt föränderliga ljusförhållanden och svara med sofistikerade acklimatisering mekanismer som upprätthålla hög fotosyntetiska effektivitet och skydda från foto-oxidativ skada som orsakas av överdriven ljuset. En större tända-skyddande process i photosynthetic eukaryota organismer är hög energi släcka (qE) absorberas ljus som uppstår som den främsta bidragen till den icke-fotokemiska släcka (NPQ) under lätta stress villkor1,2 ,3. De lätta skörda antenn komplex (LHC) är involverade i regleringen av magnetiseringen energi överföring vägar. Svar på höga ljus inducerad lågt pH i kloroplast lumen, växlarna antenn system från ljuset skörd staten att släcka staten. Denna energi dissipativa staten skyddar fotosystem (PS) och andra komplex i tylakoida membran från photo-oxidation. I photosynthetic eukaryota organismer framkallas qE oftast av två faktorer1,2,3. En faktor är specialiserade ljuset skörd protein som svarar på den lågt pH. Proteinet PsbS inducerar qE i högre växter4. LhcSRs5, moduleras av PsbS aktivitet, framkalla qE i grönalger6. Kiselalger äger Lhcx-liknande proteiner som strukturellt besläktade LHCSRs7,8,9,10.
Den andra faktorn qE är xanthofyll cykeln där karotenoider av antennen konverteras till en foto-skyddande form av de-epoxidering och återgått av epoxidering. I växter och gröna alger konverteras violaxanthin till zeaxantin. I kiselalger omvandlas diadinoxanthin till diatoxanthin, som sedan korrelerar med omfattningen av NPQ11. Kiselalger ljuset skörd antenn besitter vissa egenheter även om det är evolutionärt relaterade till växter och alger LHCs. Övergången från ljus skörd till foto-skydd är oerhört snabb och NPQ kapacitet är högre jämfört med växter12. Detta kan vara en orsak varför kiselalger är mycket framgångsrika i olika ekologiska nischer på ett sätt som de är ansvariga för upp till 45% av den oceaniska netto primärproduktion13. Kiselalger ljus skörd system är därför ett intressant objekt av photosynthesis forskning.
Kiselalger, liknar centrerad arten Cyclotella meneghiniana, äger tylakoida inneboende ljus skörd system uppkallad efter pigment de binda – fucoxanthin, klorofyll (chl) a och c, därav FCP. ljus skörd proteiner, såsom FCPs, är inbäddad i tylakoida membran systemet bestående av flera membran lager. Kiselalger bilda band av tre thylakoids. Detta komplex situationen gör det svårt att studera dem på molekylär nivå i tylakoida membran. Dessutom bidrar många komponenter till regleringen av ljus skörd (se ovan). Därför i många metoder isolerades komplexen från membranet använder mild rengöringsmedel, till exempel n-Dodecyl-β-D-maltopyranoside (β-DDM), som solubilize membranet men hålla FCP komplexen intakt. Många spektroskopiska studier utfördes med solubilized FCP för att undersöka intramolekylära energi överföring14,15,16,17. Detta före detta tillvägagångssätt var dock begränsad eftersom regleringen av energiöverföringen behöver excitonic interaktion med andra antenn komplex eller fotosystem. Därför, dessa typer av studier inte kan utföras med solubilized komplex eftersom interaktionen mellan komplex går förlorad.
Ett viktigt inslag i antenn förordning är ”molekylär trängsel” antenn och fotosystem i tylakoida membran18. Tidigare, en enkel strategi genomfördes för att simulera effekten in vitro-. Tvättmedlet togs bort, vilket leder till slumpmässiga aggregering av antenn komplex. Även om vissa rimliga uppgifter erhölls genom detta tillvägagångssätt17,19, tvättmedel avlägsnande återspeglar inte den situation i vivo och har vissa begränsningar eftersom komplexen inte interagerar i sin regelbundna tertiär struktur.
Användning av liposomer övervinner flera av de tidigare begränsningarna. Tertiär struktur är fortfarande helt intakt. Liposom membranet ger en kvasi infödda miljö för antenn komplexen. Membranet separerar insidan av Liposom från den yttre miljön. Av dessa medel ger liposomer två reaktion fack för studier av ion och pH lutningar samt när det gäller processer. Ytterligare, parametrarna för experimentell systemet kan kontrolleras lättare för studier i tylakoida membran. Liposomer har redan visat sig vara ett utmärkt verktyg att studera fotosyntetiska komplex. Ett stort fokus i förflutnan var på anläggning LHC där effekten av förändrade lipid sammansättning testades på LHC II20. I andra metoder, protein-protein interaktioner mellan olika LHC II var undersökta21. Också, vissa studier i grönalger genomfördes som beskriver spontana klustring mellan LHC22. Som beaktar betydelsen av kiselalger för akvatiska ekosystem, relativt få studier utfördes med antenn komplex av kiselalger. Två studier undersökt antenn komplexen av den centrerad Cyclotella meneghiniana, var den klustring av FCP antenn23 och lyhördhet av FCP till elektrokemiska övertoningar24 visades. Liposomer är alltså ett utmärkt verktyg att studera kiselalger antenner och deras interaktion och förordning i nästan inhemska förhållanden. Liposomer är mångsidig eftersom många förhållanden såsom lipid sammansättning, Liposom storlek, protein densitet och kringliggande vattenfasen kan styras. Metoden kräver dessutom låga mängder prover. Det experimentella systemet är robusta och mycket reproducerbara. Uppdelning i liposomer möjliggör studera pH och ion övertoningar, vilka är viktiga faktorer i regleringen av antenn komplex.
Här beskriver vi isolera FCP antenn komplex från C. meneghiniana och deras införlivande i liposomer med naturliga tylakoida lipid sammansättning. Också, vi tillhandahåller exemplariskt data för spektroskopisk karakterisering av solubilized FCP och jämföra dem med FCP i liposomer. Metoden sammanfattar kunskap och standardiserade protokoll erhålls från förbättringar av Gundermann och Büchel 201223, Natali et al. 201622och Ahmad och Dietzel 201724.
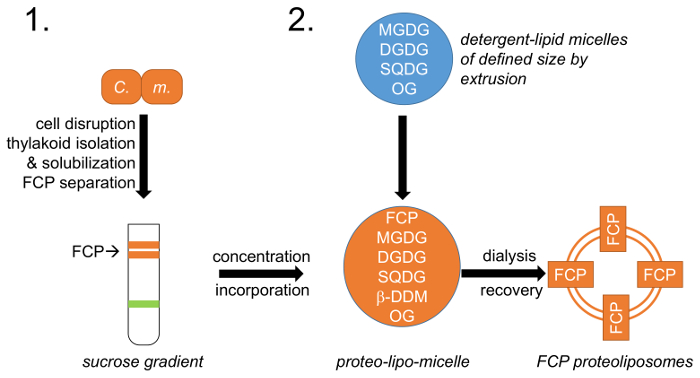
Figur 1: Schematisk bild av arbetsflödet. (1) refererar till punkt 1 och som beskriver celltillväxt, störningar och tylakoida isolering med följande FCP separation på sackaros täthetlutningar; C. m. –Cyclotella meneghiniana celler. (2) beredning av naturliga tylakoida lipid blandning (MGDG, DGDG och SQDG) beskrivs i punkt 2 och skapandet av lipid-tvättmedel miceller med octylglycoside (OG). En definierad lipid-micelle storlek uppnås genom extrudering med membran av definierade pordiameter. FCP och lipid-miceller är enhetlig på en fördefinierad lipid: förhållandet mellan protein och tvätt OG och β-DDM är borttagna via kontrollerade dialys bildar FCP proteoliposomes. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
FCP liposomer med naturliga lipid sammansättning ger en praktisk, enkel och reproducerbara verktyg för att undersöka spektroskopiska boenden in vitro-. Lipid miljön i FCP liposomer liknar situationen inom tylakoida membranet, vilket ger upphov till experimentella resultat som är närmare naturliga förhållanden.
I området i närheten finns det flera fördelar med att använda C. meneghiniana som modellsystem för FCP antenn. Den växer relativt fort och är mer robust …
Declarações
The authors have nothing to disclose.
Acknowledgements
Vi tackar Rana Adeel Ahmad för bistånd i FCP rening. Prof. Claudia Büchel är erkänt för bra diskussioner och läsa manuskriptet. Detta arbete fick stöd av den tyska forskningsfondens till LD (DI1956-1/1) och Humboldt foundation för ett Feodor Lynen stipendium till LD.
Materials
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel – por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer – Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | |||
| For specific safety instructions please refer to material safety sheets and repective manuals. | |||
| Standard lab material and substances are not listed. |
Referências
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Bioquímica. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Bioquímica. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Bioquímica. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).

