Undertype-specifikke optisk aktionspotentialet optagelser i menneskelige induceret pluripotente stamceller-afledt ventrikulær Cardiomyocytes
Summary
Her præsenterer vi en metode til optisk billede handling potentialer, specielt i ventrikel-lignende inducerede pluripotente stamceller-afledt cardiomyocytes. Metoden er baseret på udtrykket promotor-drevet af en spænding-følsomme fluorescerende proteiner.
Abstract
Cardiomyocytes genereres fra menneskelige inducerede pluripotente stamceller (iPSC-CMs) er en spirende værktøj i hjerte-kar-forskning. Snarere end at være en homogen population af celler, iPSC-CMs skabt af nuværende differentiering protokoller repræsenterer en blanding af celler med ventrikel-, atrieflimren-, og nodal-lignende fænotyper, som komplicerer fænotypiske analyser. Her, er en metode til optisk optage handling potentialer specifikt fra ventrikulær-lignende iPSC-CMs præsenteret. Dette opnås ved lentiviral transduktion med en konstruktion, hvor en genetisk kodet spænding indikator er under kontrol af en ventrikulær-specifikke promotor element. Når iPSC-CMs er transduced med denne konstruktion, udtrykkes spændingsmåler udelukkende i ventrikel-lignende celler, aktivering undertype-specifikke optisk membran potentielle optagelser ved hjælp af time-lapse Fluorescens mikroskopi.
Introduction
Cardiomyocytes (CMs) afledt af induceret pluripotente stamceller (iPSCs) er et kommende værktøj til at dissekere molekylære mekanismer for hjertesygdomme, at undersøge nye behandlingsformer, og at skærmen for negative hjerte narkotika effekter1,2 ,3. Lige fra starten, har arrhythmogenic sygdomme som channelopathies været et vigtigt fokus for denne forskning område4. Metoder til at undersøge elektriske fænotyper af CMs, såsom arytmier eller ændringer i aktionspotentialet (AP) morfologier, er derfor, i hjertet af denne teknologi.
En vigtig overvejelse i anvendelsen af iPSC-CMs er, at nuværende hjerte differentiering protokoller ikke resulterer i en homogen population af celler. I stedet, de er snarere en blanding af celler der ligner sinusknuden, atrieflimren, og ventrikulær CMs på forskellige niveauer af modning5,6,7,8. Denne forskelligartethed kan være en relevant kilde eksperimentel variation, især hvis parametre som AP varighed (APD) er undersøgt, som uløseligt er forskellige mellem CM undertyper (f.eks.APD er kortere i atrieflimren end i ventrikulær CMs). Den konventionelle tilgang til at løse dette problem er at undersøge enkelt iPSC-CMs ved hjælp af metoden patch klemme og klassificere hver celle som nodal-, atrieflimren-, eller ventrikulær-lignende, baseret på dens AP morfologi9. Enhver efterfølgende analyse kan begrænses derefter til de celler, der repræsenterer CM undertype af interesse. Den store ulempe ved denne strategi er dens begrænsede produktion og mangel på skalerbarhed. Derudover tillader patch klemme Elektrofysiologi invasiv art ikke billeddannelse af de samme celler sekventielt over længere perioder.
Her give vi eksperimentelle detaljer på en metode10 udviklet optisk billede APs i specifikke undertyper af iPSC-CMs. Dette overvinder problemet med subtype heterogenitet og øger dramatisk throughput sammenlignet med konventionelle metoder, så den hurtige fænotyper af iPSC-CMs bærer genetiske varianter eller bliver udsat for farmakologiske stoffer.
Oversigt over den undertype-specifikke optiske billeddannelse tilgang
En genetisk kodet spænding indikator (GEVI), hvis fluorescens egenskaber ændre på depolarisering og repolarisering af cellemembranen, bruges til optisk billede ændres af membran potentiale af CMs. GEVI anvendes her er den spænding-sensing fluorescerende protein VSFP-CR11, som består af en spænding-sensing transmembrane domæne smeltede sammen til et par en grøn (kløver) og en rød (mRuby2) fluorescerende proteiner (figur 1A). På grund af nærhed af de to fluorophores, excitation af den grønne fluorescerende proteiner resultater på en brøkdel af excitation energi overføres til den røde fluorescerende proteiner via Förster resonans energioverførsel (FRET). Derfor resulterer excitation af den grønne fluorescerende proteiner i en emission fra både grønne og de røde fluorescerende proteiner (figur 1A, øverste panel). Når cellen depolarizes, opstår en strukturel omlægning af spændingsmåler der giver sig udslag i en omlægning af de to fluorescerende proteiner, øge FRET effektivitet. Således overføres endnu mere for magnetisering energi fra grønne til de røde fluorescerende proteiner (figur 1A, nederste panel). Som et resultat, i en depolarized celle, grønne fluorescens emission er svagere, og den røde fluorescens emission er lysere end i en celle på hvile membran potentiale (figur 1B).
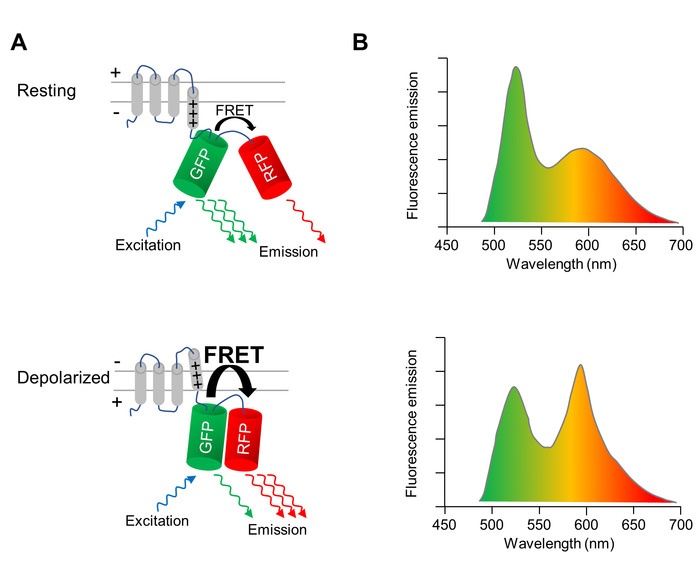
Figur 1: optiske billeddannelse af membran potentiale med VSFP-kr.NOTANR (A) A skematisk skildrer handlingen af spænding-følsomme fluorescerende proteiner VSFP-CR er vist. Ved depolarisering af cellemembranen, en strukturel omlægning i den spænding-sensing transmembrane domæne giver sig udslag i en omlægning af green (normal god landbrugspraksis) og rød (RFP) fluorescerende proteiner, øge effektiviteten af den intramolekylære Förster resonans energioverførsel (FRET). (B) emission spektre af en VSFP ved excitation af normal god landbrugspraksis i celler på den hvilende membran potentiale (øverste panel) og i depolariseret celler (nederste panel) er afbildet. Den spektrale ændring ved depolarisering er overdrevet for klarhed. Venligst klik her for at se en større version af dette tal.
Ændringer i FRET effektivitet spejling udsving af membranen potentiale er afbildet ved hjælp af et fluorescens mikroskop udstyret med en image splitter, som adskiller røde og grønne fluorescens emission og projekter dem på to tilstødende områder af chip af en sCMOS kamera (figur 2). Med dette set-up, kan fluorescens emission på to forskellige bølgelængde bands registreres samtidigt, hvilket giver mulighed for beregning af forholdet mellem rød til grøn fluorescens afspejler membran potentiale i hvert billede af en time-lapse serie.
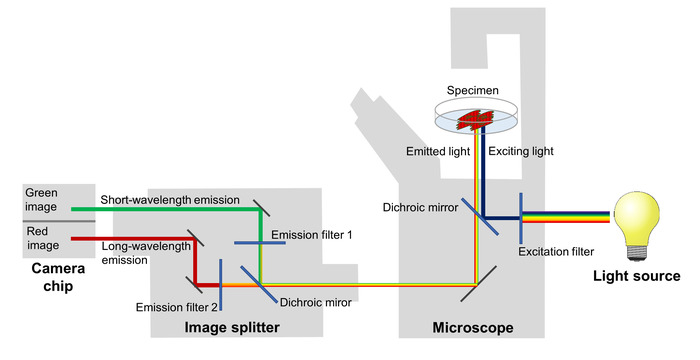
Figur 2: konfiguration af imaging systemet. De vigtigste komponenter i den billedbehandlingssystem bruges til billede de spektrale ændringer af spænding-følsomme fluorescerende proteiner spejling membran potentielle ændringer på en høj tidsmæssige opløsning er afbildet. Venligst klik her for at se en større version af dette tal.
Udtryk for VSFP-CR i CMs er opnået ved lentiviral transduktion. Direkte udtryk til CM undertype af interesse, indeholder en lentivirus en promotor element ( MLC2v forstærker), der specifikt drev transskription i ventrikel-lignende iPSC-CMs10. Når iPSC-CMs, der repræsenterer en blanding af atrieflimren-lignende, nodal-lignende og ventrikel-lignende celler er transduced med denne lentivirus, er VSFP-CR kun udtrykt i ventrikel-lignende celler. Da den optiske aktionspotentialet imaging afhænger denne fluorescerende sensor, repræsenterer de optagede handling potentialer udelukkende CM undertype af interesse (figur 3).
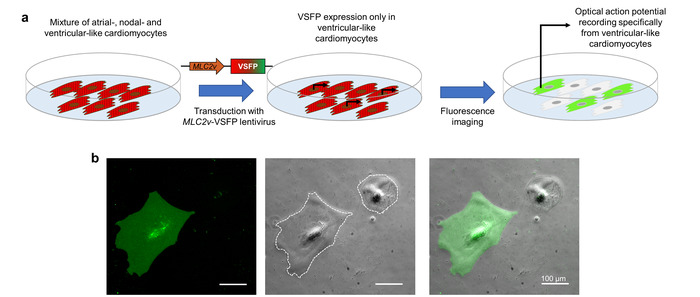
Figur 3: promotor-drevet VSFP udtryk for undertype-specifikke membran potentielle imaging. (pt) denne skematiske viser hvordan cardiomyocyte undertype-specifikke optisk aktionspotentialet optagelser er opnået. (b) iPSC-CMs inficeret med en VSFP under kontrol af den ventrikulære-specifikke MLC2v-forstærker er vist. Udtryk for en spændingsmåler ses kun i ventrikel-lignende CMs i normal god landbrugspraksis kanal (venstre panel). Der tilbydes også fasekontrast (midterste panel) og overlejringsbillede (højre panel). De hvide stiplede linjer markere celle grænser. Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Metoden beskrevet her giver en optisk registrering af APs fra en bestemt undertype (dvs., ventrikel-lignende celler) af CMs genereret fra menneskelige iPSCs. Menneskelige iPSC-CMs er en spirende værktøj til at løse en lang række biologiske og medicinske problemer, og differentiering til forskellige CM undertyper er en vigtig kilde til eksperimentel variation. Ved hjælp af specifikke promotor elementer, er udtryk for en GEVI specifikt opnået i CMs repræsenterer undertype af interesse, som er derefter optis…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af tilskud fra den tyske Research Foundation (Si 1747/1-1), andet Kröner-Fresenius-Stiftung og Deutsche Stiftung für Herzforschung.
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
Referências
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

