Subtyp-specifika optiska aktionspotential inspelningar i mänskliga inducerade pluripotenta stamceller-derived ventrikulära hjärtmuskelcellerna
Summary
Här presenterar vi en metod för att optiskt bild handlingspänningar, särskilt i ventrikulära-liknande inducerade pluripotenta stamceller-derived hjärtmuskelcellerna. Metoden är baserad på arrangören-driven uttrycket av en spänningskänsliga fluorescerande protein.
Abstract
Hjärtmuskelcellerna genereras från mänskliga inducerade pluripotenta stamceller (iPSC-CMs) är ett framväxande verktyg i kardiovaskulär forskning. Snarare än att vara en homogen population av celler, iPSC-CMs genereras av nuvarande differentiering protokoll representerar en blandning av celler med ventrikulära-, förmaks-, och nodal-liknande fenotyper, vilket komplicerar fenotypiska analyser. Här presenteras en metod för att optiskt rekord handlingspänningar specifikt från ventrikulära-liknande iPSC-CMs. Detta uppnås genom lentiviral transduktion med en konstruktion där en genetiskt-kodade spänningsindikator är under kontroll av en ventrikulär-specifika promotorn element. När iPSC-CMs är sensorik med denna konstruktion, uttrycks spänningssensor uteslutande i ventrikulära-liknande celler, aktivera subtyp-specifika optiska membran potentiella inspelningar med time-lapse fluorescensmikroskopi.
Introduction
Hjärtmuskelcellerna (CMs) härrör från inducerade pluripotenta stamceller (iPSCs) är ett framväxande verktyg att dissekera molekylära mekanismer av hjärtsjukdom, att undersöka nya terapier, och till skärmen för kardiella biverkningar effects1,2 ,3. Rätt från början, har Högerkammarfunktion sjukdomar såsom channelopathies varit ett viktigt fokus för denna forskning område4. Metoder för att undersöka elektriska fenotyper av CMs, såsom arytmier eller förändringar i aktionspotential (AP) morfologier, är således kärnan i denna teknik.
En viktig faktor i tillämpningen av iPSC-CMs är att nuvarande hjärt differentiering protokoll inte resulterar i en homogen population av celler. Istället, de är snarare en blandning av celler som liknar sinusknutan, förmaksflimmer, och ventrikulära CMs på olika nivåer av mognad5,6,7,8. Denna heterogenitet kan vara en relevant källa av experimentell variationer, särskilt om parametrar såsom AP varaktighet (APD) undersöks, som intimt skiljer sig mellan CM subtyper (t.ex., APD är kortare i förmaksflimmer än i ventrikulära CMs). Den konventionella metoden för att lösa problemet är att undersöka enda iPSC-CMs med metoden för patch-clamp och klassificera varje cell som nodal-, förmaks-, eller ventrikulär-liknande, baserat på dess AP morfologi9. Eventuella efterföljande analys kan då begränsas till cellerna som representerar CM subtyp av intresse. Den stora nackdelen med denna strategi är dess begränsade genomströmning och avsaknaden av skalbarhet. Dessutom tillåter inte invasiva arten av patch clamp elektrofysiologi bildtagning av samma celler sekventiellt över längre tidsperioder.
Här tillhandahåller vi experimentella Detaljer om en metod10 utvecklade för att optiskt bild APs i specifika subtyper av iPSC-CMs. Detta övervinner problemet subtyp heterogenitet och ökar dramatiskt genomströmningen jämfört med konventionella metoder, så att den snabba fenotypning av iPSC-CMs bär genetiska varianter eller att vara utsatt för farmakologiska agenter.
Översikt av subtyp-specifika optisk imaging strategi
En genetiskt-kodade spänningsindikator (GEVI), vars fluorescens egenskaper ändras vid depolarisation och repolarisering av cellmembranet, används för att optiskt bild förändringar av membranet potential av CMs. Den GEVI tillämpas här är det spänningsavkännande fluorescerande proteinet VSFP-CR11, som består av en spänningsavkännande transmembrana domän smält till ett par en grön (klöver) och en röd (mRuby2) fluorescerande protein (figur 1A). På grund av närheten av de två fluorophores, excitation av grönt fluorescerande protein resulterar i en bråkdel av magnetiseringen energin överförs till den röda fluorescerande protein via Förster resonans energiöverföringen (bandet). Därför, excitation av grönt fluorescerande protein resulterar i utsläpp från både gröna och de röda fluorescerande proteinerna (figur 1A, övre panelen). När cellen depolarizes, uppstår en strukturell ombildning av spänning sensorn som översätter till en omorientering av de två fluorescerande proteiner, effektivisering bandet. Således överförs ännu mer av energin som excitation från gröna till röda fluorescerande proteinet (figur 1A, nedre panelen). Som ett resultat, i en Aricebo cell, grön fluorescens utsläpp är dimmer och röd fluorescens utsläpp är ljusare än i en cell på Vila membranpotential (figur 1B).
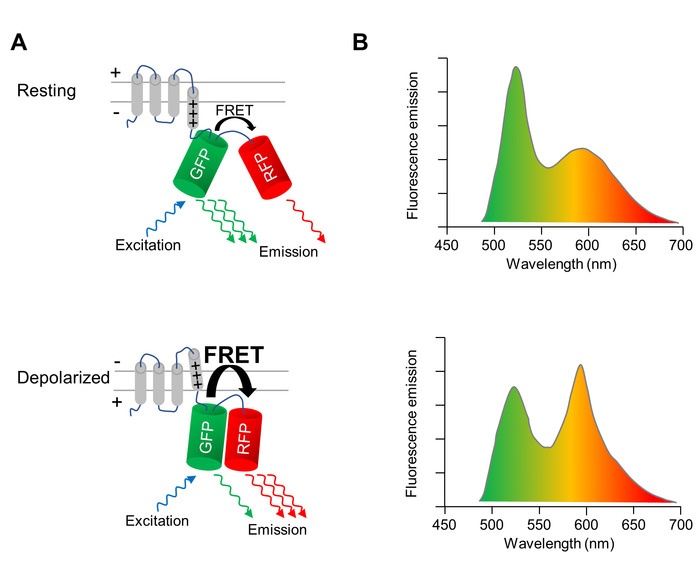
Figur 1: optisk avbildning av membranpotential som med VSFP-CR. (A) A Schematisk föreställande åtgärden av spänningskänsliga fluorescerande protein VSFP-CR visas. Vid depolarisation av cellmembranet översätter en strukturell ombildning i domänen spänningsavkännande transmembrana till en omorientering av den gröna (GFP) och röd (RFP) fluorescerande protein, öka effektiviteten i de intramolekylära Förster resonans energiöverföringen (bandet). (B) utsläpp spektra av en VSFP vid excitation av GFP i celler på vilande membranpotentialen (övre panelen) och i Aricebo celler (nedre panelen) skildras. Den spektrala ändringen vid depolarisation är överdriven tydlighet. Klicka här för att se en större version av denna siffra.
Förändringar i bandet effektivitet spegling växlingarna av membranet potential är avbildade med fluorescens Mikroskop utrustat med en bild-splitter, som skiljer röd och grön fluorescens utsläpp och projekt dem på två angränsande områden i chip av en sCMOS kamera (figur 2). Med denna uppsättning, kan fluorescens utsläpp på två olika våglängd band spelas in samtidigt, vilket gör att beräkningen av en kvot på röd-till-grön fluorescens att återspegla membranet potential i varje bild av en time-lapse serie.
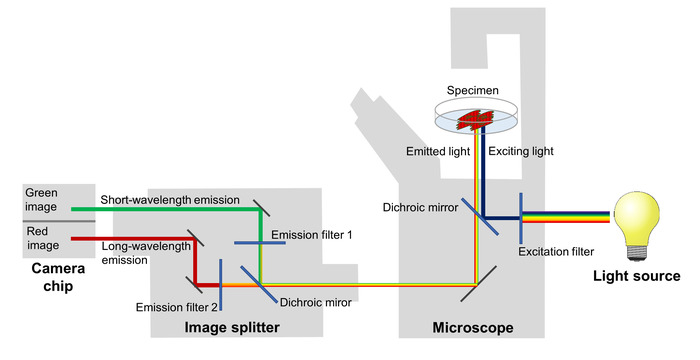
Figur 2: konfiguration av bildgivande systemet. De huvudsakliga komponenterna av bildgivande systemet brukade bild spektrala ändringarna av spänningskänsliga fluorescerande protein spegling membran potentiella ändringar på en temporal högupplöst skildras. Klicka här för att se en större version av denna siffra.
Uttrycket av VSFP-CR i CMs uppnås genom lentiviral transduktion. För direkt intresseanmälan till undertypen CM, innehåller lentivirus ett arrangören element (den MLC2v förstärkare) som specifikt driver transkription i ventrikulära-liknande iPSC-CMs10. När iPSC-CMs som representerar en blandning av förmaksflimmer-liknande, nodal-liknande och ventrikulära-liknande celler är sensorik med denna lentivirus, uttrycks VSFP-CR endast i ventrikulära-liknande celler. Eftersom den optiska aktionspotential imaging beror på denna fluorescerande sensor, representerar de inspelade handlingspänningar uteslutande CM subtyp av intresse (figur 3).
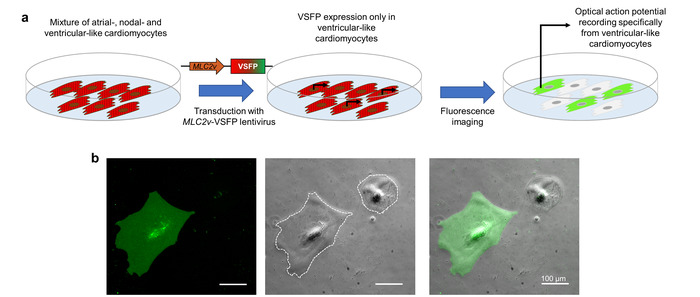
Figur 3: arrangören-driven VSFP uttryck för subtyp-specifika membran potentiella imaging. (pt) Detta schema visar hur hjärtmuskelcellen subtyp-specifika optiska aktionspotential inspelningar uppnås. (b) iPSC-CMs infekterade med en VSFP under kontroll av den ventrikulära-specifika MLC2v-förstärkare visas. Ett uttryck för spänningssensor observeras bara i ventrikulära-liknande CMs i GFP-kanalen (vänster). Faskontrast (mellersta panelen) och överlägg bild (höger panel) finns också. De vita streckade linjerna markerar cellgränserna. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Den metod som beskrivs här kan en optisk inspelning av APs från en specifik undertyp (dvs, ventrikulär-liknande celler) av CMs som genereras från iPSCs mänskliga. Mänskliga iPSC-CMs är ett framväxande verktyg att hantera en enorm mängd biologiska och medicinska problem och differentiering till CM subtyperna är en viktig källa till experimentella variabilitet. Genom att använda specifika promotorn element, uppnås specifikt uttryck för ett GEVI CMs som representerar subtyp av intresse, som sedan är …
Declarações
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöds av bidrag från den tyska forskningsfondens (Si 1747/1-1), den annan Kröner-Fresenius-Stiftung och Deutsche Stiftung für Herzforschung.
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
Referências
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

